基于染料Genefinder的荧光传感体系检测玉米赤霉烯酮
2021-06-07郭婷陈金航周鸿媛张宇昊马良
郭婷,陈金航,周鸿媛,张宇昊,马良
(西南大学 食品科学学院,重庆,400715)
玉米赤霉烯酮(zearalenone, ZEN)是由镰刀菌属真菌产生的一种毒素[1],广泛存在于玉米、小麦、大米等谷物、饲料和动物制品中。ZEN具有类雌激素作用,进而影响人体和动物的生殖系统[2-3]。此外,ZEN还具有免疫毒性、肝肾毒性及致癌性[4-5]。我国国标规定小麦及玉米中ZEN含量不超过60 μg /kg,饲料中ZEN含量不超过500 μg/kg。目前,食品中ZEN的检测方法有高效液相色谱法(high performance liquid chromatography,HPLC)[6-10]、免疫法[11-14]、生物传感器法[15-18]等。高效液相色谱法准确度和稳定性较高,但需要复杂的样品前处理及昂贵的仪器设备,不能满足食品安全快速检测的要求。免疫分析法具有高效、快速的特点,但其会出现假阳性问题,并且抗体的制备周期较长、稳定性差,限制了该方法的应用。
适配体是一种单链DNA或RNA,通过指数富集(systematic evolution of ligands by exponential enrichment,SELEX)系统筛选产生,能够与靶标进行特异性结合,稳定且易制备,在4 ℃条件下能保存半年甚至更久,不会影响其结构[19-21],目前已广泛应用于食品安全检测及疾病诊断方面。HE等[22]利用适配体的特异性构建基于内滤效应的荧光比率分析法检测ZEN和伏马毒素,该方法选择性高,实际样品加标回收率在89.9%~106.6%。ZHANG等[23]通过SELEX法筛选出ZEN适配体,并建立基于纳米金的无标记可视化方法检测ZEN。HE等[24]构建基于纳米材料和适配体的高灵敏的电化学传感方法成功用于ZEN检测,其中纳米材料(CoSe2/AuNRs和DNA-PtNi@Co-MOF)的主要作用是放大检测信号,该方法的检出限为1.37 fg/mL。另有新型3D樱花状金属有机框架材料也可用于电化学信号放大,该方法检出限可达0.45 fg/mL[25]。本课题组也开发了多种适配体荧光传感器检测黄曲霉毒素、展青霉毒素等真菌毒素[26-28]。
Genefinder染料是一种新型花青素类核酸染料,与双链DNA作用后荧光会增强800~1 000倍,毒性低、灵敏度高[29-30],可以有效保护实验人员和环境,常用于电泳中核酸染色[30-31],在检测方面的研究较少。因此,本研究利用核酸适配体的特异性,结合荧光染料Genefinder特殊的荧光特性构建荧光传感体系,用于简单、高灵敏、快速检测ZEN。
1 材料与方法
1.1 仪器与试剂
UV-2450紫外分光光度计,日本岛津公司;F-2500荧光分光光度计,日本日立公司;台式高速离心机,德国Eppendorf公司。
ZEN适配体(5′-TCATCTATCTATGGTACATTACTATCTGTAATGTGATATG-3′)[32],互补链(5′- TCAAATTAAAGATAATAATGTATTATAGAT-3′),生工生物工程(上海)有限公司;染料Genefinder,合肥博美生物科技有限责任公司;ZEN、黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素G1(aflatoxin G1,AFG1)、赭曲霉毒素A(ochratoxin A,OTA)、单端孢霉烯(T-2)毒素标准品,美国Sigma公司;玉米粉购于本地超市。
1.2 试验方法
1.2.1 DNA浓度测定
DNA浓度以单链浓度表示,利用紫外-可见分光光度计测定DNA在260 nm处的吸光度,依据朗伯比尔定律(A=εbc)计算得DNA的浓度,于-20 ℃备用。
1.2.2 荧光传感器对ZEN的检测
DNA备用溶液解冻后,水浴90 ℃处理10 min,逐渐冷却至室温备用。将ZEN适配体与等体积等浓度互补链混合,再加入一定浓度ZEN孵育一段时间后,加入2 μL Genefinder100×,测定荧光光谱(激发波长500 nm)。
1.2.3 实际样品中ZEN的检测
向玉米粉样品中加入一定量ZEN,分别配成质量浓度为5、20 μg/L的阳性样本。用90%(体积分数)乙腈水溶液超声提取30 min,离心后取上清液,氮吹吹干后加入缓冲溶液,按照构建的荧光传感体系检测ZEN。
2 结果与分析
2.1 检测原理
本研究利用Genefinder的特性构建荧光传感体系用于快速检测ZEN。检测原理图如图1-A,ZEN适配体与其互补链形成双链结构,Genefinder染料与双链结构DNA作用后产生较强的荧光,当加入毒素ZEN后,适配体优先识别ZEN,双链打开,Genefinder染料荧光猝灭。首先研究方法的可行性,以500 nm作为激发波长,观察不同条件下体系荧光信号的变化情况。图1-B显示单链适配体(a)及互补链(b)与Genefinder作用后显示出较微弱的荧光信号。ZEN适配体与其互补链形成双链结构,Genefinder染料与双链结构DNA结合后荧光信号明显增强(d),加入毒素ZEN后,适配体与ZEN结合,双链打开,Genefinder染料荧光强度降低(e)。根据荧光强度的改变检测目标物ZEN的含量。

a-ZEN适配体+Genefinder;b-互补链+Genefinder;c-40 μg/L ZEN;d-ZEN适配体+互补链+Genefinder;e-ZEN适配体+互补链+40 μg/L ZEN+GenefinderA-传感体系的检测原理图;B-不同条件下荧光光谱图1 传感体系原理图及可行性分析Fig.1 Schematic of sensing system and feasibility
2.2 检测条件优化
2.2.1 孵育时间
实验中适配体需要与目标物孵育一段时间才能更好地识别目标物。因此本试验研究孵育时间对荧光信号的影响。如图2所示,随着孵育时间的延长,荧光猝灭量逐渐增强,当孵育时间60 min时,荧光猝灭量达到最大,说明体系中ZEN适配体与ZEN结合已达到饱和。因此,本实验选择60 min为最佳孵育时间。
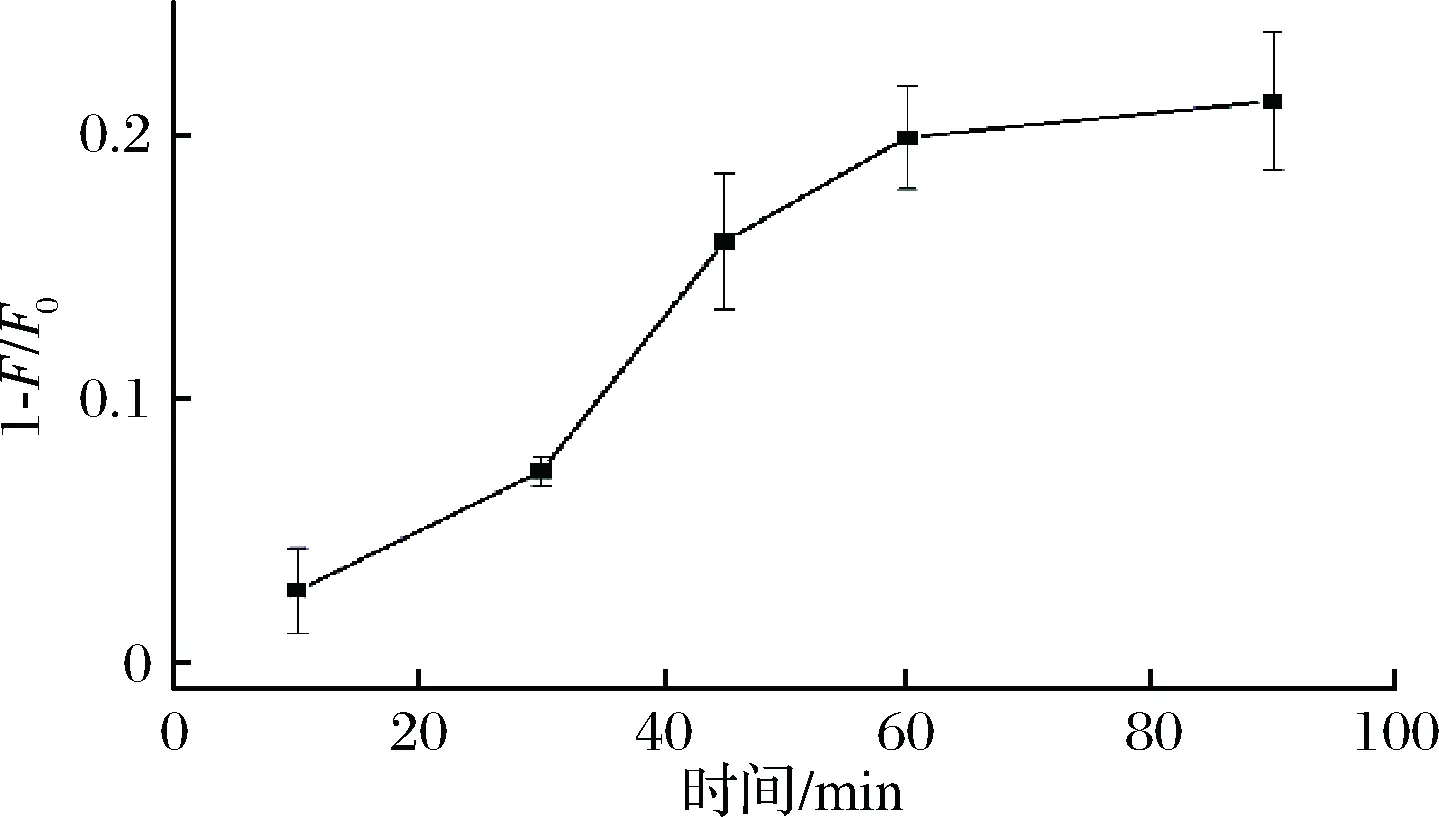
图2 孵育时间对荧光强度的影响Fig.2 Effect of incubated time on the fluorescence注:F0和F分别表示没有目标物和添加目标物时的荧光强度(下同)
2.2.2 适配体用量
适配体用量会影响荧光传感体系的灵敏度。图3显示适配体浓度对荧光传感体系的影响。结果表明,随着ZEN适配体用量的增加,荧光猝灭程度迅速增加,当适配体浓度达到100 nmol/L时,荧光猝灭量趋于稳定。因此,适配体用量选择100 nmol/L作为后续实验用量。

图3 适配体用量对荧光强度的影响Fig.3 Effect of aptamer on the fluorescence
2.3 荧光传感体系的构建
在上述最佳的实验条件下,以ZEN为目标物构建荧光传感体系。结果如图4-A所示,随着ZEN浓度的增加,传感体系荧光强度逐渐减弱,这是由于ZEN的加入破坏了双链结构,从而造成荧光减弱。然而当ZEN浓度达到一定值时,荧光强度不再明显降低,达到平衡。从图4-B可以看出,1-F/F0与ZEN浓度的对数在0.1~200 μg/L呈线性关系,实际可检测的检出限为0.1 μg/L。结果表明该荧光传感体系具有较高的灵敏度。
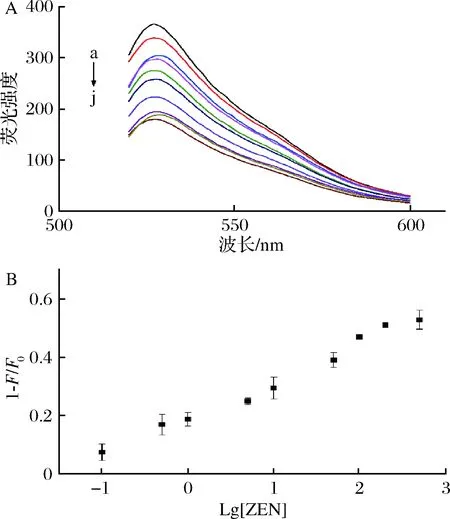
a-0 μg/L;b-0.1 μg/L;c-0.5 μg/L;d-1 μg/L;e-5 μg/L;f-10 μg/L;g-50 μg/L;h-100 μg/L;i-200 μg/L;j-500 μg/LA-不同浓度ZEN对所构建传感体系荧光响应变化;B-1-F/F0与ZEN浓度对数的线性关系图4 传感体系对ZEN的荧光响应Fig.4 Fluorescence resptnse of sensor with ZEN
2.4 荧光传感体系选择性
为了考察荧光传感体系的选择性,本研究以黄曲霉毒素B1(AFB1)、黄曲霉毒素G1(AFG1)、赭曲霉毒素A(OTA)、单端孢霉烯毒素(T-2)为对照毒素研究该传感体系的特异性,结果如图5所示。加入40 μg/L ZEN时,荧光传感体系的荧光强度猝灭量显著增加,而加入同浓度的对照毒素并未造成荧光体系明显的荧光猝灭,这是因为传感体系中使用的适配体与ZEN可以特异性结合,而与其他毒素无明显作用。结果表明该传感体系对ZEN具有较好的选择性。

图5 方法选择性Fig.5 Selectively of sensing system注:ZEN质量浓度为40 μg/L,其他对照毒素质量浓度均为40 μg/L
2.5 实际样品测定
为了考察传感体系实际测定效果,以玉米粉作为实际阴性样品,研究加标回收情况。结果如表1所示,利用传感体系检测的加标回收率在100.4%~105.8%,这说明该荧光传感体系可用于真实复杂样品中ZEN的测定。
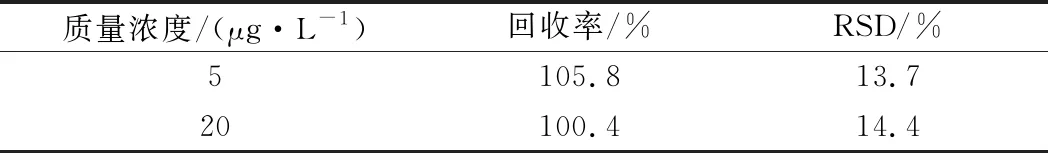
表1 实际样品加标回收率(n=3)Table 1 Real sample spike recovery (n=3)
3 结论
本研究构建了一种基于Genefinder和适配体的荧光传感体系检测ZEN,在最优条件下,传感体系的线性范围为0.1~200 μg/L,实际检出限为0.1 μg/L,并成功用于出玉米粉中ZEN的测定,加标回收率在100.4%~105.8%。本方法为开发简单、快速、灵敏的生物传感体系开辟了新的途经。
