绿茶加工中主要脂溶性色素变化及其对茶叶色泽品质的影响
2021-06-07舒娜汪蓓欧阳珂孟庆童华荣
舒娜,汪蓓,欧阳珂,孟庆,童华荣
(西南大学 食品科学学院,重庆,400715)
干茶色泽是绿茶的第一感官因子[1],也是茶叶加工过程中评定在制品质量的重要参考依据。脂溶性色素是绿茶干茶色泽的主要物质基础,主要包括叶绿素和类胡萝卜素[2]。叶绿素属吡咯类绿色色素,是影响绿茶干茶绿色色泽的重要成分[3]。类胡萝卜素是指一类具有黄色到橙红色的多种有色化合物,是构成干茶黄色色泽的主要因子[4],同时对茶叶的香气品质有积极影响[5]。目前茶叶中已发现41种叶绿素和38种类胡萝卜素[6],但由于缺乏有关脂溶性色素组分与绿茶干茶色泽的相关性研究,难以表征各色素组分对干茶色泽品质的作用。
目前测定茶叶中脂溶性色素的方法有分光光度法[7]、薄层色谱法[8]和液相色谱法[9]等。分光光度法定量准确性和灵敏度偏低[10],薄层色谱法鉴定的色素组分有可能是混合物且耗时久[11],目前多采用高效液相色谱法检测茶叶中脂溶性色素[6,9,12]。但国内用于检测茶叶中脂溶性色素的方法大多存在分离效果不够理想,可测定色素种类少等问题[12-13]。ZAPATA等[14]通过使用C8反向色谱柱,并在流动相中添加吡啶/醋酸溶液以改善峰形所建立的脂溶性色素分析方法具有分离度好,可鉴定组分多等优点,国际上对其应用日益增多[15-17],但在国内的茶学领域应用尚不广泛[18]。
加工工艺对绿茶脂溶性色素的影响较大[1]。研究表明,绿茶加工中脂溶性色素在酶、热和机械外力等因素的作用下发生降解,生成一系列叶绿素和胡萝卜素的衍生物[11]。杀青是形成绿茶“清汤绿叶”品质的关键工序,同时也是叶绿素降解形成脱镁叶绿素最显著的阶段[19]。揉捻对条形绿茶的叶绿素含量影响不大[20],但增加揉捻压力和次数会增大叶绿素的破坏率[21]。类胡萝卜素含量在绿茶加工过程中显著下降,特别是经杀青和干燥后降幅分别达到52%和67%[6]。干燥方式对脂溶性色素影响较大,冷冻干燥和微波干燥处理有利于减少绿茶叶绿素和β-胡萝卜素等脂溶性色素的损失[12]。提香是绿茶加工中提升茶叶香气品质的重要工序[19,22],但在提高香气的同时,较难保证绿茶“三绿”的色泽品质要求[23]。目前鲜见有关提香工序对脂溶性色素组分及干茶色泽影响的研究。
本研究采用高效液相色谱-二极管阵列检测器 (high performance liquid chromatography with photodiode array detection, HPLC-PDA) 对绿茶加工过程中在制品的脂溶性色素进行测定,同时采用色差仪监测在制品外观色泽的变化,旨在阐明脂溶性色素在绿茶加工中的变化规律及其与干茶色泽的内在联系,探究影响绿茶色泽的关键色素成分,为绿茶色泽品质的调控提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 材料与试剂
茶鲜叶原料:巴渝特早,一芽一叶,2018年9月采于重庆市巴南区。
黄体素(98%)、玉米黄素(98%)、β-胡萝卜素(98%),上海源叶生物科技有限公司;叶绿素a(90%)、叶绿素b(90%),上海迈瑞尔化学技术有限公司;脱镁叶绿素a(95%),美国Frontier Scientific公司;丙酮、甲醇、乙腈、无水吡啶、冰乙酸,均为色谱纯,成都市科龙化工试剂厂。
1.1.2 仪器与设备
M20A高效液相色谱仪,日本岛津公司;Ultra Scan PRO测色仪,美国 Hunter Lab 公司;雷磁pHS-25型pH计,上海仪电科学仪器股份有限公司;5810R冷冻离心机,德国艾本德公司。
1.2 试验方法
1.2.1 样品制备
鲜叶原料加工成绿茶毛茶的工艺如下:
摊青(室温,10 h)→杀青(320 ℃,1 min)→揉捻(室温,空压10 min-轻压10 min-重压30 min-轻压10 min)→干燥(110 ℃,20 min)
加工过程样采用液氮固样,冷冻干燥后粉碎过40目筛密封。样品均置于-40 ℃冰箱保存备用,每个样品重复取样3次。
选取生产上常用的3个提香温度,即80、100、120 ℃对绿毛茶进行提香处理,其中80 ℃提香,每隔60 min取样,共计6次,样品分别编号T101、T102、T103、T104、T105、T106;100 ℃提香每隔45 min取样,共计6次,样品分别编号T201、T202、T203、T204、T205、T206;120 ℃提香每隔30 min取样,共计6次,样品分别编号T301、T302、T303、T304、T305、T306。提香制得的样品粉碎过40目筛后装入密封袋,置于-40 ℃冰箱保存备用,每个样品重复取样3次。
1.2.2 色素提取与HPLC分析条件
准确称取0.100 g样品于预先冷却的研钵中,加入80% 丙酮水溶液(-4 ℃)2 mL研磨至匀浆状,经冷冻离心(-20 ℃,4 000 r/min,10 min)后转移上清液。重复上述操作,合并上清液,定容至5 mL,过0.45 μm有机膜,注入样品瓶待测。HPLC分析条件参考文献ZAPATA等[14]、邓春梅等[24]的方法,并根据实际情况做适当修改。色谱柱:Waters C8柱(150 mm×4.6 mm,3.5 μm);流动相A:V(甲醇)∶V(乙腈)∶V(吡啶/醋酸溶液)=50∶25∶25;流动相B:V(甲醇)∶V(乙腈)∶V(丙酮)=20∶60∶20;吡啶/醋酸溶液的配制如下:20 mL吡啶溶于900 mL超纯水,缓慢滴加醋酸直到pH值变为5.0,随后用超纯水定容到1 L;流速为1 mL/min,柱温箱温度25 ℃;梯度洗脱程序:0-22-28-38-40 min,0%B-40%B-95%B-95%B-0% B;进样体积:10 μL:检测波长340~740 nm。
1.2.3 色素组分定性定量分析
参考SUZUKI等[6]及陈丽等[18]的试验结果中的保留时间和特征吸收波长对色谱峰进行定性,采用外标法进行定量,标准曲线如表1所示。各组分在430 nm 处均有一定强度的吸收峰,因此采用430 nm下的峰面积进行定量计算。由于茶叶脂溶性色素种类繁多且大部分色素没有商品化标准品出售,在本试验中没有标品的组分根据文献[18,25]报道的替换计算方法进行定量,即叶绿素a异构体用叶绿素a标准曲线定量,叶绿素b异构体用叶绿素b标准曲线定量,其余无标品的叶绿素组分及类胡萝卜素组分分别根据脱镁叶绿素a和黄体素的标准曲线定量。

表1 色素标准曲线Table 1 Standard curve of pigments
1.2.4 干茶色差的检测
采用L*-a*-b*表色系。取40目下的样品粉末, 用测色仪测定其L*、a*、b*,每个样品重复测定3次。
1.2.5 数据分析
采用SPSS 25.0进行单因素和多因素方差分析;采用SIMCA 14.1进行偏最小二乘分析;采用Origin 2019作图。
2 结果与分析
2.1 脂溶性色素组分检测结果
26个样品经HPLC-PDA检测分析后共得到脂溶性色素成分28种(表2),其中叶绿素12种,类胡萝卜素16种,与其他液相色谱检测方法[9,12]相比,此方法分离出了茶叶中更多的脂溶性色素组分。由于自然界中叶绿素及类胡萝卜素的种类繁多,且存在多种同分异构体,本试验中检测到的色素组分特征吸收波长相近,未能确定全部检出色素的具体结构。其中,未确定具体结构的叶绿素及类胡萝卜素分别用字母Y及C表示。

表2 叶绿素和类胡萝卜的特征吸收波长Table 2 Characteristic absorption wavelengths of chlorophylls and carotenoids
2.2 脂溶性色素在绿茶加工中的变化
叶绿素组分在毛茶加工中的变化如图1所示。鲜叶中检出Y1、Y2、叶绿素a和叶绿素b 4种叶绿素。摊放后新检出叶绿素a′及脱镁叶绿素a,杀青后新增组分包括叶绿素b′、脱镁叶绿素a′、Y3、Y4及Y5。叶绿素总量在加工过程中呈下降趋势,相较鲜叶,在制品叶绿素总量经摊青、杀青、揉捻及干燥后分别降低3.21%、9.73%、10.08%及13.73%。其中,叶绿素a(蓝绿色)和叶绿素b(黄绿色)是茶鲜叶中2种主要的天然色素[2],含量分别为335.61和146.41 μg/g,共占茶鲜叶叶绿素总量的92.3%。相较鲜叶,在制品叶绿素a和b的总量经摊青、杀青、揉捻及干燥后分别降低16.12%、37.98%、39.38%及53.50%。这是由于在温度、水分及外力等因素的影响下,叶绿素a和b发生脱镁、水解和氧化反应[19]导致其含量降低。叶绿素发生脱镁反应产生的脱镁叶绿素呈现黑褐色泽,被认为是造成茶叶发黑的主要物质[26]。本研究中检出2种脱镁叶绿素,即脱镁叶绿素a及脱镁叶绿素a′。摊青叶中脱镁叶绿素总量为11.29 μg/g,经杀青、揉捻及干燥后其含量分别增加30.64%、37.08%及57.38%。因此,可知在绿毛茶加工过程中杀青和干燥工序是叶绿素a和b大量降解、脱镁叶绿素迅速形成和积累的主要阶段。

图1 叶绿素在绿毛茶加工过程中的变化Fig.1 Trends of chlorophylls in green tea during processing注:图中不同小写字母表示样品间差异显著(P<0.05)(下同)
在毛茶加工过程中,类胡萝卜素组分的变化如图2所示。鲜叶中共检出14种类胡萝卜素,其中黄体素含量最高(231.60 μg/g),其次是堇黄素(115.84 μg/g)和新黄素(64.36 μg/g)。由于类胡萝卜素性质不稳定,在热、光、氧等因素影响下易发生热裂解和光解等反应[10],各类胡萝卜素组分在绿茶加工中发生不同程度的降解。与叶绿素相似,杀青和干燥工序是类胡萝卜素含量下降最为显著的2个阶段。相较于鲜叶,类胡萝卜素总量经杀青及干燥后分别降低27.80%和35.10%。其中,杀青后降幅最大的是C1(47.75%),其次是玉米黄素(45.18%),堇黄素(39.79%)和C9(38.93%)。干燥后堇黄素降幅最高,达95.55%,此外,环氧玉米黄素、新黄素、C8和C9降幅均高于55%。鲜叶中含量最高的黄体素在各加工工序中无显著性变化,干燥后其含量仅减少3.24%。

图2 类胡萝卜素在绿毛茶加工过程中的变化Fig.2 Trends of carotenoids in green tea during processing
3个不同提香温度处理下,在制品脂溶性色素种类及含量的变化过程如图3所示。色素种类在提香过程中发生显著变化,提香样中未检出环氧玉米黄素、C1、C5、C6及C8。在T1和T2处理中,新黄素、堇黄素、C2及C9随提香时间的延长逐渐消失,T3中未检出上述四类色素,新检出原焦脱镁叶绿酸a、C14和C15,其含量随提香时间的延长呈上升趋势。在同一提香温度下,在制品叶绿素和类胡萝卜素总量随提香时间的延长均呈下降趋势。提香180 min后,T1、T2和T3处理中叶绿素总量较毛茶样(提香0 min)分别减少9.21%、11.22%及33.11%,其中叶绿素a和b的总量分别较少38.17%、44.35%及59.78%,而脱镁叶绿素总量分别增加34.22%、37.48%及67.82%。类胡萝卜素总量分别减少12.52%、16.92%、33.48%,其降解产物可能参与绿茶香气品质的形成[10,19]。

a-叶绿素组分;b-类胡萝卜素组分图3 叶绿素和类胡萝卜在绿茶提香过程中的变化Fig.3 Trends of chlorophylls and carotenoids in green tea during baking
采用多因素方差分析探究提香温度、提香时间及其交互作用对提香中在制品脂溶性色素含量的影响,结果见表3。由表3可知,提香温度和时间对所分析的15种色素含量均有极显著影响(P<0.01)。提香温度和时间的交互作用除对C2、玉米黄素及β-胡萝卜素的含量无显著影响外,对其余色素含量的影响均达到显著或极显著水平。从F值来看,提香温度对各色素含量的影响程度均大于提香时间、提香温度和时间交互作用的影响程度。
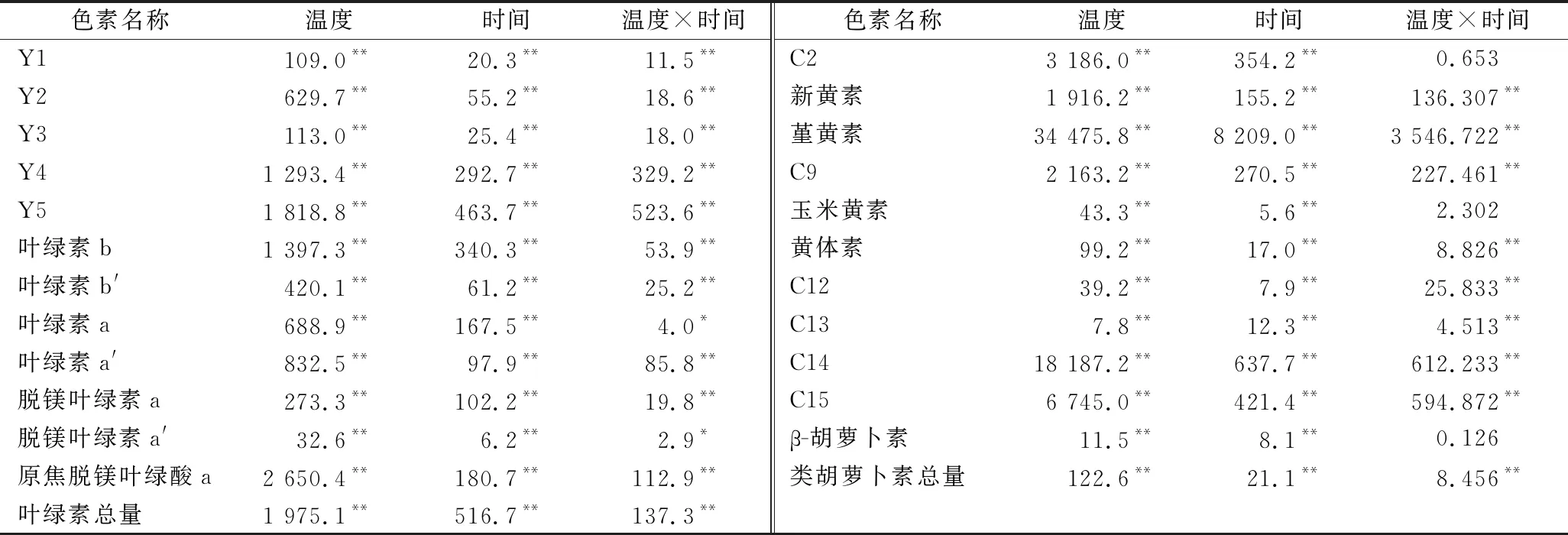
表3 绿茶提香过程中脂溶性色素的多因素方差分析结果Table 3 Multivariate ANOVA of lipophilic pigments in green tea during baking
2.3 在制品色度值在绿茶加工中的变化
干茶色度值在绿毛茶加工过程中的变化如图4所示。L*代表亮度,在毛茶加工过程中L*呈下降趋势,其中摊青和干燥处理后L*显著降低,在制品色泽明显变暗。揉捻后在制品亮度略有增加,可能与在制品的水分重新分布及内含物质穿透至表面有关[21]。a*代表红绿度,正值代表颜色偏红,负值代表颜色偏绿。在毛茶加工中a*保持负值,且呈现上升趋势,表明在制品色泽以绿色为主,但绿色色泽逐渐削弱,干燥后a*变化幅度最大。b*代表黄蓝度,正值代表颜色偏黄,负值代表颜色偏蓝。在毛茶加工中b*的变化规律与L*的较为一致,在制品表现为黄度降低。

图4 在制品色度值在绿毛茶加工过程中的变化Fig.4 Trends of colorimetric values in green tea during processing
3个不同提香温度处理下,在制品L*、a*和b*的变化过程见图5。由图5可知,在同一提香温度下,随着时间的延长,L*呈下降趋势,a*呈上升趋势,b*则在80 ℃中呈波动下降趋势,100 ℃中呈现先波动下降后波动上升的变化趋势,120 ℃中呈波动上升趋势。而在不同提香温度下,整体上L*表现为80 ℃>100℃>120 ℃,a*和b*表现为80 ℃<100 ℃<120 ℃,表明随着提香温度的升高,在制品的亮度降低,绿色色泽减弱,黄色色泽增强。采用多因素方差分析进一步研究提香温度、提香时间及其交互作用对在制品色度值的影响,结果如表4所示。由表4可知,提香温度和时间对L*、a*及b*均有极显著影响。温度与时间的交互作用对L*和a*的影响达极显著水平,而对b*无显著影响。从F值来看,提香温度对a*和b*的影响程度大于提香时间及温度和时间的交互作用,提香时间对L*的影响程度略大于提香温度的影响程度。

表4 绿茶提香过程中在制品色度值的多因素方差分析结果Table 4 Multivariate ANOVA of colorimetric values in green tea during baking
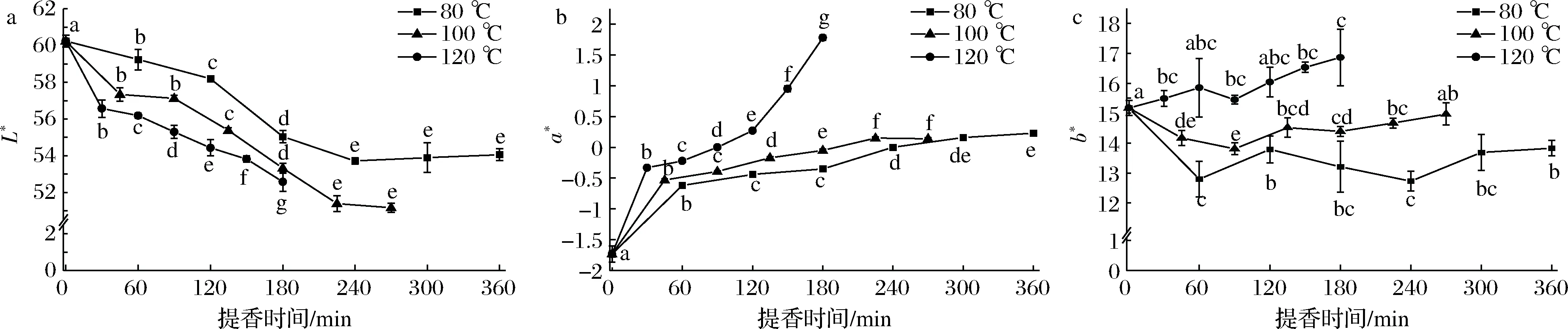
a-L*;b-a*;c-b*图5 干茶色度值在绿茶提香过程中的变化Fig.5 Trends of colorimetric values in green tea during baking
2.4 在制品色泽与关键色素组分的相关性分析
根据色度值与脂溶性色素组分含量建立偏最小二乘回归模型,分析色素组分与在制品色泽的相关性,并采用偏最小二乘回归-变量投影重要性法(partial least squares regression-variable importance for projection, PLSR-VIP)筛选出影响绿茶色泽的关键色素组分[27]。以检出的28种脂溶性色素含量为自变量X,各样品的色度值为因变量Y。依次作3个因变量Y的偏最小二乘回归,选择因变量解释度>80%的因子计算各自变量的VIP值。选择VIP值>1的变量作为关键变量,优化偏最小二乘回归模型,并计算各关键变量与因变量的加权回归系数,回归系数的大小的绝对值与相关性成正比,选取回归系数绝对值>0.1 的关键变量为显著相关物质[28]。
通过模型所包含的X和Y矩阵信息的百分比及预测能力三方面对所建模型进行评价[29]。如表5所示,3个模型中的前2个主成分分别包含自变量X的信息均>90%,对因变量Y的解释度均>82%,模型预测能力均>77%,说明这些色素组分与色度值间关系密切,且PLSR法能够较好预测二者间的关系。在亮度L*模型,有15个色素组分的VIP值>1,其中叶绿素b、C6、叶绿素a、C5和新黄素与L*呈显著正相关,回归系数均>0.15。与L*呈显著负相关的组分有脱镁叶绿素a及Y3,回归系数均<-0.1,说明随着脱镁叶绿素a及Y3含量的增加,在制品亮度降低,叶色发暗。在红绿度a*模型中,VIP值>1的色素组分有14个,其中仅有脱镁叶绿素a′和Y3与a*呈正相关。与a*呈显著负相关的主要成分有Y1、叶绿素b和叶绿素a,回归系数均<-0.1,说明当Y1、叶绿素b和叶绿素a含量越高时,a*越小,在制品绿色色泽越强,这与孙婵骏[30]研究结果一致。在黄蓝度b*模型中,VIP值>1的色素组分有15个,其回归系数的绝对值较为接近,为0.057~0.067。其中回归系数为正值的有堇黄素、环氧玉米黄素、新黄素、叶绿素a、C1、C5、C6和C8,表明在制品的黄色色泽可能是多个类胡萝卜素综合作用的结果。
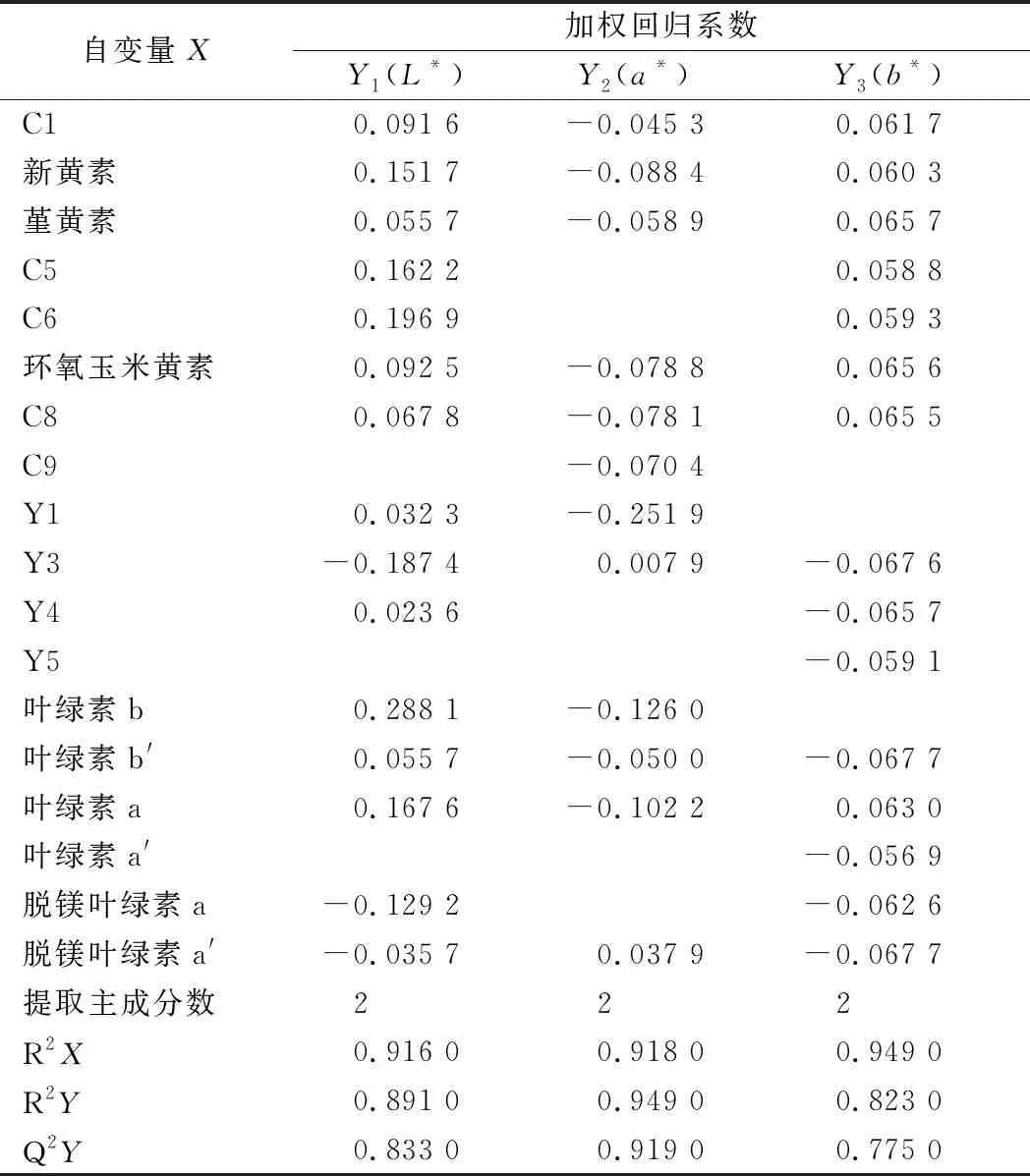
表5 脂溶性色素在色度值PLSR模型中的加权回归系数Table 5 Estimated regression coefficients from PLSR models of chromatic values
3 结论
本研究通过对绿茶加工过程中在制品脂溶性色素的变化分析,发现在制品的叶绿素种类在杀青后显著增加,类胡萝卜素种类在提香过程中逐渐减少,叶绿素总量及类胡萝卜素总量在加工中均呈下降趋势。其中,在杀青和干燥工序中,高温作用破坏了叶绿体结构,叶绿素从蛋白体中释放出来[2],使呈绿色色泽的叶绿素大量降解,呈黑褐色泽的脱镁叶绿素迅速生成并积累,同时呈黄色色泽的类胡萝卜素在高温下发生裂解[10],含量显著降低,导致在制品亮度显著降低,绿色及黄色色泽显著减弱。在提香工序的持续热作用下,叶绿素a、叶绿素b和类胡萝卜素进一步损失,脱镁叶绿素持续积累,在制品色泽逐渐变暗。多因素方差分析结果表明,提香温度对各脂溶性色素含量、a*及b*的影响程度明显大于提香时间的影响程度。因此,在加工中合理选择杀青、干燥及提香温度,严格控制在制品叶温,以减少叶绿素等脂溶性色素的大量损失,是达到绿茶“三绿”品质要求的有效途径。
本研究基于PLSR-VIP法对28种脂溶性色素含量与在制品色度值的相关性进行分析,结果表明影响在制品L*、a*和b*的主要色素组分分别为15种、14种和15种。其中,与L*呈显著正相关的色素为叶绿素b、C6、叶绿素a、C5和新黄素,呈显著负相关的色素为脱镁叶绿素a及Y3。与a*呈正相关的色素为脱镁叶绿素a′及Y3,呈显著负相关的色素为Y1、叶绿素b和叶绿素a。与b*呈正相关的色素组分包括7种类胡萝卜素和1种叶绿素,表明在制品黄色色泽可能受多种类胡萝卜素含量的影响。但在加工过程中多酚类氧化产物、美拉德反应产物等的形成均会对干茶色泽产生一定影响[31-32],后续可对这部分物质对干茶色泽的作用做进一步研究。
