蛋白A免疫吸附治疗自身免疫脑炎疗效的回顾性分析
2021-06-07王玉鸽马晓宇杨渝常艳宇李蕊陈小东张炳俊余波光陆正齐胡学强邱伟舒崖清
王玉鸽 马晓宇 杨渝 常艳宇 李蕊 陈小东 张炳俊 余波光 陆正齐 胡学强 邱伟 舒崖清
自身免疫脑炎(AE)是机体对神经元抗原成分的异常免疫反应所致的中枢神经系统疾病,其主要临床特点表现为急性或亚急性的精神症状、认知行为障碍、癫痫、不自主运动或自主神经功能紊乱等[1]。抗N-甲基-D-天冬氨酸受体(NMDAR)脑炎是AE最常见的一种类型,此外AE还包括由富含亮氨酸胶质瘤失活蛋白1(LGI1)、γ-氨基丁酸B型受体(GABABR)、IgLON5、接触蛋白相关蛋白2(CASPR2)等抗体介导的相关抗体脑炎[2-3]。目前有关AE的病因不明,认为其与感染、肿瘤有关[4]。因此,对于合并肿瘤的AE患者,需尽快行肿瘤切除。AE急性期的治疗手段不多,主要包括大剂量糖皮质激素冲击、丙种球蛋白冲击、血浆置换[5]。由于目前血浆紧缺,从而限制了血浆置换在临床中的应用。最近研究表明免疫吸附(immunoadsorption)可用于治疗AE[6-7],但国内相关研究报道较少。该研究通过对近两年在作者医院行蛋白A免疫吸附治疗的AE患者的疗效进行回顾性分析,旨在为免疫吸附治疗AE的治疗提供经验。
1 对象和方法
1.2 对象回顾性收集2019年1月至2020年11月在中山大学附属第三医院神经科住院的24例AE患者,其中抗NMDAR阳性20例,抗GABABR阳性2例,抗IgLON5抗体1例,以及抗LGI1抗体1例。患者均符合文献[8]报道的有关AE诊断标准。经激素冲击1疗程和(或)丙球冲击1疗程后无反应的患者采用蛋白A免疫吸附柱(KONPIA®,广州康盛生物)行3~10次吸附治疗,如为畸胎瘤患者则于肿瘤切除1周后视病情需要进行。该研究通过中山大学附属第三医院的伦理委员会审批,且获得患者及家属知情同意。
1.2 方法评估患者免疫吸附前后改良Rankin量表评分(mRS),检测患者脑脊液及免疫指标变化,观察免疫吸附治疗相关不良反应。于第1次免疫吸附前及最后1次吸附治疗后分别留取血及脑脊液,采用细胞转染法(CBA法)检测血和脑脊液抗NMDAR-Ab、GABABR-Ab、IgLON5-Ab、LGI1-Ab,试剂盒为欧蒙公司产品(Euroimmun Medizinische Labordiagnostika,Lübeck,Germany)。血IgG水平及补体C3、C4水平,脑脊液细胞数及蛋白水平检测均由中山大学附属第三医院检验科完成。
1.3 统计学处理采用SPSS 16.0软件进行数据分析,符合正态分布的计量以均值±标准差表示,两均数比较采用t检验;非正态分布的计量资料以中位数(最小值,最大值)表示,采用Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料24例患者中男11例,女13例,年龄15~63岁,中位年龄28岁。免疫吸附次数3~10次,中位数为6次,24例患者共行151次吸附治疗。7例患者有畸胎瘤并行手术切除术史。
2.2 疗效比较
2.2.1全部AE患者疗效:结果见图1。经免疫吸附治疗后,21例(87.5%)患者mRS评分至少下降1分,3例抗NMDAR脑炎(12.5%)患者mRS无变化。24例患者免疫吸附治疗前后mRS评分中位数分别为4分和2分,治疗前后比较差异有统计学意义(P=0.000)。免疫吸附后血IgG水平(P=0.000)、血(P=0.006)和脑脊液AE相关抗体滴度(P=0.000)、脑脊液细胞数(P=0.002)及血补体C3(P=0.000)、C4水平(P=0.0373)均较治疗前降低,而免疫吸附治疗前后脑脊液蛋白水平比较无统计学差异(P=0.3921)。
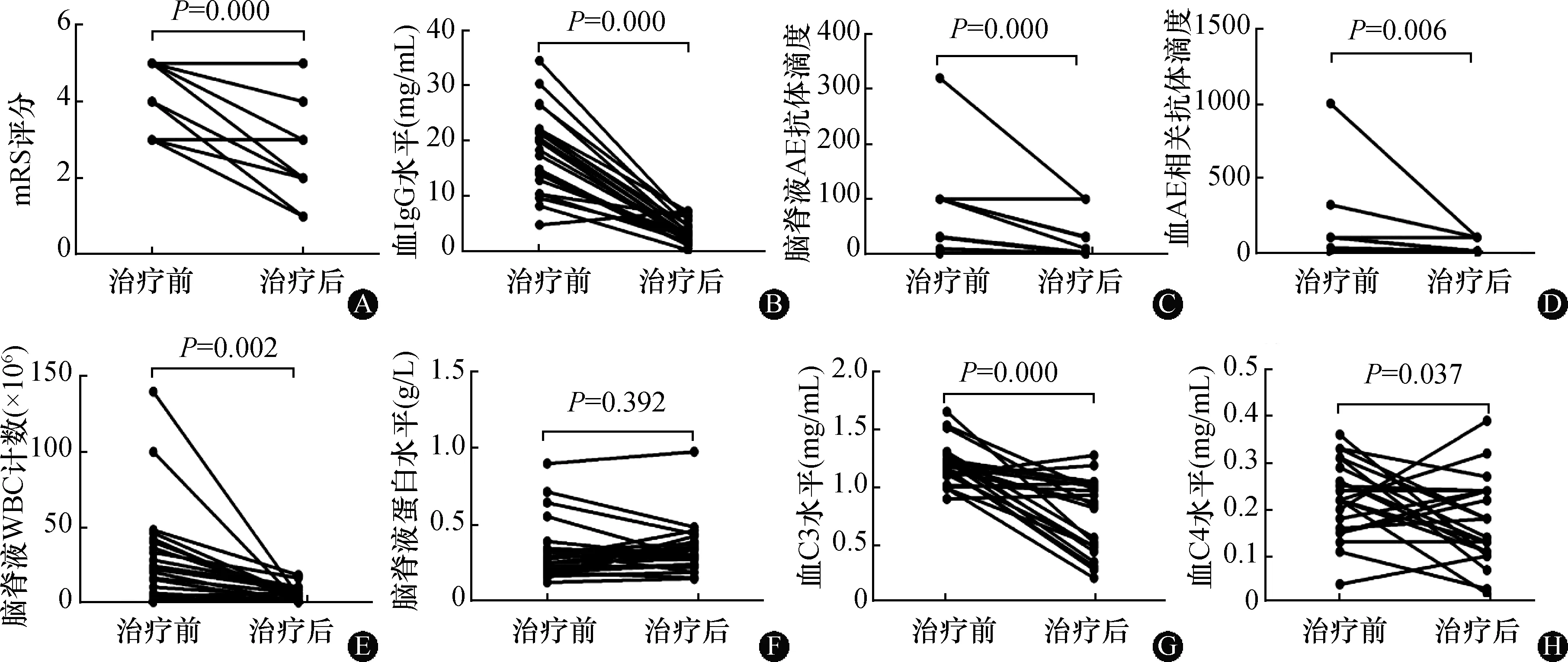
注:AE:自身免疫性脑炎;mRS:改良Rankin量表评分;图2同。WBC:白细胞
2.2.2抗NMDAR脑炎疗效:抗NMDAR脑炎患者免疫吸附治疗后其mRS(P=0.000)、血NMDAR抗体滴度(P=0.000)、脑脊液NMDAR抗体滴度(P=0.007)较治疗前均降低。结果见图2。
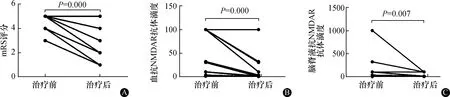
图2 抗NMDAR脑炎患者免疫吸附前后mRS评分(A)及血(B)和脑脊液(C)抗NMDAR抗体滴度变化
2.3 不良事件24例患者在吸附治疗过程中出现不良反应3例(12.5%),其中低血压2例(8.3%),心率加快1例(4.2%)。在151例次的吸附治疗过程中,不良反应发生3例次(2.0%),其中低血压2例次(1.3%),心率加快1例次(0.7%)。经对症处理后患者均完成了吸附疗程。
3 讨论
AE是由体内致病抗体介导的自身免疫紊乱。因此,理论上清除这些致病抗体可达到治疗的目的。研究表明,免疫吸附可用于AE的治疗[6,9-10]。2015年Kohler等[10]报道了13例AE患者(包括抗NMDAR、GABABR、GAD、LGI1抗体)经吸附治疗后平均mRS从3分降为2分。Dogan等[9]报道了19例经免疫吸附治疗的AE患者(3例抗LGI1相关脑炎,4例抗CASPR2相关脑炎,7例抗NMDAR脑炎,5例抗GAD相关脑炎),结果显示,14例AE患者(抗LGI1、CASPR2、NMDAR抗体相关脑炎)中9例临床评分好转,随访发现14例AE患者中有12例患者(85.7%)临床评分进一步改善。该研究结果表明,24例AE患者中21例(87.5%)临床mRS评分明显下降,表明蛋白A免疫吸附可有效改善AE的临床疾病程度,与既往研究结果一致[9-10]。
免疫吸附的吸附柱对IgG不同亚类的亲和力并不相同[11],决定了其对不同类型抗体吸附效果的不同。该研究中所使用的蛋白 A 吸附柱的亲和力依次为IgG1= IgG2=IgG4>IgG3。AE相关抗体中的抗NMDAR抗体为IgG1,抗GABAR为IgG1,抗LGI1为IgG4,IgLON5为IgG4和IgG1类[2-3]。因此,蛋白 A免疫吸附理论上可有效清除上述抗体。该研究结果亦表明,AE患者经免疫吸附治疗后,不仅总体血清IgG下降,而且脑脊液及血液中的特异性抗体也下降;此外,血补体C3、C4水平亦下降。作者团队既往研究发现血C4水平与抗NMDAR脑炎的疾病程度正相关[12]。由此可推断,蛋白A免疫吸附通过降低致病抗体及补体水平以改善疾病程度。
关于免疫吸附的安全性总体较好,其原因在于免疫吸附无外源性物质的输入导致的不耐受或血流动力学的变化[13]。该研究显示免疫吸附治疗的不良反应较轻,24例患者共151例次的治疗中仅3例出现低血压或心率加快反应,经补液等对症处理均可改善,并最终完成吸附治疗。
综上所述,该研究结果显示,蛋白A免疫吸附治疗可有效改善AE的临床症状评分,降低致病抗体滴度以及脑脊液炎性反应及血补体水平,且患者总体耐受性较好。该研究不足之处:(1)仅以mRS评分评价临床表现改善,不够全面,未来研究需分析治疗对通气障碍、癫痫、精神症状等影响。(2)纳入患者为对一线治疗反应不佳的患者,免疫吸附前有糖皮质激素、丙种球蛋白治疗,由于缺乏对照组,尚不能排除免疫吸附前期治疗对疗效判断的干扰。(3)为回顾性研究,未能对免疫吸附次数同质化,而免疫吸附次数可能与治疗效果有关。因此,有关免疫吸附治疗AE的确切疗效尚需进一步研究验证。
