剥离-重堆积法制备TiO2/HNbMoO6复合材料
2021-06-05徐向前崔艳丽郭宪吉
徐向前,崔艳丽,郭宪吉,2*
(1.郑州大学 化学学院,郑州 450001; 2.郑州大学 绿色催化研究中心,郑州 450001; 3.漯河食品职业学院 食品检测系,河南 漯河 462300)
以层状过渡金属氧化物为主体合成的功能复合材料因在吸附、催化、光、电、磁等领域表现出优良的性能而备受青睐[1-6].由于层状过渡金属氧化物固有的特征(层板带负电,层间存在可交换的阳离子),因此可以将一些无机聚合阳离子引入到层状过渡金属氧化物的层间,形成插层材料,经高温焙烧后获得无机氧化物柱撑的层状过渡金属氧化物[7].众所周知,二氧化钛是典型的半导体氧化物,可用于光催化分解水产氢[8].由于它具有无毒、高稳定性、成本低廉等优良特征,在众多半导体光催化材料中脱颖而出.层状过渡金属氧化物也是具有潜在光催化性能的半导体化合物,因而以二氧化钛柱撑层状过渡金属氧化物乃是一项具有重要实际意义的研究课题.本研究团队曾用逐步离子交换途径制得二氧化钛柱层状钽钼酸(TiO2-HTaMoO6)[9],但以这种方式制得的层柱产品,其层间距较小、相应的BET比表面积也不大,在催化应用方面并不占优势.近年来的研究工作表明,可以利用一些物理或化学处理手段,破坏层状化合物层间的静电引力,获得构建层状化合物的基本组成单元,即单分散的纳米片层.由于单分散纳米片层本身带负电,且具有较高的自由度,在一定条件下可与带正电的多聚离子(比如无机聚合阳离子)重组形成主客体杂化材料[6,10].铌钼酸盐及其质子交换产物即铌钼酸(HNbMoO6)都是具有Trirutile结构的典型层状半导体化合物,具有潜在的光催化性能.何杰课题组[11]曾采用逐步离子交换方式制得以HNbMoO6为主体而TiO2为层间客体的插层型TiO2-HNbMoO6复合材料.本文以层状铌钼酸(HNbMoO6)为主体,以二氧化钛为客体,通过先制备带正电的TiO2溶胶,并将HNbMoO6剥离制成含NbMoO6-纳米片层的溶胶,再将两种溶胶混合后采用重堆积技术制得HNbMoO6与TiO2的复合材料(TiO2/HNbMoO6),进一步地对所得复合材料的结构和表面形貌进行了表征.本研究所制得的TiO2/HNbMoO6复合材料是单分散HNbMoO6纳米片层与细小TiO2粒子构成的非晶态材料.
1 实验部分
1.1 实验试剂
五氧化二铌(Nb2O5)、三氧化钼(MoO3)和碳酸锂(Li2CO3)均为分析纯级试剂,由国药集团化学试剂有限公司供应;硝酸(HNO3),分析纯,洛阳市化学试剂厂;四丁基氢氧化铵(C16H37NO,简写为TBAOH),10%的水溶液,购自阿拉丁;钛酸丁酯(C16H36O4Ti),分析纯,天津市科密欧化学试剂有限公司;无水乙醇(C2H6O),分析纯,天津市风船化学试剂科技有限公司.所有试剂在实验时都是直接使用,没有做进一步的纯化处理.
1.2 制备
1.2.1 LiNbMoO6和HNbMoO6的合成 铌钼酸锂(LiNbMoO6)的合成采用高温固相法[5,12].具体地,将碳酸锂,五氧化二铌和三氧化钼分别充分研细后,按n(Li2CO3)∶n(Nb2O5)∶n(MoO3)=1∶1∶2的比例充分混合均匀,置于马弗炉内,在773 K进行固相反应,4 h后停止加热,待温度降至室温,取出试样再进行研磨后,重新置于马弗炉内升至773 K,继续保持4 h,如此反复3次后,将温度升至833 K,在该温度下总共保持10 h(期间,分别在4 h和8 h时取出冷却后研磨各1次),即得铌钼酸锂(LiNbMoO6).取5 g LiNbMoO6,加入2 mol/L的硝酸溶液500 mL,在连续搅拌条件下室温反应48 h,当反应进行到24 h时,更换一次硝酸溶液.经离心分离和充分洗涤后,于343 K干燥,得到层状铌钼酸(HNbMoO6,简记为o-HNbMoO6).
1.2.2 HNbMoO6的剥离 称取0.2 g铌钼酸(o-HNbMoO6)置于锥形瓶中,并加入138 mL去离子水和1.83 mL四丁基氢氧化铵水溶液,摇匀,在超声波清洗槽中超声,超声处理后的悬浮液静置5 h,离心分离后,测定上清液(即剥离液)的pH值为8.0,将上清液密闭保存在试剂瓶中.离心分离后获得的固体经烘干后称重,由此可计算剥离率.
1.2.3 TiO2溶胶的制备 取58.3 mL无水乙醇,加入50 mL去离子水,再向其中缓慢加入2.8 mL浓硝酸,于磁力搅拌器上搅拌2 h使其混合均匀,测得其pH值为1.5,形成的溶液标记为A.取16.1 mL钛酸四丁酯,缓慢加入53.2 mL无水乙醇后,再加入1.4 mL浓硝酸,密封好,在磁力搅拌器上搅拌3 h,形成的溶液标记为B.在40 ℃和磁力搅拌条件下,将溶液A缓慢滴加到溶液B中,滴加完毕后,继续搅拌5 h,然后静置3 d,最终得到呈现淡蓝色的TiO2溶胶.
1.2.4 TiO2溶胶与铌钼酸单分散纳米片层的重组 取o-HNbMoO6与四丁基氢氧化铵(TBAOH)摩尔比为1∶1、剥离时间1 h得到的剥离液60 mL,测得其pH值为8.0,在磁力搅拌条件下向其中缓慢滴加TiO2溶胶(TiO2与HNbMoO6的投料比1∶1),室温下搅拌2 h后,缓慢滴加0.5 mol/L HNO3到上述混合体系中,当pH值为4.0左右时,开始出现絮状沉淀,大约耗用HNO3溶液1.2 mL.继续在室温下搅拌24 h,之后于333 K的温度下老化24 h,确保重组和复合进行完全.最后经离心分离,弃去上清液,所得沉淀用30 mL去离子水洗涤2次,再用1∶1的乙醇水溶液30 mL洗涤2次,所得固体产物置于鼓风干燥箱中于313 K烘干后,将其研成粉末,装在称量瓶中,产物记为TiO2/HNbMoO6.作为对比,在不引入客体TiO2时,通过降低HNbMoO6剥离形成的透明溶胶的pH值,可以使单分散的铌钼酸纳米片层自组装而聚沉,自聚沉形成的产物记为e-HNbMoO6.
1.3 表征
样品的粉末X射线衍射(XRD)实验在型号为PANalytical X′Pert PRO的X射线衍射仪上进行,仪器条件为:Cu靶,CuKa辐射,管电压40 kV,管电流40 mA.样品的表面形貌测试实验在HIACHI TM-1000型扫描电镜(SEM)仪上进行,并用仪器自身装配的照相系统拍摄SEM照片.实验时将样品固定在导电胶带上.
2 结果与讨论
2.1 铌钼酸的剥离及剥离条件
铌钼酸锂(LiNbMoO6)的XRD结果在文献中已有报道[5],本研究的XRD结果与该文献一致,在此不再重复展示.LiNbMoO6的(001)面衍射峰位于2θ=9.2 °,按照Bragg方程,nλ=2dsinθ,计算得知,其对应的层间距d001为0.96 nm,扣除Li+直径0.15 nm后,则层状化合物LiNbMoO6的层板厚度为0.81 nm.LiNbMoO6与硝酸溶液进行离子交换反应后,H+进入到层状铌钼酸盐的层间,并将其中的Li+置换出来,得到层状铌钼酸(即o-HNbMoO6).强碱性的四丁基氢氧化铵(TBAOH)溶液在与层状铌钼酸进行酸碱反应时,TBAOH进入到其层间,由于TBAOH物种的体积很大,使层状铌钼酸的层板间距发生膨胀,直至分离形成单分散的NbMoO6-纳米层片,这个过程称为剥离.本文考察了不同剥离时间以及不同HNbMoO6与TBAOH摩尔比时的剥离效率.
图1给出了在固定HNbMoO6与TBAOH摩尔比为1∶1时,剥离率与剥离时间的关系曲线.由图1可见,当剥离时间为2 h时,剥离率已接近100%,再延长剥离时间,剥离率反而有所下降,可能是时间过长,造成剥离液中极少量单分散的铌酸纳米片层发生聚沉.由此可见,必须控制适当的剥离时间,才能使剥离率达到最高,时间短,剥离不完全,但时间过长,则不仅造成能耗增加,而且影响剥离效率.对剥离上清液的pH进行即时监测可知,在剥离时间分别为0.5、1.0、2.0、3.0 h时,剥离上清液的pH值分别为8.9、8.0、7.4和7.4.由此可见,剥离时间2 h时,pH已趋于恒定,这也从另一个侧面证实,剥离时间为2 h时,剥离已近乎完全.
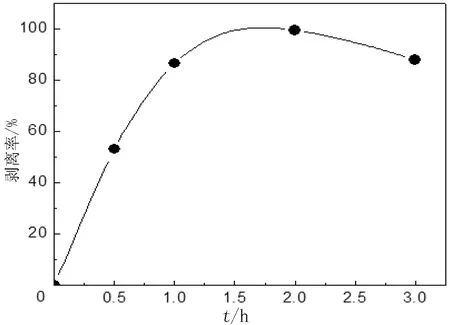
图1 剥离率随剥离时间的变化关系Fig.1 Change of exfoliation rate with time
要使HNbMoO6与TBAOH恰好完全反应,则它们的摩尔比应为1∶1.在本研究中,在两者恰好完全反应以及在剥离剂TBAOH过量两种情况下,考察了HNbMoO6的剥离效果.固定剥离时间为2 h,在HNbMoO6与TBAOH的摩尔比分别为1∶1和1∶1.5时进行剥离实验.结果表明,在HNbMoO6与TBAOH的摩尔比为1∶1和1∶1.5时,剥离率分别为99.5%和64.5%,对应的剥离上清液的pH值分别为7.4和10.3.由此可知,当剥离时间固定2 h,在HNbMoO6与TBAOH的摩尔比为1∶1时,剥离效果良好,其剥离率已经很高,接近100%.
可以证实,在TBAOH的作用下,HNbMoO6经超声处理所形成的透明体系不是真溶液,而是溶胶.当可见光透过溶胶体系时,会产生明显的散射作用.而对于真溶液,根据Rayleigh光散射强度公式[13],一方面由于其分散相质点(分子及离子)很小,另一方面由于溶质分子或离子一般具有较厚的溶剂化层,使分散相与分散介质的折光率相差较小,因此,真溶液对光的散射作用十分微弱.所以,溶胶体系具有显著丁达尔效应,而溶液几乎没有,丁达尔效应乃是区分溶胶体系和真溶液的一种简单而有效的手段.移取少量的剥离液体于干净的小烧杯中,用手电筒照射,从垂直于光线的方向均可观察到明亮的光通道(图2),由此证实,剥离所得透明液体属于含NbMoO6-单分散纳米片层的胶体溶液.

图2 剥离液的丁达尔效应(分别从烧杯 侧面(a)和上方(b)观察)Fig.2 Tyndall effect of exfoliated HNbMoO6 collosol (Observing from the lateral side(a)and top of beaker(b))
2.2 NbMoO6-单分散纳米片层的自组装
根据对剥离条件的考察结果,将剥离时间选定为2 h,HNbMoO6与TBAOH的摩尔比选定为1∶1,对层状铌钼酸进行剥离实验.当剥离完成后,在向剥离液中滴加硝酸溶液时,由于硝酸与强碱性的TBAOH溶液发生中和作用,而且滴加的硝酸溶液中多余的氢离子又与单分散的
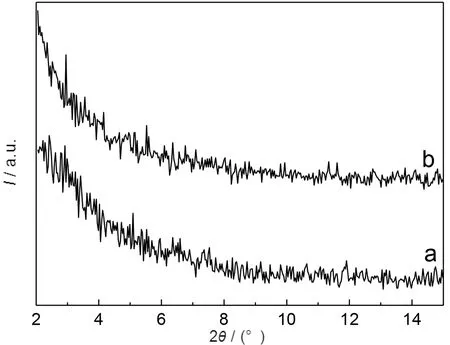
(a)TiO2/ HNbMoO6(1∶1);(b) TiO2/ HNbMoO6(2∶1)图5 二元复合样品的XRD图谱Fig.5 XRD patterns of composite materials
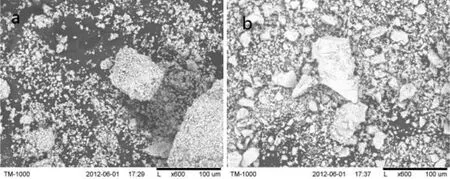
(a) TiO2/ HNbMoO6(1∶1) (b) TiO2/HNbMoO6(2∶1)图6 二元复合样品的SEM图Fig.6 SEM photos of composite materials
NbMoO6-纳米片层因静电吸引作用重组形成HNbMoO6.剥离后再重组形成的HNbMoO6(即e-HNbMoO6),其粉末X射线衍射(XRD)图谱结果展示于图3中(图3a).为便于比较,由高温固相法合成的LiNbMoO6与硝酸溶液进行离子交换反应后形成的层状HNbMoO6(即o-HNbMoO6)也展示于图3中(图3b).可以看出,o-HNbMoO6的XRD图谱上展现出尖锐的(002)衍射峰(2θ=6.5 °),对应的层间距d002为1.36 nm.相比,在酸性条件下,由单分散的NbMoO6-纳米片层重组形成的HNbMoO6(即e-HNbMoO6),其衍射峰十分弥散,仅在2θ=6.5 °附近显示了一个微弱的(002)衍射峰包,在2θ=27.0 °附近显示了一个弱的衍射峰,但该衍射峰既与o-HNbMoO6的衍射图谱上的(110)面衍射峰位置不完全吻合,又与(112)面衍射峰位不相一致.说明经剥离-重堆积后形成的e-HNbMoO6并不呈现有序的结晶形态,而主要是以微小的HNbMoO6纳米层片堆叠在一起.图4对比地展示了o-HNbMoO6和e-HNbMoO6两个样品的扫描电镜(SEM)照片.e-HNbMoO6的SEM结果与XRD相吻合.从SEM结果可见,e-HNbMoO6主要是以细小粒子或由细小粒子堆积形成的蜂窝状疏松体形式存在,其中还夹杂着一些板状粒子,这些板状粒子与XRD图谱上2θ=6.5 °附近弱的(002)衍射峰包相对应.

图3 剥离-重组的铌钼酸(e-HNbMoO6)(a)和 铌钼酸(o-HNbMoO6)(b)的XRDFig.3 A comparison between XRD of e-HNbMoO6(a)and that of o-HNbMoO6(b)

图4 铌钼酸(o-HNbMoO6)(a)和 剥离-重组铌钼酸(e-HNbMoO6)(b)的SEMFig.4 SEM photos of o-HNbMoO6 (a) and e-HNbMoO6(b)
2.3 HNbMoO6与二氧化钛的复合
分别按照TiO2与HNbMoO6摩尔比为1∶1和2∶1的比例量取TiO2溶胶和含单分散的NbMoO6-纳米片层溶胶,两者混合均匀后,在逐滴滴加强酸溶液使体系的pH值逐渐降低时,NbMoO6-与H+结合形成HNbMoO6并发生聚沉,同时随着体系中由TBAOH产生的OH-与H+的不断中和而相互消耗,部分带负电的NbMoO6-纳米片层与带正电的TiO2胶粒相互结合[14],从而形成以HNbMoO6为主体TiO2为客体的TiO2/HNbMoO6二元复合材料.TiO2/HNbMoO6(1∶1)和TiO2/HNbMoO6(2∶1)两个复合材料的XRD(2θ在2 °~15 °区间)图谱如图5所示.由图5可见,两个复合样品的XRD图谱与单一的铌钼酸剥离-重组样品(e-HNbMoO6,图3a)明显不同,复合样品的XRD图谱上未显示任何代表HNbMoO6层状结构的衍射峰,可以认为这是由TiO2与HNbMoO6杂化导致的,同时也表明HNbMoO6是以单分散的纳米片层形式存在于复合材料中.图6是两个复合产品[TiO2/HNbMoO6(1∶1)和TiO2/HNbMoO6(2∶1)]的SEM照片.由图6可见,复合样品呈现非晶形貌,主要由细小粒子或细小粒子堆积而成的疏松体构成,而且样品TiO2/HNbMoO6(1∶1)显然比TiO2/HNbMoO6(2∶1)更均匀.
3 结论
在大体积强碱性四丁基氢氧化铵的作用下,通过超声方式将层状铌钼酸(HNbMoO6)有效地剥离,形成含单分散的NbMoO6-纳米片层溶胶体系,当HNbMoO6与TBAOH摩尔比为1∶1,剥离时间为2 h时,剥离率可达99%以上.利用剥离-重堆积技术,可使含NbMoO6-纳米片层的溶胶与新鲜制得的二氧化钛溶胶同时聚沉并发生有效杂化,形成以HNbMoO6为主体TiO2为客体的二元复合材料.由剥离-重堆积法合成主客体复合材料,是从分子水平设计和制备具有低成本、高催化活性光催化材料的有效思路和方式,也有望今后在合成化学领域起到重要的参考作用.
