碱预处理稻草产生物乙醇的工艺研究
2021-06-04金显春宋嘉宁
金显春,宋嘉宁
(1.河南农业大学 理学院,河南 郑州 450002;2.河南农业大学 风景园林与艺术学院,河南 郑州 450002)
我国是一个农业大国,水稻是我国主要农作物之一,每年产生稻草多达2亿多吨,占秸秆总产量的27.96%[1]。随着农民生活水平的提高以及城镇化的加速,农民的燃料由原来的生物质转变为液化气、煤等化石能源。化石能源的使用,释放出大量温室气体以及氮氧化物和硫氧化物,导致全球变暖以及大气污染。而稻草作为燃料以及饲料的功能逐渐下降甚至消失,导致大量的稻草成为废弃物,主要处理措施为就地掩埋或是露天焚烧,造成资源浪费以及环境污染[2-3]。利用稻草发酵生产生物乙醇可显著降低因稻草就地掩埋以及露天焚烧造成的环境污染,同时有效避免利用粮食生产乙醇的第一代生物乙醇的与粮争地,与人畜争粮的缺陷,成为世界各国研究的热点之一[4-7]。
稻草中碳水化合物(纤维素和半纤维素)含量较高,木质素含量相对较低,是一种很有前景的生物乙醇生产原料[8-9]。从木质纤维素生产乙醇一般需经过预处理、酶解以及发酵三个过程,但由于纤维素、半纤维素以及木质素通过氢键、醚键以及酯键相互连接形成三维立体网状结构,对微生物以及酶的降解呈高度抗性,因此,通过酶解发酵途径利用稻草有效生产生物乙醇,必须对稻草进行预处理。国内外基于最高糖化效率建立的稻草预处理方式包括物理、化学以及生物方法,其中,化学方法中的碱预处理方式因可以选择性去除木质素以及溶解二氧化硅而使用最广[10-12]。木质纤维素的酶解需纤维素降解酶、半纤维素降解酶以及木质素降解酶的协同作用。纤维素降解酶以及半纤维素降解酶可以分别将纤维素和半纤维素降解为相应单糖,而木质素降解酶则降解木质素以及预处理过程中产生的木质素部分降解产物。
为解决这些商业酶的高成本严重阻碍有效利用木质纤维素生产生物乙醇的问题,本研究将酶的生产、糖化和解毒结合在一个系统中,以碳酸钠预处理的稻草作为唯一碳源,硫酸铵作为氮源,采用烟曲霉酶解稻草,采用嗜鞣管囊酵母对酶解产生的还原糖进行发酵以生产乙醇。与同步糖化发酵(simultaneous saccharification and fermentation,SSF)相比,该工艺进一步强化,避免了酶的分离和纯化,同时实现了脱木质素和解毒,可显著降低糖化成本,提高生物乙醇的产率。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
稻草:源自河南省信阳市农家,自来水洗涤后风干至恒质量,小型粉碎机粉碎后过20目筛,密封袋封装保存于室温备用。
烟曲霉(Aspergillus fumigatus):从霉变稻草中筛选获得并以孢子形式保存于本实验室;嗜鞣管囊酵母(Pachysolen tannophilus):中国工业微生物菌种保藏管理中心(China center of industrial culture collection,CICC)1770。
1.1.2 培养基
烟曲霉种子培养基[13]:蔗糖10 g/L,硝酸钠3 g/L,磷酸氢二钾1 g/L,七水硫酸镁0.5 g/L,氯化钾0.5 g/L,硫酸亚铁0.01 g/L,自然pH,121 ℃条件下灭菌20 min。
酵母种子培养基[14]:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖12 g/L,木糖8 g/L,自然pH,121 ℃条件下灭菌20 min。
1.1.3 试剂
2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2-diazobis(3-ethyl-benzothiazole-6-sulfonic acid)diammonium salt,ABTS)、藜芦醇、对硝基苯基-β-D-吡喃葡萄糖苷、对硝基苯基-β-D-吡喃木糖苷、桦木木聚糖、愈创木酚(均为分析纯):德国Sigma Aldlich公司。其他试剂均为国产分析纯。
1.2 仪器与设备
BXM-30R高压蒸汽灭菌锅:上海博讯实业有限公司;XY-ZDL-2102C回转式摇床:上海昕仪仪器仪表有限公司;UV-2450紫外可见分光光度计:日本岛津公司;5804R型离心机:德国Eppendorf公司。
1.3 实验方法
1.3.1 种子液的制备
将烟曲霉孢子悬液(1.0×108CFU/mL)1 mL接种于种子培养基中,37 ℃、150 r/min条件下培养24 h作为种子液(2×107CFU/mL)备用。
取1环嗜鞣管囊酵母于酵母种子培养基中,37 ℃、150 r/min条件下活化24 h作为种子液(2×107CFU/mL)备用。
1.3.2 稻草预处理
在装有10g稻草粉的500mL三角瓶中加入90mL0.15mol/L Na2CO3溶液,在121 ℃条件下灭菌20 min,蒸馏水代替碳酸钠作相同处理作为对照,研究碳酸钠预处理对稻草组分的影响。
1.3.3 酶解工艺
采用10 mol/L无菌硫酸或NaOH将预处理稻草的初始pH值分别调节为4.0、4.5、5.0、5.5、6.0后,加入无菌50%硫酸铵溶液至其终浓度为1%,按照2%(V/V)的接种量接入烟曲霉种子液,于37 ℃、150 r/min条件下培养,定时取样,于1 230×g、4 ℃条件下离心10 min,取上清液测定酶活、还原糖、纤维素、半纤维素、木质素、总酚以及稻草降解率。在此基础上,以稻草降解率为评价指标考察烟曲霉接种量(1%、2%、3%、4%、5%、6%)对酶解效果的影响。以灭活烟曲霉种子作为对照,每组实验重复3次。
1.3.4 乙醇生产工艺
接入烟曲霉种子液酶解12 h后,按4%(V/V)的接种量接入嗜鞣管囊酵母种子液,于37 ℃、150 r/min条件下培养,发酵生产乙醇,每隔一定时间取样,于1 230×g、4 ℃条件下离心10 min,取上清液,测定乙醇含量。以乙醇含量为评价指标,考察嗜鞣管囊酵母接种量(1%、2%、3%、4%、5%和6%)、接种时间(酶解12 h、16 h、20 h和24 h时接入酵母)对乙醇生产的影响。以灭活嗜鞣管囊酵母种子液作为对照,每组实验重复3次。
1.3.5 分析检测方法
相对酚浓度[13]:定义烟曲霉接入前的初始酚浓度为100%,接入菌种酶解后的酚浓度与初始浓度之比即为相对酚浓度;漆酶酶活、锰依赖过氧化物酶酶活、木质素过氧化物酶酶活测定:参照文献[14];滤纸酶活、内切纤维素酶酶活以及β-葡萄糖苷酶酶活测定:参照文献[15];木聚糖酶酶活以及木糖苷酶酶活测定:参照文献[16];稻草中纤维素、半纤维素以及木质素含量的测定:参照文献[17];总酚含量的测定:参照文献[18]。
稻草降解率的计算公式如下:
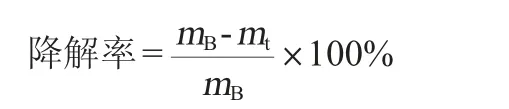
式中:mB和mt分别为对照和实验组中残留稻草质量,g。
1.3.6 数据处理方法
所有实验重复3次,结果用“平均值±标准差”表示。
2 结果与分析
2.1 碳酸钠预处理对稻草组分的影响
碱预处理木质纤维素因选择性好,产生的酶解、发酵抑制物少,条件温和,故广泛被使用。Na2CO3预处理前后稻草主要组分见表1。
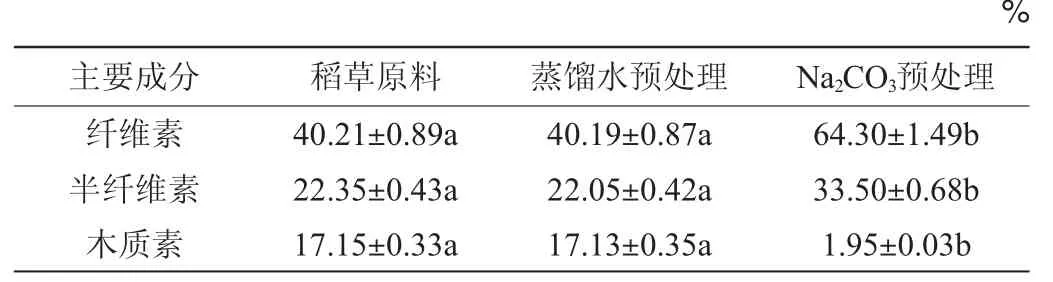
表1 Na2CO3预处理对稻草主要组分的影响Table 1 Effect of Na2CO3 pretreatment on the main components of rice straw
由表1可知,稻草经过蒸馏水预处理后,稻草主要组分含量没有显著性变化(P>0.05)。然而,稻草经过0.15 mol/L碳酸钠预处理后,纤维素及半纤维素含量显著提高(P<0.05),分别为(64.30±1.49)%、(33.50±0.68)%,而木质素含量(1.95±0.03)%显著减少(P<0.05),这是因为碳酸钠选择性地断裂木质素与半纤维素间的酰基,从而导致木质素的脱除,并不降解纤维素和半纤维素[2,19]。说明碳酸钠预处理稻草具有高度选择性。
2.2 酶解工艺优化
2.2.1 初始pH值对烟曲霉降解碱预处理稻草的影响
由于pH值既影响微生物的生长又影响酶的分泌以及酶活,故pH值是发酵过程十分关键的因素之一[20]。初始pH值对烟曲霉降解碱预处理稻草的影响见图1。

图1 初始pH值对烟曲霉降解稻草的影响Fig.1 Effect of initial pH on rice straw degradation by Aspergillus fumigatus
由图1可知,随着初始pH值的升高,稻草降解率呈先升高后下降的趋势。当初始pH值为4.5时,稻草降解率最高,为(100±2.13)%,说明烟曲霉在初始pH值为4.5时可以完全降解碳酸钠预处理的稻草。这可能是因为纤维素降解酶以及半纤维素降解酶的最适pH值为4.5。
2.2.2 烟曲霉接种量对碱预处理稻草降解的影响
接种量在酶的生产中起着至关重要的作用,为了获得最大的生产力,需要在底物利用和微生物繁殖之间取得平衡[21]。烟曲霉接种量对碱预处理稻草降解的影响见图2。

图2 烟曲霉接种量对稻草降解的影响Fig.2 Effect of inoculum on the degradation of rice straw by Aspergillus fimigatus
由图2可知,随着烟曲霉接种量的增大,稻草降解率呈先升高后下降的趋势。当烟曲霉接种量为4%时,稻草降解率最高,达(100±2.13)%,分析原因可能是过低的接种量因预处理过程中产生的木质素降解产物酚类物质的抑制不利于烟曲霉的生长,而过高的接种量则导致微生物竞争营养物质,从而不利于稻草的降解[21]。
2.3 最优酶解条件下酶活、还原糖及相对酚浓度的变化
在烟曲霉降解碱预处理稻草过程中,检测到了所有纤维素降解酶(滤纸酶、内切纤维素酶以及β-葡萄糖苷酶)和半纤维素降解酶(木聚糖酶以及木糖苷酶),而木质素降解酶(漆酶、锰依赖过氧化物酶、木质素过氧化物酶)则仅检测到漆酶,并未产生锰依赖过氧化物酶以及木质素过氧化物酶。在最优酶解条件下,上清液的酶活、还原糖及相对酚浓度变化情况见图3。

图3 最优酶解条件下酶活、还原糖以及相对酚浓度随酶解时间变化曲线Fig.3 Change curves of enzyme activity,reducing sugar and relative phenol concentration under the optimal enzymatic conditions with enzymatic hydrolysis time
因酶解过程中未检测到锰依赖过氧化物酶酶活以及木质素过氧化物酶酶活,故图中木质素降解酶酶活仅显示漆酶酶活。由图3可知,木聚糖酶酶活、β-木糖苷酶酶活以及漆酶酶活均在接入烟曲霉发酵12 h后达到最大值,分别为(540.28±10.15)U/mL、(480.67±10.26)U/mL、(365.87±9.68)U/mL。而降解纤维素的内切纤维素酶酶活、β-木糖苷酶酶活以及滤纸酶酶活均在接入烟曲霉发酵16 h后达到最大值,分别为(322.16±8.75)U/mL、(67.24±1.32)U/mL、(213.45±5.26)U/mL。这可能是因为碳酸钠预处理时的木质素降解产物酚类诱导漆酶的产生,半纤维素较纤维素更容易降解之故[19]。酶活达到最大值后均略有降低,但直到24 h,均维持较高酶活。这可能是酵母稳定生长阶段产生的蛋白酶或其他抑制性代谢物使得酶分解或失活[18]。相对酚浓度随着烟曲霉的接入显著降低(P<0.05),分析原因可能是烟曲霉产生的漆酶降解了酚类物质,还原糖含量则逐渐增加,酶解24 h时,达到最大,为(52.36±1.23)g/L。分析原因可能是烟曲霉产生的漆酶可以有效降低碳酸钠预处理以及烟曲霉自身酶解过程产生的酚类物质,对发酵培养基起到脱毒作用,可以促进纤维素降解酶以及半纤维素降解酶对纤维素和半纤维素的酶解[22]。
2.4 乙醇生产工艺优化
2.4.1 嗜鞣管囊酵母接入时间对乙醇生产的影响
考虑到碳酸钠预处理稻草选择性去除木质素和二氧化硅,而对碳水化合物基本无影响,且半纤维素以及纤维素降解酶酶活则分别在接入烟曲霉12 h以及16 h时达最大值,故在接入烟曲霉12 h、16 h、20 h以及24 h时按2%的接种量接入嗜鞣管囊酵母种子液,于37 ℃、150 r/min条件下培养,考察嗜鞣管囊酵母接入时间对乙醇生产的影响,结果见图4。

图4 嗜鞣管囊酵母接种时间对乙醇生产的影响Fig.4 Effect of Saccharomyces tannophilus inoculation time on ethanol production
由图4可知,嗜鞣管囊酵母在不同酶解时间接入,乙醇含量均随着发酵时间的延长而增加,发酵16 h时,终乙醇含量最高,分别为(26.3±0.4)g/L、(26.4±0.5)g/L、(26.2±0.4)g/L、(25.9±0.3)g/L,但不同接入时间点的最高乙醇含量没有显著性的差异(P>0.05)。分析原因可能是酶解12 h时,体系中酚类物质浓度较高,对乙醇生产有一定抑制作用,而酶解24 h时,则因稻草完全降解,体系中还原糖浓度较高,可能产生底物抑制。从经济角度考虑,酶解12 h时接入嗜鞣管囊酵母更为有利。本研究的稻草降解速率以及乙醇含量均远远高于吕继良等[23]采用绿色木霉(Trichoderma viride)和污泥发酵稻草生产乙醇。发酵所需时间远远低于袁辛锐等[24]采用生香酵母和酿酒酵母(Saccharomyces cerevisiae)发酵桂圆生产果酒的6 d。
2.4.2 嗜鞣管囊酵母接种量对乙醇生产的影响
嗜鞣管囊酵母接种量对乙醇生产至关重要,接种量过少,导致发酵时间延长,接种量过多,则因维持菌体生长消耗的还原糖过多,均可导致终乙醇含量降低,因此,研究了嗜鞣管囊酵母接种量对乙醇生产的影响,结果见图5。
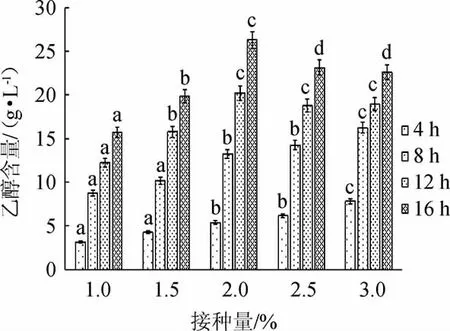
图5 嗜鞣管囊酵母接种量对乙醇生产的影响Fig.5 Effect of Saccharomyces tannophilus inoculum on ethanol production
由图5可知,不同嗜鞣管囊酵母接种量条件下,乙醇含量均随着发酵时间的延长而增加,发酵16 h时,终乙醇含量最高。随着嗜鞣管囊酵母接种量的增大,乙醇含量呈先升高后下降的趋势,当嗜鞣管囊酵母接种量为2%时,乙醇含量最高,发酵16 h时,最高乙醇含量为(26.30±0.86)g/L,因此,确定最佳嗜鞣管囊酵母接种量为2%。
3 结论
本研究选用烟曲霉和嗜鞣管囊酵母降解碳酸钠预处理的稻草生产生物乙醇,烟曲霉酶解稻草、酵母发酵生产乙醇的最优工艺为10 g稻草经90 mL 0.15 mol/L碳酸钠预处理后,调节pH值为4.5,按4%(V/V)的接种量接入烟曲霉种子液,于37 ℃、150 r/min条件下酶解12 h后,按2%(V/V)的接种量接入嗜鞣管囊酵母种子液,于37 ℃、150 r/min条件下发酵16 h,乙醇产量达到最高为(26.30±0.86)g/L。
