复合诱变选育壳聚糖酶高产菌种及产酶条件优化
2021-06-04王俊芳申梦雨
王俊芳,张 震,申梦雨,王 刚
(河南大学 生命科学学院,河南 开封 475004)
壳聚糖酶通常被认为是一类对壳聚糖有专一水解性,以内切方式在部分乙酰化壳聚糖中催化水解β-1,4糖苷键生成壳寡糖的酶。壳寡糖(chitooligosaccharides,COS)是壳聚糖的水解产物,是一种由β-(1,4)-2-氨基-D-氨基葡萄糖和β-(1,4)-2-乙酰氨基-D-氨基葡萄糖单元组成的多聚糖。COS聚合度一般为2~10,易溶于水,黏度低,易被吸收,生物活性丰富,在食品和生物医药领域得到广泛应用[1-3];具有抗肿瘤、抑菌、杀菌、抗氧化、增强免疫力和吸附重金属等重要机能[4-7]。目前,COS产品制备方法有化学法、酶法、高能冲击和基因工程重组等方法[8-9]。其中酶法具有产物特异性强、安全、环保和副产物少等特点。
壳聚糖酶主要由微生物(真菌、细菌和放线菌)和植物产生,该酶在微生物和植物的对外防御和营养功能上起着重要的作用[10-15]。壳聚糖酶的应用除COS制备,还应用于植物真菌病原菌生防治、真菌原生质体的制备和甲壳类废物的生物转化等。近年来,随着应用加剧使壳聚糖酶的研究备受关注[16-18]。虽已筛选出了大量产壳聚糖酶菌株,但经研究发现,不同壳聚糖酶产生菌降解壳聚糖的产物、降解方式和适宜的酶解条件不尽相同[19-22],而且野生菌的酶活性普遍较低,难以大规模工业化生产,壳聚糖酶来源有限,使得商品化的壳聚糖酶价格较高,生产成本难以下降,致使酶法制备COS造价较高,限制了该法的推广应用。因此,需要开发更多类型、适应条件广的壳聚糖酶降解菌来满足工业化需求,通过壳聚糖酶产生菌的作用,有助于COS的开发应用。
该试验分离获得一株产壳聚糖酶菌株G10,研究旨在利用紫外和微波复合诱变技术对野生型菌株进行改造,选育壳聚糖酶产量高、酶活性强的突变菌株,并通过正交试验优化酶活发酵工艺条件,以期为壳聚糖酶的进一步研究和应用提供理论基础,为大幅提高COS的应用技术能力提供一些技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株枯草芽孢杆菌(Bacillus subtilis)G10:河南大学微生物实验室。
1.1.2 试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):上海国药试剂集团;壳聚糖(脱乙酰度≥90%):广州化工集团。
1.1.3 培养基
液体LB培养基[23]:蛋白胨1%,酵母提取物0.5%,NaCl 1%,pH7.2;固体LB培养基:液体LB培养基添加琼脂1.8%。121 ℃灭菌20 min。
液体金氏培养基B(King's B medium,KBM)[24]:蛋白胨2.0%,甘油1.0%,K2HPO40.15%,MgSO4·7H2O 0.15%,pH7.2;固体KBM培养基:液体KBM培养基添加琼脂2.0%。121 ℃灭菌20 min。
初筛液体发酵培养基:液体KBM培养基添加0.1%胶体壳聚糖;复筛液体发酵培养基:液体KBM培养基添加0.5%胶体壳聚糖。
1.2 仪器与设备
BIO-RAD iMark酶标仪:美国伯乐公司;5424R高速冷冻离心机:德国Eppendorf公司;QHZ-98A全温度振荡培养箱:上海百典仪器设备公司。
1.3 方法
1.3.1 菌种诱变
菌株的活化:以斜面培养16~18 h的菌株G10为出发菌,接种于LB液体培养基,28 ℃、180 r/min振荡培养16 h,使细胞处于对数生长期;将上述培养物置于4~7 ℃储藏1 h,诱导同步生长,然后冰浴10 min。4 ℃条件下,将菌悬液12 000 r/min离心,去上清,重悬浮菌体细胞,将细胞浓度调整至108CFU/mL[25]。
紫外诱变:取上述菌液均匀涂布于LB固体培养基平板,使培养皿底部离紫外灯管约30 cm,打开皿盖,分别对平板进行不同时间的紫外照射,照射时间为0、5 s、10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s和90 s,照射结束后28 ℃黑暗培养48 h。以不照射的菌液为对照,计算致死率。
微波诱变:对紫外诱变获得的正突变株中遗传稳定的菌株进行微波诱变。取600 μL菌悬液置于1.5 mL离心管中,并将离心管置于装满冷水的烧杯中,微波炉中辐照。辐照档位功率为700 W,脉冲频率2 540 MHz,每隔10 s换水一次,冷却降温。辐照时间为0、10 s、20 s、30 s、50 s、60 s、80 s、90 s、110 s和120 s,辐照结束,将菌液均匀涂布于LB固体培养基平板上,28 ℃培养48 h。以不照射的菌液为对照,计算致死率。
1.3.2 突变菌株的筛选
突变菌株的初筛:根据致死曲线,在最佳紫外和微波时长诱变条件下,挑取诱变后生长速度快的单菌落,接种于LB液体培养基,180 r/min振荡培养,28 ℃恒温培养16 h。然后将菌液分别定量点接于胶体壳聚糖平板上,28 ℃恒温培养72 h。以菌株G10为对照菌株,挑取透明圈相对大的菌落。
突变菌株的复筛:将初筛的菌株接种于复筛培养基,进行摇瓶培养,28 ℃恒温培养40 h。分别测定不同菌株发酵液壳聚糖酶活,根据酶活大小筛选高产菌株。以菌株G10为对照菌株。
菌株遗传稳定性:经过初筛和复筛后,将待测菌株进行连续10代培养,接种复筛液体培养基振荡培养,分别测定其壳聚糖酶活力。
1.3.3 壳聚糖酶产酶条件优化单因素试验
培养条件的优化:菌体培养条件优化前的培养温度为30 ℃,转速180 r/min,培养基初始pH值7.2,装液量为30 mL/250 mL。以此条件为参照,将活化的菌种接入装有30 mL复筛液体培养基的250 mL三角瓶,分别对培养转速(150 r/min、180 r/min、200 r/min、220 r/min和240 r/min)、初始pH值(6.8、7.0、7.2、7.4和7.6)、培养温度(25 ℃、28 ℃、30 ℃、34 ℃和37 ℃)进行优化,培养24 h。利用DNS法测定发酵液壳聚糖酶活。
培养基成分的优化:以加有0.5%胶体壳聚糖的KBM培养基为基础培养基,分别用1%的葡萄糖、蔗糖、果糖、麦芽糖和甘露醇替代甘油;分别用2%的酵母粉、胰蛋白胨、牛肉膏、NH4Cl和尿素替代蛋白胨;分别用0.3%的FeCl2、K2HPO4、LiSO4、CaCl2、MnSO4和NaCl替代MgSO4·7H2O+K2HPO4;考察不同碳源、氮源、无机盐对壳聚糖酶活的影响。按1.3.2优化后的培养条件培养24 h。分别测定发酵液壳聚糖酶活。
1.3.4 壳聚糖酶产酶培养基优化正交试验
通过单因素试验初步考查MgSO4·7H2O(A)、果糖(B)和酵母粉(C)添加量对菌株W1-32产壳聚糖酶的影响。在单因素试验的基础上,设计L9(34)正交试验,优化菌株W1-32产壳聚糖酶发酵培养基。
1.3.5 壳聚糖酶活力测定
取待测发酵液3mL,于4℃条件下8000r/min离心10min,得上清即为粗酶液。取1 mL粗酶液,加0.1%的胶体壳聚糖1 mL,30 ℃水浴保温15 min;加入2 mol/L的NaOH溶液0.2 mL终止反应,5000r/min离心5min,取上清液1mL与1mL的DNS试剂混合,沸水浴5 min,冷却,加入蒸馏水,定容至10 mL,酶标仪测定OD520nm值。
取粗酶液1 mL与1 mL的DNS试剂混合,沸水浴5 min,冷却后加入蒸馏水,定容至10 mL,酶标仪测定OD520nm值,以此为空白对照。根据氨基葡萄糖标准曲线和酶活力单位定义,计算壳聚糖酶活力[26]。
壳聚糖酶活力单位定义为:在30 ℃条件下,1 mL酶液每分钟产生相当于1 μmol氨基葡萄糖的还原糖所需的酶量为一个壳聚糖酶活力单位(U/mL)。
2 结果与分析
2.1 紫外诱变条件的确定
由图1可知,随着照射时间的延长,菌体致死率逐渐提高,60 s、70 s和80 s照射时间时菌体致死率分别为81.5%、95%和100%。通过对紫外线、微波、烷化剂等诱变剂的诱变结果统计发现,突变株正向突变多出现在菌体致死率为80%~90%时[27]。因此,选择紫外诱变照射时间为60 s。
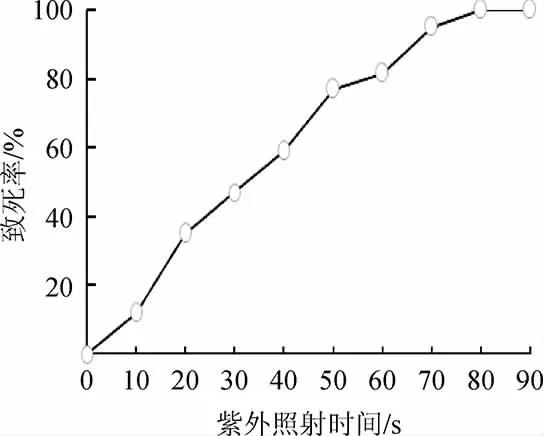
图1 紫外照射时间对菌体致死率的影响Fig.1 Effect of UV irradiation time on strain lethality
2.2 微波诱变条件确定
由图2可知,辐射时间为50 s时致死率为83%,辐射时间为60 s时致死率为91%。由于诱变致死率80%~90%之间突变菌株发生正突变概率高[27]。因此,选择微波照射时间为50 s。
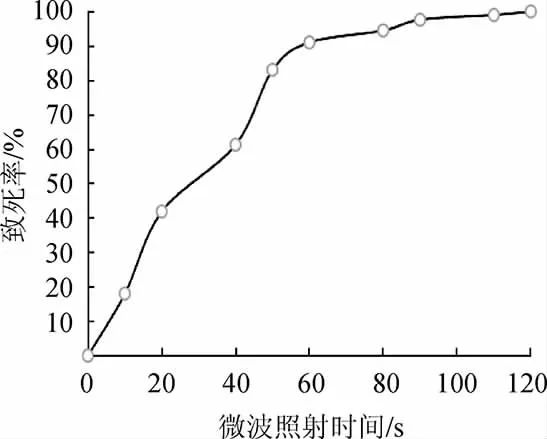
图2 微波照射时间对菌体致死率的影响Fig.2 Effect of microwave irradiation time on strain lethality
2.3 壳聚糖酶高产菌株的初筛及复筛
紫外诱变结果:菌株G10经紫外诱变后,初筛出72株高产壳聚糖酶菌株。利用摇瓶培养法进行高产菌复筛,筛选到一株壳聚糖酶活相对较高的突变菌株,编号为Z1-15。经测定,出发菌株G10产壳聚糖酶酶活为1.72 U/mL,菌株Z1-15产壳聚糖酶酶活为3.35 U/mL。
微波照射诱变结果:对紫外诱变筛选出的壳聚糖酶高产菌Z1-15进行微波照射诱变。筛选出102株突变株,经摇瓶发酵复筛测其壳聚糖酶活,选出一株产壳聚糖酶活较高的菌株W1-32,其产壳聚糖酶酶活为6.53 U/mL。
2.4 菌株W1-32产壳聚糖酶稳定性测定
菌株W1-32经过10次传代和摇瓶培养,对其壳聚糖酶活分别进行测定,结果见表1。由表1可知,该菌株传代10次后产壳聚糖酶酶活为6.531 U/mL,产壳聚糖酶稳定。

表1 菌株W1-32不同传代次数壳聚糖酶活Table 1 Chitosanase activity of different passages of strain W1-32
2.5 培养条件对菌株W1-32产壳聚糖酶酶活的影响
2.5.1 初始pH对菌株W1-32产壳聚糖酶酶活的影响
由图3可知,随培养基初始pH的升高,菌株W1-32产壳聚糖酶酶活呈先增大后减小的趋势;培养基初始pH值为7.2时,菌株W1-32产壳聚糖酶酶活最高,为6.552 U/mL。因此,选择菌株W1-32产壳聚糖酶培养基的最佳初始pH值为7.2。
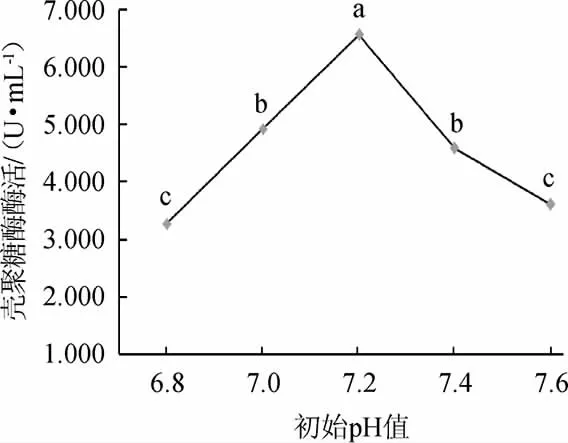
图3 初始pH对菌株W1-32产壳聚糖酶酶活的影响Fig.3 Effect of initial pH on chitosanase activity produced by strain W1-32
2.5.2 转速对菌株W1-32产壳聚糖酶活的影响
由图4可知,随着培养转速的提高,菌株产壳聚糖酶活呈先升高后下降的趋势;转速为200 r/min时,菌株发酵液相对酶活最高,酶活为6.613 U/mL。因此,选择菌株W1-32产壳聚糖酶培养的最佳转速为200 r/min。
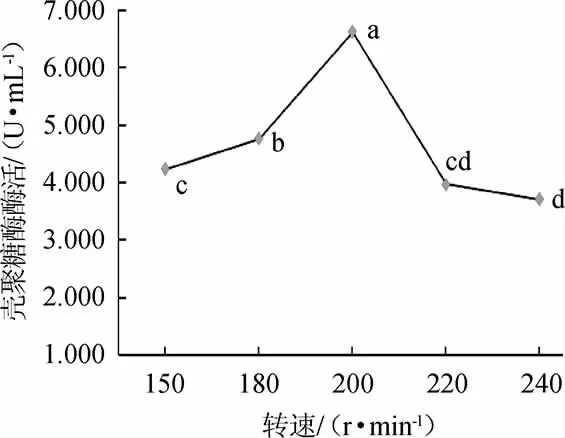
图4 转速对菌株W1-32产壳聚糖酶活的影响Fig.4 Effect of rotational speed on chitosanase activity produced by strain W1-32
2.5.3 温度对菌株W1-32产壳聚糖酶活的影响
由图5可知,随着培养温度升高,菌株W1-32产壳聚糖酶活呈先升高后降低的趋势;结果表明温度为28 ℃时,菌株W1-32产壳聚糖酶活性最高,酶活为6.530 U/mL。因此,选择菌株W1-32产壳聚糖酶的最佳培养温度为28 ℃。
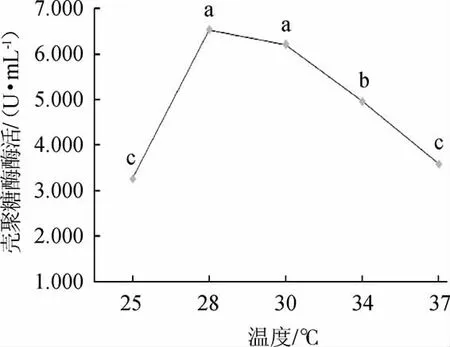
图5 温度对菌株W1-32产壳聚糖酶活的影响Fig.5 Effect of temperature on chitosanase activity produced by strain W1-32
2.6 培养基配方优化单因素试验
碳源、氮源、无机盐对菌株W1-32产壳聚糖酶活的影响见图6~图8。

图6 碳源对菌株W1-32产壳聚糖酶活的影响Fig.6 Effect of carbon source on chitosanase activity produced by strain W1-32
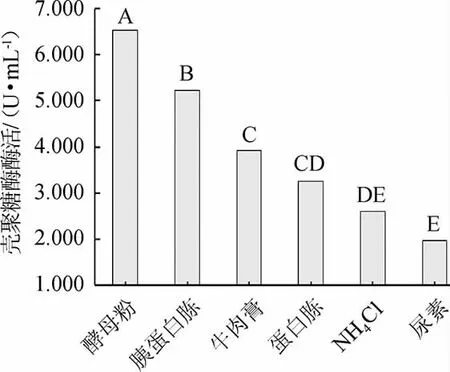
图7 氮源对菌株W1-32产壳聚糖酶活的影响Fig.7 Effect of nitrogen source on chitosanase activity produced by strain W1-32
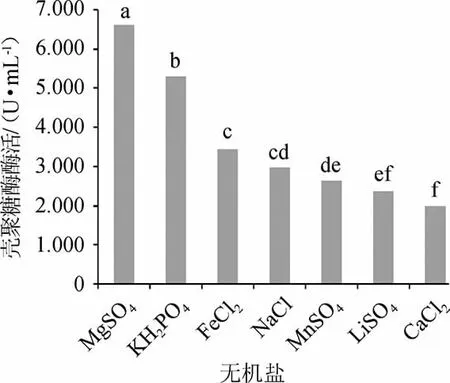
图8 无机盐对菌株W1-32产壳聚糖酶活的影响Fig.8 Effect of inorganic salts on chitosanase activity produced by strain W1-32
由图6可知,不同碳源条件下酶活差异极显著(P<0.01);结果显示以果糖为碳源时,该菌株产壳聚糖酶活最高,酶活为6.563 U/mL。因此最佳碳源为果糖。
由图7可知,不同氮源条件下菌株W1-32产壳聚糖酶活差异极显著(P<0.01);结果表明以酵母粉为氮源时,菌株W1-32产壳聚糖酶活最高,酶活为6.532 U/mL。因此,选择菌株W1-32产壳聚糖酶的最佳氮源为酵母粉。
由图8可知,不同无机盐条件下菌株W1-32产壳聚糖酶活差异极显著(P<0.01);结果显示所选的七种不同的盐中,添加MgSO4·7H2O时,菌株W1-32产壳聚糖酶活最高,酶活为6.612 U/mL。因此,选择菌株W1-32产壳聚糖酶的最佳无机盐为MgSO4·7H2O。
2.7 培养基配方优化正交试验
由表2可知,3个因素对菌株W1-32产壳聚糖酶酶活影响大小顺序为RB>RC>RA,即果糖添加量影响最大,酵母粉添加量次之,MgSO4·7H2O添加量影响最小。综合各因素培养基优水平组合为A2B3C2,即MgSO4·7H2O 0.3%,果糖1.3%,酵母粉2.0%。
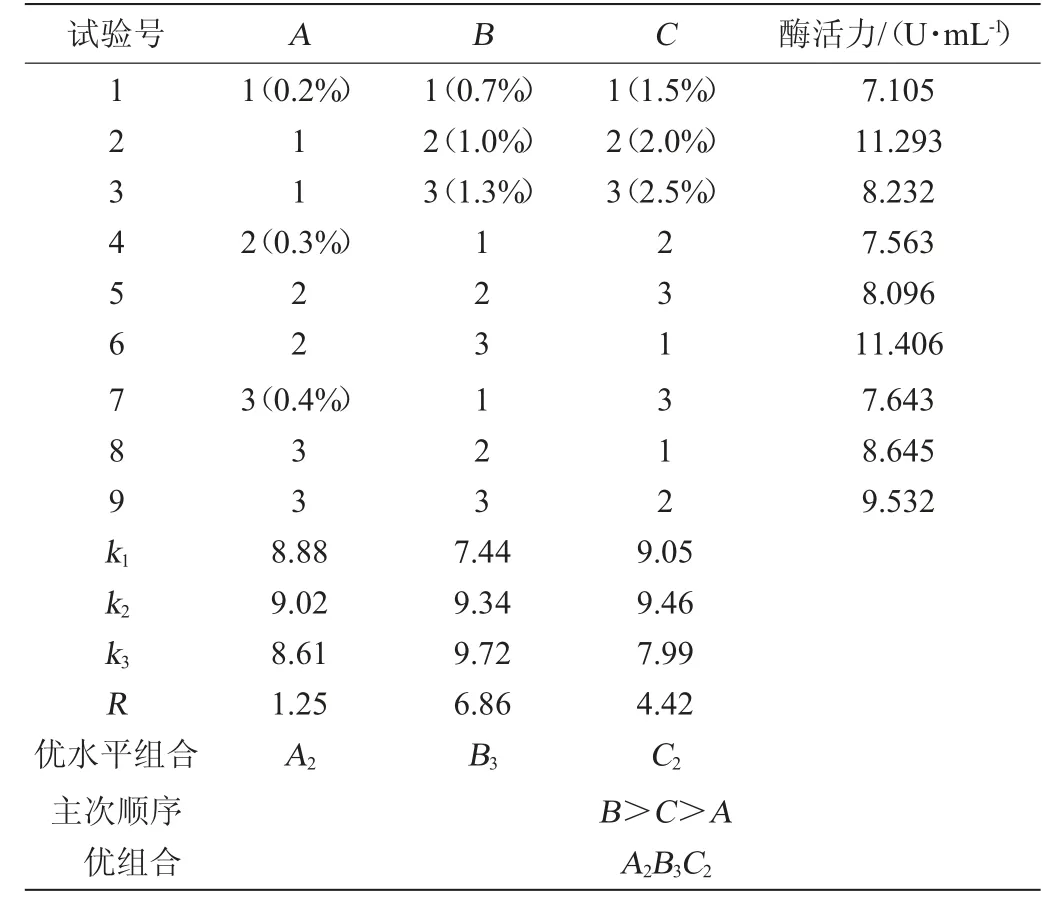
表2 菌株W1-32产壳聚糖酶培养基配方优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for medium formula optimization of chitosanase produced by strain W1-32
2.8 优化条件下菌株W1-32的壳聚糖酶活
由图9可知,在优化培养条件及培养基条件下,8 h前酶活增长缓慢;10~18 h酶活快速增长,24 h时酶活达最高11.82 U/mL,超过30 h后,酶活逐渐下降。
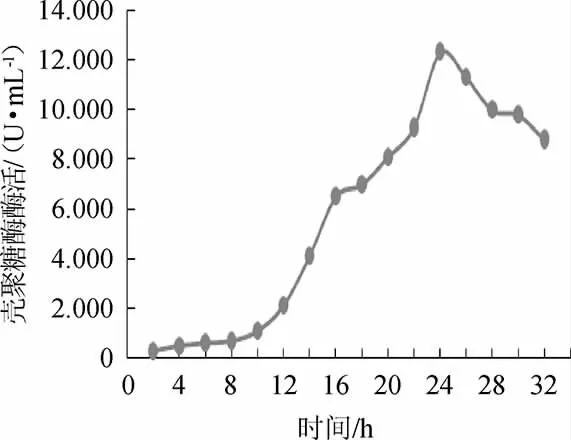
图9 菌株W1-32产壳聚糖酶活力曲线Fig.9 Curve of chitosanase activity produced by strain W1-32
3 结论
以具有产壳聚糖酶能力的枯草芽孢杆菌G10为出发菌株,利用紫外和微波复合诱变法,选育高产壳聚糖酶突变株。筛选出一株酶活相对较高突变菌株W1-32菌株。通过对培养条件的优化,最佳产酶条件为:培养基初始pH值为7.2,最适宜培养转速200 r/min,温度28 ℃,最佳产酶培养基成分为:果糖1.3%、胶体壳聚糖0.5%,酵母粉2.0%、MgSO4·7H2O 0.3%;优化后菌株W1-32产壳聚糖酶酶活为11.82 U/mL,是出发菌株的6.9倍。
