乳酸菌BN1005富硒发酵条件优化
2021-06-04邓诗贵许赣荣倪冬姣邢宏博邢孔萍宾金荣邹新华
邓诗贵,许赣荣,倪冬姣*,邢宏博,邢孔萍,宾金荣,邹新华
(1.播恩集团股份有限公司,江西 赣州 341000;2.农业农村部生物饲料重点实验室,江西 赣州 341000;3.佛山播恩生物科技有限公司,广东 佛山 528100)
硒(Se)是人体必需微量元素之一,成人推荐摄入量为60 μg/d,最高耐受量为400 μg/d[1]。硒主要以硒蛋白分布于人体与动物所有组织中[2],包括谷胱甘肽过氧化物酶、硫氧还蛋白还原酶、碘甲状腺素脱碘酶、硒蛋白P、硒蛋白W和硒蛋白S[3-4]。硒代蛋氨酸(selenomethionine,SeMet)可以竞争蛋氨酸而参与蛋白质一级结构合成[3],硒代半胱氨酸(selenocysteine,SeCys)是由通常认为的终止密码子UGA编译而参与硒蛋白多肽链的延伸[5]。硒蛋白可以抗氧化并维持机体免疫力,还具有抗癌、解毒、保肝等多种生理功能[6-7]。据统计,我国居民每天硒平均摄入量为44.4 μg/g[8],远没有达到国家卫生和计划生育委员会推荐的摄入量。硒缺乏会引起克山病[1]、心血管疾病、癌症以及神经和内分泌功能紊乱[9]。
近年来已兴起了通过富硒土壤或施用富硒肥料种植富硒茶叶、富硒蔬菜、富硒水稻等[10]农作物,通过给养殖畜禽饲喂富硒饲料,增加农作物、蛋类和肉制品的硒含量,以提高人体的硒摄入量。然而,富硒益生菌及其发酵制品生产的有机硒在机体内表现出更加显著的抗氧化性、抗菌活性和抗癌活性[11]。BENKO I等[12]通过小鼠实验证明无机硒毒性最大,纳米硒毒性次之,富硒益生菌安全性最好,其中富硒乳酸菌最安全。
乳酸菌保健功能和安全性已经被广大消费者认可,其发酵制品的风味和适口性俱佳。本实验旨在优化乳酸菌BN1005的富硒发酵条件,以期为今后利用富硒乳酸菌规模化发酵生产富硒产品奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
乳酸菌(Lactobacillussp.)BN1005:从本实验室自制富硒酸菜中筛选,由公司实验室分离保存(-20 ℃冰箱中保藏备用)。
1.1.2 试剂
亚硒酸钠:美国Sigma-Aldrich公司;硒单元素溶液标准物质(GBW(E)080215):国家标准物质研究中心;蛋白胨、牛肉膏、酵母粉、琼脂:广东环凯微生物科技有限公司;葡萄糖、三水乙酸钠、柠檬酸三铵、CaCO3、NaCl、MgSO4·7H2O、K2HPO4、MnSO4·4H2O:国药集团化学试剂有限公司;吐温-80、溴甲酚紫:天津大茂化学试剂厂;以上试剂均为分析纯或生化试剂。
1.1.3 培养基
液体MRS培养基:蛋白胨10.0 g、牛肉膏10.0 g、酵母粉5 g、葡萄糖20.0 g、三水乙酸钠5.0 g、柠檬酸三铵2.0 g、吐温-80 1.08 g、K2HPO42.0 g、MgSO4·7H2O 0.2 g、MnSO4·4H2O 0.05 g,去离子水1 000 mL,pH调至6.2。固体MRS培养基:液体MRS培养基中添加15.0 g/L的琼脂。
基础富硒培养基:液体MRS培养基添加5 mg/L亚硒酸钠。
所有培养基均在121 ℃、0.1 MPa条件下灭菌20 min。
1.2 仪器与设备
MGC微需氧产气袋、2.5 L立式培养袋:三菱瓦斯化学株式会社;SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;HNY-2102D立式恒温培养振荡器:天津欧诺仪器股份有限公司;AF640A原子荧光光谱仪:北京北分瑞丽分析仪器(集团)有限公司。
1.3 方法
1.3.1 菌株液态发酵
将保藏于冰箱的乳酸菌BN1005接种于MRS液体培养基中活化,活化后的菌液以10%接种量接种于MRS液体培养基,装液量为60 mL/250 mL,37 ℃静置培养48 h,每隔12 h取样,测定发酵液中乳酸菌BN1005生物量、富硒量和富硒率。
1.3.2 富硒培养条件的优化
以液体MRS培养基中添加5 mg/L亚硒酸钠为基础富硒培养基,分别考察摇床转速(0、50 r/min、100 r/min、150 r/min、200 r/min)、发酵时间(12 h、24 h、36 h、48 h、60 h)、亚硒酸钠添加时间(0、4 h、6 h、8 h、10 h)对乳酸菌BN1005富硒的影响,以优化摇瓶发酵工艺条件。
1.3.3 基础富硒培养基的优化
因CaCO3可以中和菌液中的有机酸,使乳酸菌产酸更加持续;NaCl可以改变细胞膜的通透性,会影响细胞内产生的有机硒的跨膜运输。
单因素试验:在1.3.2优化后富硒培养条件基础上,分别考察葡萄糖添加量(20 g/L、25 g/L、30 g/L、35 g/L、40 g/L、45 g/L)、复合有机氮源(蛋白胨∶牛肉膏∶酵母粉=2∶2∶1)添加量(10 g/L、15 g/L、20 g/L、25 g/L、30 g/L、35 g/L)、柠檬酸三铵添加量(1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L、3.5 g/L)、亚硒酸钠添加量(3 mg/L、5 mg/L、7 mg/L、9 mg/L、11 mg/L)、CaCO3添加量(0、5 g/L、10 g/L、15 g/L、20 g/L、25 g/L)、NaCl添加量(0、1 g/L、3 g/L、5 g/L、7 g/L、9 g/L)6个因素对乳酸菌BN1005富硒的影响。
响应面试验:在单因素试验的基础上,选取对乳酸菌BN1005富硒量影响较显著的3个因素亚硒酸钠添加量(A)、NaCl添加量(B)、葡萄糖添加量(C)为考察变量,以富硒量(Y)为响应值,通过响应面分析优化富硒培养基。应用Design-Expert 8.0.6软件设计3因素3水平的Box-Behnken响应面分析试验。
1.3.4 测定方法
乳酸菌生物量的测定:取一定量的菌液于65 ℃烘至质量恒定,计算菌液中菌体细胞干质量(g/L)。
硒含量的测定:参照参考文献[13]的方法,富硒量和富硒率计算公式如下[14]:

2 结果与分析
2.1 富硒培养条件的优化
由图1A可知,静置培养并不适合乳酸菌BN1005生长,可能是亚硒酸钠等物质混合不够均匀;当摇床转速为100 r/min时,菌体干质量、富硒率和富硒量分别达到3.5 g/L、26.49%和378.24 μg/g,三者同时达到最大值,说明乳酸菌BN1005为兼性厌氧菌,静置和高转速都不利于其生长,因此摇床转速确定为100 r/min。由图1B可知,当培养时间在0~36 h时,随着培养时间的延长,其生物量和富硒能力显著增加,36~48 h其生物量和富硒能力增加不显著,当60 h时其生物量和富硒能力有所下降,因此培养时间确定为36 h,此时乳酸菌BN1005培养液的菌体干质量、富硒率和富硒量分别达到3.57 g/L、27.42%和383.54 μg/g。高浓度的亚硒酸钠对菌株生长有一定抑制作用[15],推迟亚硒酸钠添加至培养基中的时间,有助于乳酸菌BN1005的生长。由图1C可知,在培养8 h时添加亚硒酸钠5 mg/L,培养至36 h时取样测得菌体干质量、富硒率和富硒量分别达到3.74 g/L,30.01%和401.13μg/g;相对于其他时间添加达亚硒酸钠,乳酸菌BN1005的富硒量达到最大值。因此确定亚硒酸钠的添加时间为培养8 h。有机硒主要以硒代氨基酸(硒代蛋氨酸和硒代半胱氨酸等)、硒蛋白(酶类)和硒多糖存在于微生物和动植物体内[16-17],当亚硒酸钠在菌株的对数生长期时添加至培养基有助于菌体胞内有机硒的积累[18],对数期微生物代谢旺盛,旺盛的酶系反应和氨基酸代谢有利于微生物提高对硒的转化利用[19-20]。
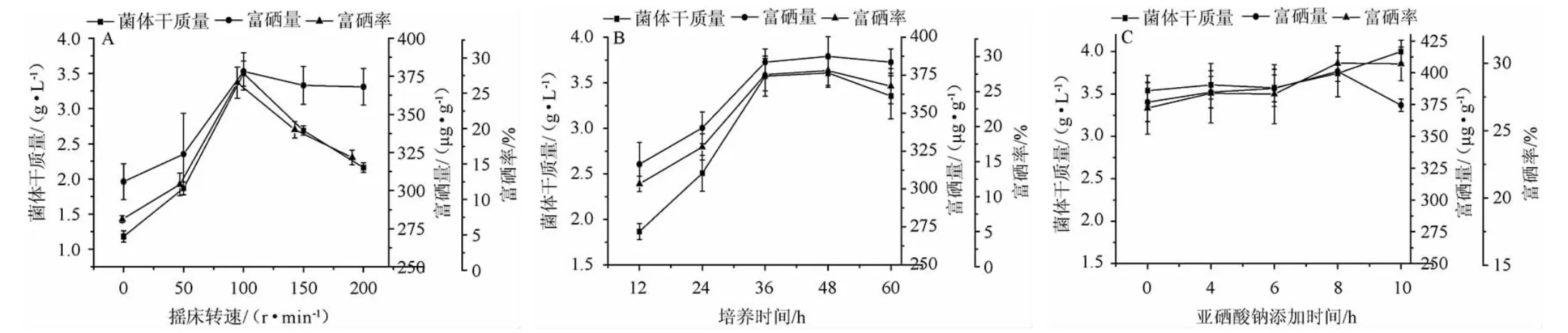
图1 摇床转速(A)、培养时间(B)、亚硒酸钠添加时间(C)对乳酸菌BN1005富硒能力的影响Fig.1 Effect of rotate speed (A),culture time (B) and sodium selenite addition time (C) on selenium enrichment of lactic acid bacterium BN1005
综上,乳酸菌BN1005富硒培养条件优化后确定为接种量10%,装液量为60 mL/250 mL,恒温37 ℃、100 r/min振荡培养36 h,亚硒酸钠添加时间为培养8 h。
2.2 富硒培养基的优化
2.2.1 单因素试验
由图2A可知,当葡萄糖添加量为35g/L时,乳酸菌BN1005富硒量和富硒率达到最大值。低浓度的葡萄糖延缓了菌株的生长代谢,高浓度的葡萄糖导致菌株快速生长,种内竞争加剧,某些富硒因子供给不足,从而引起乳酸菌BN1005生物量、富硒量和富硒率的下降。因此选择葡萄糖添加量为35 g/L。由图2B可知,当复合有机氮源添加量为15 g/L时,乳酸菌BN1005富硒量和富硒率达到最大值。复合有机氮源对乳酸菌BN1005富硒影响结果相类似,但影响的机制或不相同。培养基中复合有机氮源较低时,营养因子匮乏导致生长受阻,从而影响其富硒能力;当复合有机氮源浓度过高时,复合有机氮源中的蛋氨酸和半胱氨酸会与硒代氨基酸等竞争而参与硒蛋白质合成,导致有机硒的生物合成被降低[21]。因此选择复合有机氮源添加量为15 g/L。由图2C可知,当柠檬酸三铵添加量为1.5 g/L时,乳酸菌BN1005的生物量、富硒量和富硒率为最大值,相对于低浓度的柠檬酸三铵,高浓度(≥2.5 g/L)的柠檬酸三铵对乳酸菌BN1005富硒能力的抑制作用更加显著,可能是由于乳酸菌利用无机氮源的能力比较弱。因此选择柠檬酸三铵添加量为1.5g/L。由图2D可知,低浓度的亚硒酸钠对乳酸菌BN1005生长影响较小,无机硒是自由扩散进入细胞内的[22],细胞外亚硒酸钠的浓度低,则扩散到细胞内的速度缓慢,有机硒转化的底物不足,有机硒转化率下降;高浓度的亚硒酸钠存在细胞毒性和基因组损伤[23-24],严重影响细胞的生长和代谢。因此选择亚硒酸钠添加量为5 mg/L。由图2E可知,一定浓度的CaCO3对乳酸菌BN1005的富硒量和富硒率有显著的提高。徐颖等[14]通过调整培养基初始pH值到6.4时,培养48 h,鼠李糖乳杆菌富硒量和富硒率达到最大值,过低或过高的pH都不利于鼠李糖乳杆菌(Lactobacillus rhamnosus)的富硒,并认为可能是硒蛋白转化的酶系反应对pH值有一定要求。乳酸菌产酸能力较强,培养基中加入一定浓度CaCO3有助于稳定pH值,以保证有机硒转化反应环境的稳定。因此选择CaCO3添加量为15g/L。由图2F可知,当NaCl添加量从1 g/L增加至3 g/L时,菌株生物量影响并不显著,但对乳酸菌BN1005富硒量和富硒率的提高是极显著的,富硒量和富硒率分别从529.82 μg/g、49.26%提高至604.88 μg/g、53.81%,说明低浓度的NaCl可以促进乳酸菌BN1005有机硒的转化;但高浓度的NaCl会显著降低细胞富硒能力。细胞内外NaCl的高浓度差会导致细胞膜组成(脂质多糖和脂肪酸残基)的改变,膜的渗透性发生变化,细胞内水分外流,细胞体积减小[25]。因此选择NaCl添加量为3 g/L。

图2 培养基不同组成成分对乳酸菌BN1005富硒能力的影响Fig.2 Effect of different medium composition on the selenium enrichment ability of lactic acid bacterium BN1005
综上所述,乳酸菌BN1005富硒培养基优化后确定其培养基组成为葡萄糖35 g/L,复合有机氮源15 g/L,柠檬酸三铵1.5 g/L,亚硒酸钠5 mg/L,CaCO315 g/L,NaCl 3 g/L。
2.2.2 响应面试验设计结果与分析
采用Design Expert 8.0.6软件对表1数据进行多元回归拟合,得到其二次多项回归模型为Y=607.52+4.81A+4.52B+4.22C-0.75AB-3AC-2.38BC-25.68A2-42.80B2-2.53C2。由表2可知,模型P=0.000 1<0.01,失拟项P=0.222 4>0.05,说明该模型回归显著。当模型的判定系数R2值越接近于1时表明实际值和预测值之间的相关性更好[26],本模型判定系数R2=0.986 5,模型拟合性较好。调整判定系数R2Adj=0.969 1,表明96.91%的试验数据的变异性可用此回归模型解释。
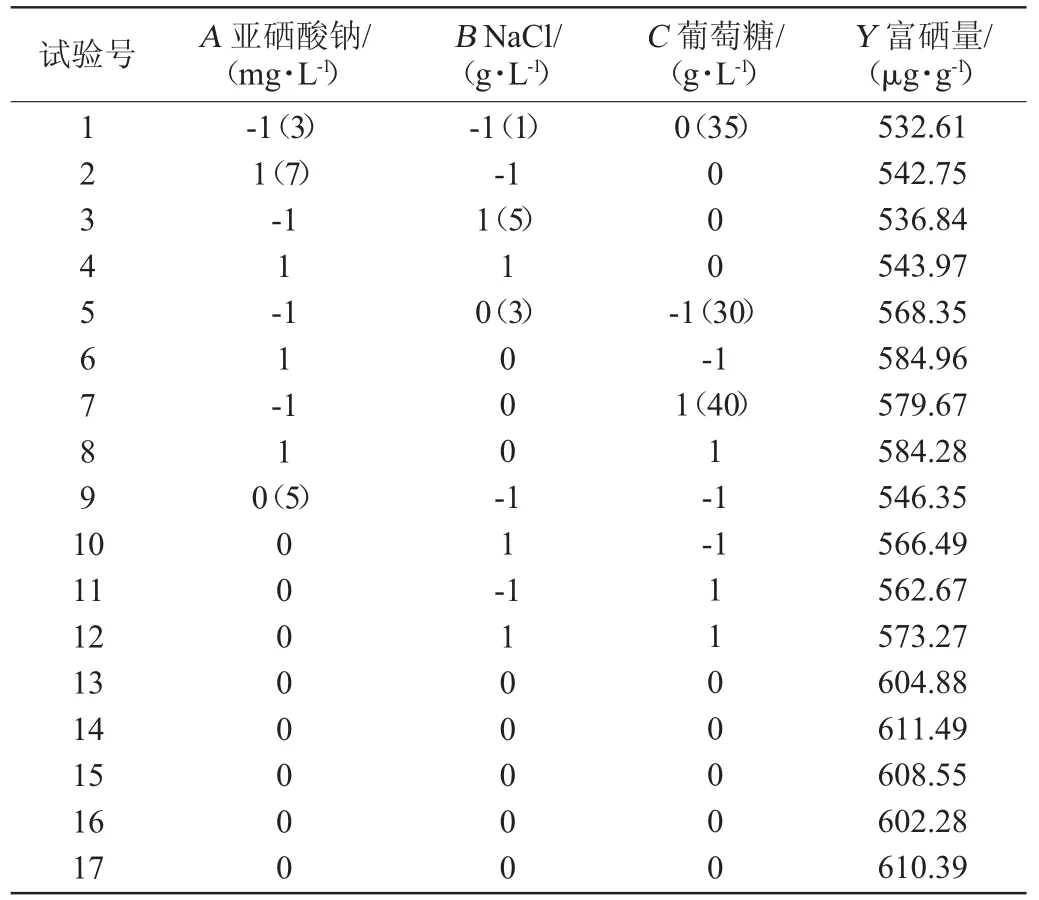
表1 乳酸菌BN1005富硒发酵培养基组成优化响应面试验设计与结果Table 1 Design and results of response surface methodology for medium formula optimization of selenium enrichment fermentation of lactic acid bacterium BN1005
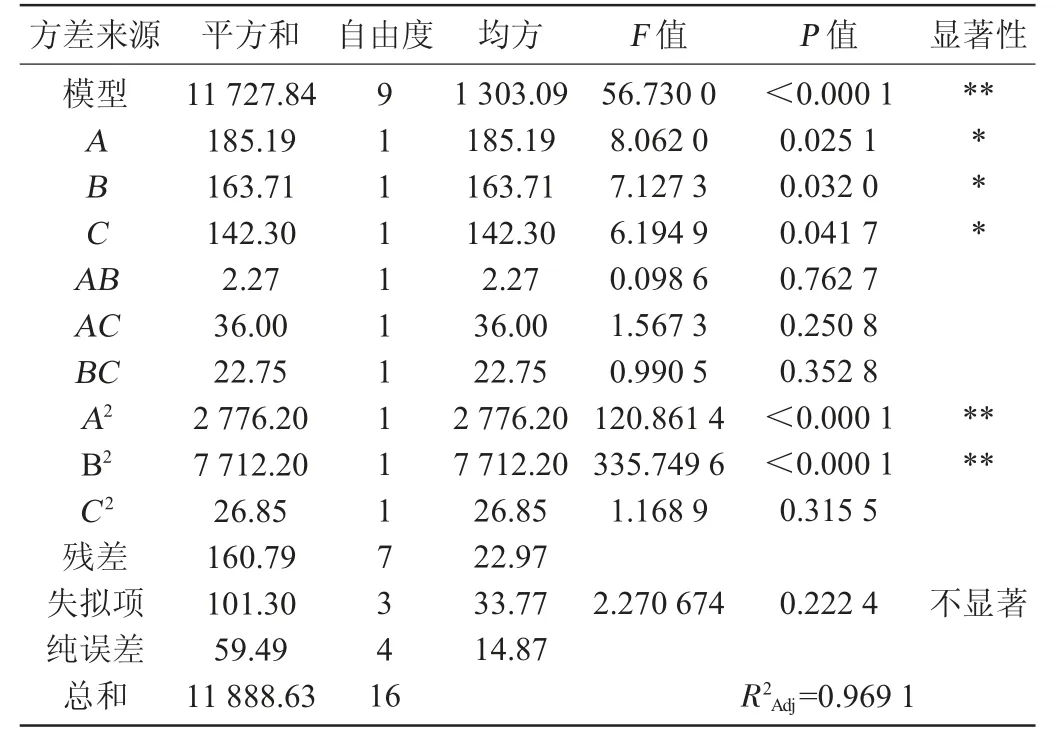
表2 模型回归方程方差分析Table 2 Variance analysis of regression equations
各因素交互作用对乳酸菌BN1005富硒量的影响见图3。由图3可知,随着亚硒酸钠添加量的增加乳酸菌BN1005富硒量是呈现先增加后降低的趋势,且存在极高值点;随着NaCl添加量的增加乳酸菌BN1005富硒量是呈现先增加后降低的趋势,且存在极高值点;随着葡萄糖添加量的增加乳酸菌BN1005富硒量变化趋势较小,结合方差分析中P值大小,在本试验各因素水平范围内影响乳酸菌BN1005富硒量的主次因素A>B>C,即亚硒酸钠>NaCl>葡萄糖。各曲面图上升和下降的波度较缓,且等高线疏密度变化不明显,一次项A、B、C对结果影响显著(P<0.05),二次项A2、B2对结果影响极显著(P<0.01),交互项AB、AC、BC和二次项C2对结果影响不显著(P>0.05),与模型方差分析一致。
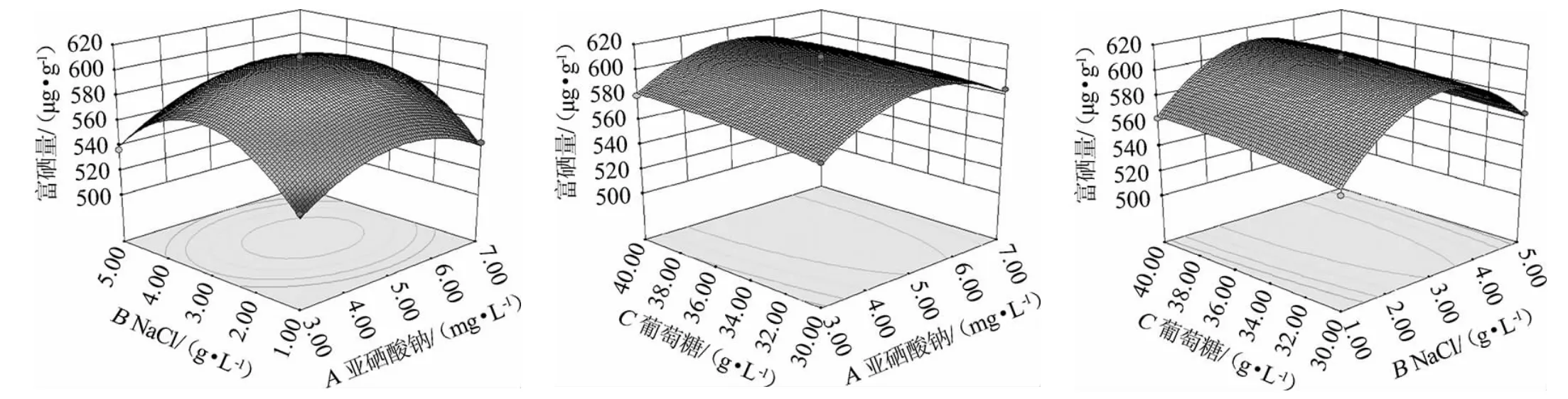
图3 亚硒酸钠、NaCl与葡萄糖添加量交互作用对富硒量影响的响应曲面与等高线Fig.3 Response surface plots and contour lines of effects of interaction between sodium selenite,NaCl and glucose addition on selenium enrichment content
通过Design-Expert 8.0.6软件对回归方程求解得到模型最大值,即亚硒酸钠5.0 mg/L,NaCl 3.0 g/L,葡萄糖39.0 g/L,此时菌体富硒量预测值为609.37 μg/g。在预测最佳培养基配方条件下进行发酵试验,做3个重复,所得的实际菌体富硒量为607.52 μg/g,与预测值接近,说明该模型合理可行的。
3 讨论
乳酸菌是公认的益生菌,广泛用于食品、饮料和动物营养产品的发酵生产。乳酸菌可以将有毒的无机硒转化为对人与动物安全的菌体有机硒。LV C H等[27]在日均温度38 ℃环境下,以饲喂基础日粮和无机硒为对照,给断奶仔猪饲喂益生菌和富硒益生菌(嗜酸乳杆菌和酿酒酵母)第28天和第42天时仔猪粪便中乳酸菌数量较高,而大肠杆菌数量较低;饲喂42 d时富硒益生菌组的仔猪体质量以及血液的硒浓度、谷胱甘肽过氧化酶浓度均显著高于其他3组;富硒益生菌相对于单纯的益生菌表现出了对断奶仔猪更好的抗热应激和生长促进作用。YANG J等[28]通过小鼠实验、牛津杯法和共培养法证明了富硒益生菌(包括产朊假丝酵母、嗜酸乳杆菌、鼠李糖乳杆菌和嗜热链球菌)在体内体外均可有效抑制大肠杆菌生长,富硒益生菌可改善机体抗氧化状态,增强免疫力,改善肠道内部环境。IBRAHIMHAM等[29]通过给高血脂症雄性小鼠饲喂添加益生菌、无机硒或富硒益生菌的饲料发现富硒益生菌(富硒产朊假丝酵母和富硒嗜热链球菌)组比益生菌组和无机硒组更有效地降低小鼠血脂水平。
4 结论
该试验采用单因素试验和响应面试验优化了乳酸菌BN1005振荡发酵培养条件。结果表明,乳酸菌BN1005的富硒最优培养基组成为葡萄糖39.0 g/L,复合有机氮源15.0 g/L,柠檬酸三铵1.5 g/L,吐温-80 1.08 g/L,MgSO4·7H2O 0.2 g/L,K2HPO42.0 g/L,MnSO4·4H2O 0.05 g/L,CaCO315.0 g/L,NaCl 3.0 g/L;培养条件为接种量10%,装液量60 mL/250 mL,恒温37 ℃、100 r/min振荡培养36 h,亚硒酸钠5.0 mg/L,亚硒酸钠添加时间为8 h。在此条件下,乳酸菌BN1005富硒率从7.22%提高至53.81%;富硒含量由305.9 μg/g提升至607.52 μg/g。说明乳酸菌BN1005具有较好的富硒能力,在富硒食品与富硒益生菌发酵饲料的开发中具有较好的应用前景。
