新疆新源县酸马奶细菌菌群分析
2021-06-04高世南徐志华雷勇辉孙燕飞
高世南,徐志华,李 杨,雷勇辉,孙燕飞*
(1.石河子大学 生命科学学院,新疆 石河子 832003;2.石河子大学农学院,新疆 石河子 832003)
马奶发酵后的酸马奶是具有草原特色的传统发酵饮品。酸马奶又称为马奶酒、策勒(我国内蒙古自治区常用)、艾日格(蒙古国常用)等,是以新鲜马奶为原料,结合自然发酵和传统发酵技术制成的一种古老的乳酸菌保健品[1]。在新疆地区的哈萨克族和蒙古族牧民家庭中,至今还保留着制作和饮用酸马奶的习俗[2]。新鲜马奶自采集后的短时间内,在含有的多种微生物菌群共同互助作用下会自然发酵产生口味变酸的现象,成为酸味的乳制品[3]。酸马奶风味的改变和其中的发酵微生物有密切联系,酸马奶中的发酵微生物群落结构复杂,包括多种类型的乳酸菌(如嗜温乳杆菌、嗜酸乳杆菌、乳杆菌、乳球菌、嗜热乳杆菌等),酵母菌(如乳糖发酵酵母、非乳糖发酵酵母、单孢酵母等)以及其他未鉴定出的菌种[4]。
自1895年对酸马奶自然发酵过程中起重要作用微生物的研究开始,许多研究人员已经对中国新疆地区[5]、内蒙古锡林郭勒地区[6-7]、蒙古国[8]等的酸马奶采用了包括传统鉴定培养、焦磷酸高通量测序技术、Illumination MiSeq高通量测序技术、Pacbio SMRT第三代测序技术等在内的方法研究酸马奶中微生物群落多样性,这些研究大多数集中于乳酸菌菌群多样性,分析发酵酸马奶中乳酸菌属在发酵过程中丰富度和多样性变化。这表明新鲜马奶在采集后的自然发酵过程中,乳酸菌菌群发挥着至关重要的作用,马奶中蕴含丰富的乳酸菌资源。
近年来,许多研究人员利用微生物菌剂改良盐碱地并取得了良好效果:逄焕成等[9]通过玉米盆栽试验,表明施用微生物制剂能够降低盐碱土的pH和含盐量,并对玉米的株高和地上部分干物质的积累有促进作用;王维华等[10]对不同盐梯度的土壤施用乳酸菌菌肥,结果表明乳酸菌菌肥可以提高盐胁迫下其他微生物的活性;侯景清等[11]以西红柿为材料进行田间试验,认为施加乳酸菌复合制剂能够显著降低盐碱土的pH,增加土壤养分,并且能够降低土壤中病原微生物的数量。这显示了乳酸菌菌剂对于改良盐碱土具有较大的应用潜力。
本研究选用Illumina MiSeq高通量测序技术,分析了采集于新疆那拉提大草原的新鲜马奶在自然发酵变酸后细菌的菌群结构;并对其可培养优势菌群(乳酸菌)进行分离纯化鉴定,为将来将其应用在新疆盐碱地改良方面奠定基础,亦为新疆酸马奶中乳酸菌资源开发和利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品的采集
将采集于新疆伊犁新源县那拉提草原的新鲜马奶分装入无菌容器中,低温保存带回实验室,在4 ℃冰箱中保存备用。
1.1.2 培养基
MRS培养基[12]:酵母浸粉5.0 g/L,葡萄糖20.0 g/L,蛋白胨10.0 g/L,牛肉膏8.0 g/L,无水乙酸钠5.0 g/L,柠檬酸氢二铵2.0 g/L,磷酸氢二钾2.0 g/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,吐温-80 1 mL/L,pH 6.2~6.4。
牛肉膏蛋白胨液体培养基:氯化钠5.0 g/L,蛋白胨10.0 g/L,牛肉膏3.0 g/L,pH 7.4~7.6。
糖类发酵培养基:溴甲酚紫(1.6%)1 mL,肉膏5.0 g/L,糖(或醇)1%,蛋白胨10.0 g/L,pH7.6。
1.1.3 主要试剂
Taq酶(5 U/μL):大连TAkaRa公司;氯化钠、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、琼脂、蛋白胨、葡萄糖、牛肉膏、柠檬酸氢二铵、吐温-80、磷酸氢二钾、硫酸镁、15%过氧化氢、结晶紫染液、番红染液、体积分数95%乙醇、琼脂糖、TE缓冲液等(均为分析纯或生化试剂):天津市北联精细化学品开发有限公司。
1.2 仪器与设备
SW-CJ-1F超净工作台:苏州净化设备有限公司;RS-232精密电子天平:上海恒平科学仪器有限公司;FroFleX聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技有限公司;DNP-9272电热恒温培养箱:上海精宏设备实验有限公司;HY-5A回旋式振荡器:江苏省金坛市荣华仪器制造有限公司。
1.3 方法
1.3.1 酸马奶可培养和不可培养细菌菌群高通量测序分析
无菌条件下选择适量酸马奶样品与蒸馏水按照体积比为1∶10进行稀释,将稀释好并振荡均匀的酸马奶样品选择部分分批次进行0.22 μm的滤膜抽滤:样品标号后,使用减压抽滤装置进行振荡液抽滤富集;待锥形瓶内的所有振荡液抽滤完毕,用干净的分装袋封存滤膜送样至上海美吉生物公司完成高通量测序。样本的16S rDNA V4区(引物为515F和806R)高通量测序后,对优化序列在97%水平上归并划分可操作分类单元(operational taxonomic unit,OTU),将高质量丰度的序列作为该OTU的代表性序列,相似度大于97%的序列将聚为同一个OTU,用于细菌菌群结构的分类地位鉴定,在不同分类水平上分析该样品中细菌群落的含量及种群结构差异[13]。
1.3.2 Alpha多样性分析
对新疆伊犁那拉提大草原酸马奶高通量测序结果进行Alpha多样性的相关分析,应用QIIME(1.8.0)软件平台计算酸马奶样本细菌群落的生物多样性,绘制稀疏曲线,由此来判定当前样本的测序深度是否能够完全呈现该菌群群落样本所包含的微生物多样性。超(Chao)1指数用来评估物种总数,ACE指数估计群落中包含的OTU数目,两者主要是侧重表现群落丰富度;香农指数和辛普森指数评估样本中群落多样性。目的在于对OTU丰度矩阵中的酸马奶样本在90%的最低测序水平深度下,随机抽取样本后,使用平台运算上述4种多样性指数。
1.3.3 酸马奶中乳酸菌的分离纯化和保藏
利用MRS分离鉴定培养基,灭菌后与乳酸菌培养的同等条件下进行恒温培养24 h,排除培养基污染因素,将酸马奶按10倍稀释法进行稀释分离,移取稀释液0.1 mL涂布于MRS培养基上,37 ℃恒温培养24~72 h[14]。根据乳酸菌菌落和菌体形状圆形、表面凸起、边缘光滑、颜色呈乳白色等特征镜检确认后[15],随机挑取不同的疑似单菌落,平板划线纯化2~3次,将纯化后的疑似乳酸菌于MRS斜面培养,4 ℃干燥冷藏。
1.3.4 分离菌株的生理生化鉴定
将分离纯化后的单菌落进行形态学鉴定,观察乳酸菌菌落形态特征和细胞形态,同时进行革兰氏染色、过氧化氢酶接触实验、糖发酵实验以及生长温度实验,对菌株进行初步鉴定。最后依据以上实验结果,将革兰氏染色阳性、接触酶试验阴性的菌株暂时认定为乳酸菌[16],进行下一步的基因型分子鉴定分析,给疑似菌株编号并采用斜面4 ℃低温保藏。
1.3.5 分离菌株的分子生物学鉴定
采用传统DNA抽提法(酚-氯仿法)[17],提取酸马奶样品中分离纯化得到的乳酸菌的总DNA。将抽提的样本DNA进行浓度检测,选择OD260nm/OD280nm=1.8~2.0且波长260 nm处有明显吸收峰的样本,利用1%的琼脂糖凝胶电泳检测其完整性。采用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-ACCTTGTTACGACTT-3')扩增16S rDNA全长PCR扩增条件:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共进行30个循环;最后72 ℃延伸10 min。将PCR扩增产物送上海美吉生物公司进行测序,将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)序列比对,用Mega软件建立系统发育树。
2 结果与分析
2.1 酸马奶中OTU划分和细菌多样性组成分析
通过Illumination MiSeq高通量测序,酸马奶样品中的菌群微生物多样性指数如表1所示。由表1可知,总共产生了高质量有效16Sr RNA基因序列38 901条,依据样本基因序列相似程度来归并划分OTU,一共获得了235个OTU;Chao1和ACE指数分别为249.76、252.23,表明OTU数目较多,酸马奶中细菌菌群丰富度较大;香农(Shannon)和辛普森(Simpson)指数分别为1.41和0.47,表明细菌菌群多样性较低。
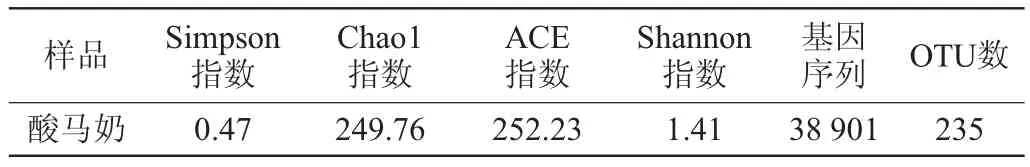
表1 酸马奶菌群微生物多样性指数Table 1 Diversity index of microbial flora in koumiss
可分类操作单元OTU在Alpha多样性分析以及对于各分类水平划分都具有非常重要的意义。对样本进行16S rDNA高通量测序后,最终酸马奶样品的细菌菌群可以注释到17个门、36个纲、73个目、110个科、156个属,核心OTU为乳杆菌属以及醋杆菌属。
2.2 Alpha多样性分析
由图1A可知,酸马奶样本的稀释性曲线随着抽取序列数的增加还未进入平台期;但根据图1B和图1C可知,Shannon曲线以及Chao1曲线均倾向于平缓:其中Chao1曲线进入到了平台期,且Shannon曲线也已饱和,说明在本次研究中所得到的样本测序结果可以充分体现当前样本所包含的细菌多样性,满足了细菌测序量后继所需的生物信息学分析要求。酸马奶细菌菌群多样性已经不会再随着样本总量的增加而有较大的改变,即使测序深度继续增加也已无法检测出大量还未发掘的新型菌种,现有的测序结果足以反映大多数细菌菌群的物种信息;根据图1D可知,Rank-Abundance曲线在横坐标上的范围下降快速,反映酸马奶样本中优势菌群所占比例很高,细菌多样性较低。
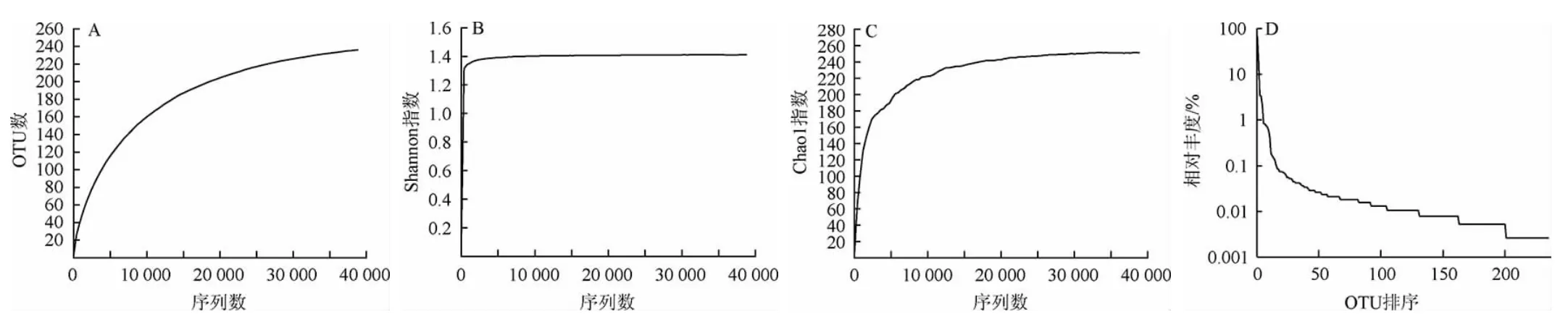
图1 酸马奶样品的Alpha多样性分析结果Fig.1 Alpha diversity analysis results of koumiss
2.3 群落结构分析
酸马奶的细菌群落结构如图2所示。该酸马奶样本从门的分类水平上来看,细菌菌群中优势门为厚壁菌门(Firmicutes)占所有菌群的85.78%,其次为变形菌门(Proteobacteria)占12.72%,其他门占1.50%;从纲的分类水平上看,细菌菌群的优势纲为芽孢杆菌纲(Bacilli)占所有菌群的85.52%,γ-变形杆菌纲(Gammaproteobacteria)、α-变形杆菌纲(Alphaproteobacteria)和β-变形杆菌纲(Betaproteobacteria)也均有分布,分别占6.54%、4.39%和1.82%;从目的分类水平上,细菌菌群的优势目是乳杆菌目(Lactobacillales),占所有菌群的85.51%,分布较多的还有红螺菌目(Rhodospirillales)和假单胞菌目(Pseudomonadales),分别占3.54%和3.44%;在科的分类水平上,细菌菌群中的优势科是乳杆菌科(Lactobacillaceae)占所有菌群的83.95%,醋杆菌科(Acetobacteraceae)和莫拉氏菌科(Moraxellaceae)也有分布,分别占3.42%和3.25%;在属的分类水平上来看,细菌菌群中优势菌属为乳杆菌属(Lactobacillus)占83.95%,醋杆菌属(Acetobacter)占3.36%,不动杆菌属(Acinetobacter)占3.24%,肠杆菌属(Enterobacter)占2.04%,其他菌属占7.40%。

图2 酸马奶样品中细菌相对丰度Fig.2 Relative abundance of bacteria in koumiss samples
2.4 乳酸菌的形态特征
从酸马奶中分离纯化出1株菌株MN-Is,参照文献[18]观察其菌落形态以及细胞形态,如图3所示,菌落形态观察为圆形,乳白色,边缘光滑,表面突起,菌株革兰氏染色结果为紫色,由此推断菌株MN-Is属于革兰氏阳性菌。
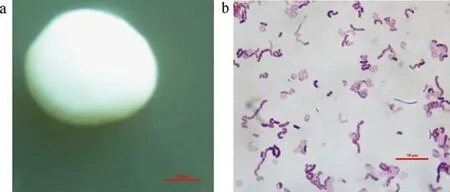
图3 菌株MN-Is菌落形态图(a)和革兰氏染色图(b)Fig.3 Colony morphology (a) and Gram chromatogram (b) of strain MN-Is
2.5 菌株MN-Is生理生化检测
菌株MN-Is的生理生化试验结果如表2所示:细胞无运动行为,接触酶试验为阴性,能够在15 ℃以及45 ℃条件下生长,能够利用葡萄糖、麦芽糖、半乳糖等碳源,不能利用棉籽糖[19]。结合形态观察及生理生化初步经鉴定为乳杆菌属(Lactobacillussp.)。

表2 菌株MN-Is的生理生化试验结果Table 2 Results of physiological and biochemical tests of strain MN-Is
2.6 乳酸菌的系统进化分析
菌株MN-Is的系统发育树见图4,菌株MN-Is与通过结合菌株MN-Is形态特征、生理生化特性检测结果,鉴定出菌株MN-Is属于乳杆菌属(Lactobacillus)。

图4 基于16S rDNA基因序列菌株MN-Is的系统发育树Fig.4 Phylogenetic tree of strain MN-Is based on 16S rDNA gene sequences
3 讨论
传统纯培养方法分离出酸马奶中的乳酸菌种类有限,仅分离得到优势属中的乳杆菌属,可能的原因是研究中采用MRS培养基进行分离纯化,其成分含量并不能适用于所有乳酸菌,在后续的研究中应利用不同种类的培养基。其次,研究中采用的培养温度是37 ℃,根据张兰威等[20]的研究表明,温度会影响混合生长的乳酸菌培养,且当温度达到44 ℃时,有利于不同乳酸菌的生长比例到达平衡,这提示在后续试验中应设置不同的温度梯度,以适应不同种类乳酸菌的生长。
不同地区酸马奶的细菌菌群结构差异并不十分明显,乌日汗等[21]采用Illumina MiSeq第二代测序技术对内蒙古科尔沁地区的酸马奶进行了细菌多样性分析,结果表明酸马奶引子中细菌主要分布于四个属:乳杆菌属、醋杆菌属、乳球菌属和链球菌属,其中乳杆菌属是绝对优势菌群;布仁其其格等[22]采用454焦磷酸测序分析内蒙古锡林郭勒地区酸马奶不同发酵时期的细菌群落结构,结果表明酸马奶中乳杆菌属是优势细菌属,乳球菌属是次优势细菌属。此外,还分布有醋酸菌属和不动杆菌属等多种细菌;赵飞燕等[23]利用PacBio SMRT测序技术分析内蒙古锡林郭勒地区鲜马奶的细菌多样性,结果表明在细菌属水平,优势菌群主要有芽孢杆菌属(23.44%)、乳球菌属(18.18%)和类芽孢杆菌属(13.8%),这提示鲜马奶的细菌多样性比发酵后的酸马奶更丰富。
4 结论
采用Illumina MiSeq高通量测序首次对新疆新源县那拉提草原的酸马奶细菌菌群结构的多样性进行了分析与鉴定。结果表明,酸马奶的细菌菌群结构丰富,但菌群多样性较低,其中厚壁菌门(Firmicutes)为酸马奶中的优势菌门,占所有菌群的85.78%;乳杆菌属(Lactobacillus)为酸马奶中的优势菌属,占所有菌群的84%。通过传统培养分离方法分离出1株菌,编号为MN-Is,经形态观察、生理生化试验及分子生物学鉴定为乳杆菌属(Lactobacillus)。
