Regorafenib联合TAS102新策略治疗肝细胞癌的研究
2021-06-04董宇华张梦琪
章 俊,董宇华,杨 叶,张梦琪,何 常
1.贵州医科大学病理学教研室,贵州 贵阳 550004;2.贵州医科大学附属医院病理科,贵州 贵阳 550004;3.贵州医科大学生理学教研室,贵州 贵阳 550004
瑞格菲尼(regorafenib,REG)是一种新型多靶点酪氨酸激酶抑制剂,是治疗原发性肝癌的规范用药之一[1]。临床试验证实其能改善sorafenib治疗耐受晚期肝癌患者的生存时间[2]。TAS102是由曲氟尿苷(trifluridine,FTD)及胸苷磷酸化酶抑制剂(tipiracil hydrochloride,TPI)按摩尔浓度2∶1比例制成的一种新型口服配方化疗药物,临床试验[3-4]证实TAS102可显著改善多耐药性消化道肿瘤的疗效,延长患者的生存时间。多项研究[5-9]报道REG或TAS102分别联合其他化疗药物或靶向药物能够有效控制消化道肿瘤的进展。
肿瘤干细胞(cancer stem cell,CSC)决定肿瘤的自我更新及异质性,促进肿瘤的生长、复发、转移及药物耐受等,靶向肿瘤干细胞对拮抗肿瘤的演进及治疗耐受提供了一条重要途径[10]。大量研 究[11-12]证实靶向肿瘤干细胞能够改善肿瘤细胞对抗肿瘤药物的敏感性,抑制肿瘤生长、复发及转移。我们报道了靶向氧化应激信号能够下调肝癌细胞的干细胞性并抑制肝细胞癌(hepatocellular carcinoma,HCC)细胞的增殖[13]。
研究[5]证实序贯给予REG和TAS102能够有效控制晚期结肠癌的进展。我们报道了FTD类似物5-FU联合REG显著改善多耐药性转移性结肠癌患者的预后[14]。因此,本研究拟探讨REG联合TAS102靶向CSC治疗HCC的疗效及潜在机制,以期为临床治疗难治性肝癌提供新的可供选择的联合治疗策略。
1 材料和方法
1.1 材料
1.1.1 实验试剂
生化试剂TAS102(货号S81525,纯度98%)和REG(货号R843747,纯度98%)均购自美国MedKoo Biosciences公司,干细胞培养基购自加拿大Stemcell Technologies公司,CD133-conjugated PE荧光抗体购自英国Abcam公司,乙醛脱氢酶1A(aldehyde dehydrogenase 1A,ALDH1A)及髓细胞白血病-1蛋白(myeloid cell leukemia-1,MCL1)抗体购自美国Cell Signaling Techonology公司,GAPDH和干细胞标志分子SRY相关的高迁移率族盒蛋白-2(SRY-related high mobility group box protein-2,SOX2)抗体购自美国Santa Cruz公司,胎牛血清、青链霉素双抗、DMEM及PRMI-1640培养基均购自美国Invitrogen公司。
1.1.2 实验细胞
本研究使用的3种人肝癌细胞系HepG2、Huh7及SK-Hep1均购自中国科学院典型培养物保藏委员会昆明细胞库。HepG2及Huh7均是人HCC细胞株,HepG2来源于儿童肝母细胞瘤,Huh7来源于高分化HCC。二者均表达甲胎蛋白(alpha fetoprotein,AFP)、未检出乙肝病毒(hepatitis B virus,HBV)。SK-Hep1来源于肝腺癌患者腹水中的上皮细胞。按照细胞库推荐的培养基,HepG2、Huh7及SK-Hep1分别培养于含10%胎牛血清及100单位/100 mL青链霉素的DMEM或RPMI-1640培养基,并放置于含CO2体积分数为5%、湿度95%的37 ℃培养箱,细胞丰度达80%~90%,进行传代。
1.1.3 实验动物
BALB/c雌性4~6周龄裸小鼠购自北京华阜康生物科技股份有限公司,荷瘤成功后饲养于贵州医科大学实验动物中心,生产许可证为SYXK(黔)2018-0001。
1.2 方法
1.2.1 实验分组
分组分为对照(control)组、REG组、TAS102组和REG+TAS102组。实验细胞分组见 表1。实验动物分组见表2。
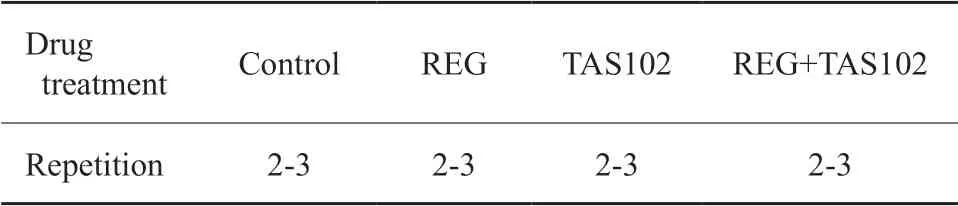
表1 不同药物处理的细胞实验分组Tab.1 Cell experiment grouping with treatment of different regimens
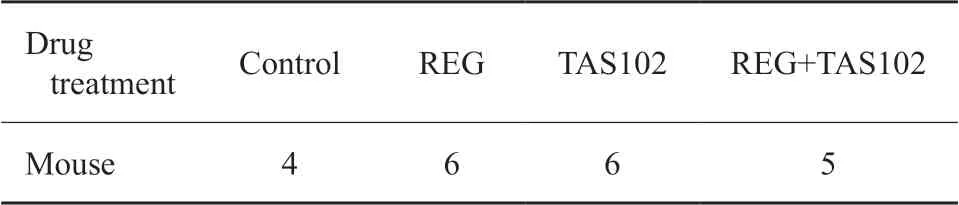
表2 不同药物处理的动物实验分组Tab.2 Mouse experiment grouping with treatment of different regimens
1.2.2 细胞计数试剂盒(cell counting kit-8,CCK-8)检测细胞活力
将4 000个HCC细胞接种到96孔板中,过夜贴壁后加入2 mol/L TAS102 及 5 mol/L REG分别或联合使用处理48 h。加入10 μL CCK-8试剂温育2 h,使用酶标仪检测每孔溶液450 nm处的吸光度(D)值。通过CCK-8[化学名:2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐]检测细胞线粒体脱氢酶活性,定量评估细胞活力。
1.2.3 CD133阳性干细胞亚群比例的检测
不同药物处理48 h后的HCC细胞,使用偶联荧光素藻红蛋白(phycoerythrin,PE)的CD133荧光抗体温育30 min后,采用流式细胞仪(美国BD公司)检测CD133阳性细胞的百分比;结果用二维图示。
1.2.4 肝癌干细胞球(HCC sphere)的培养
按每孔20 000个HCC细胞接种到24孔的低黏附性培养板,使用含不同药物的肿瘤干细胞培养基体外培养肝癌细胞8 d,观察孔内HCC sphere的形成及生长,倒置显微镜(购自日本Olympus公司)观察及测量细胞球并对直径>60 μm细胞球 计数。
1.2.5 蛋白质印迹法(Western blot)检测细胞内蛋白水平
收集不同药物处理后的细胞,使用RIPA缓冲液裂解收集总蛋白,BCA法定量后,按每孔等量12~20 g蛋白上样于10%~12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE)胶中,置于恒定电压缓冲系统(XCell system,美国Invitrogen公司)中分离不同相对分子质量蛋白电泳条带。分离胶中不同相对分子质量蛋白在恒定电流缓冲系统(Bio-Rad,美国Invitrogen公司)转移到PVDF膜上,使用10%脱脂牛奶封闭后,与一抗4 ℃过夜温育、相应偶联辣根过氧化物酶二抗温育,全自动凝胶成像仪显示蛋白条带。Image J软件测量蛋白条带的平均光密度值(average optical intensity,AOI)蛋白条带灰度,与内参蛋白GAPDH AOI比较,计算各种蛋白的相对含量。
1.2.6 动物实验
本课题设计已通过贵州医科大学伦理委员会认证,所涉及实验动物的使用及操作,均严格遵循“减少、替代、优化”的3Rs原则。BALB/c裸小鼠皮下每部位接种2×106个细胞,荷瘤成功后使用游标卡尺间隔2~3 d测量瘤体长径和短径,按照公式0.5×长×宽2计算瘤体体积并绘制生长曲线,约4周麻醉处死动物,剥离瘤体并称重。
1.2.7 药物处理
细胞实验使用2 mol/L TAS102及5 mol/L REG分别或联合使用处理3种HCC细胞;动物实验TAS102溶解于5%羟丙基甲基纤维素配制成终浓度20 mg/mL溶液,4 ℃储存备用。REG溶解于体积比为42.5%∶42.5%∶15.0%的聚丙二醇/聚乙二醇/聚氧乙烯聚氧丙烯醚嵌段共聚物188溶液中,配制成终浓度为1 mg/mL溶液,4 ℃储存备用。TAS102按每日100 mg/kg每日2次灌胃给药,REG按每日50 mg/kg每日1次灌胃给药。连续给药 3周。
1.3 统计学处理
2 结果
2.1 REG和TAS102单药及联合使用降低肝癌细胞活力
CCK-8检测结果发现,REG及TAS102单药或联合处理,较对照组均显著减低了3种肝癌细胞活力(HepG2:Control组为0.491±0.023,TAS102组为0.388±0.013,REG组为0.380±0.022,REG+TAS102组为0.379±0.014;Huh7:Control组为0.738±0.018,TAS102组为0.571±0.011,REG组为0.534±0.015,REG+TAS102组为0.564±0.011;SK-Hep1:Control组为0.696±0.014,TAS102组为0.493±0.034,REG组为0.465±0.047,REG+TAS102组为0.388±0.007)(图1,P<0.05)。其中SK-Hep1细胞中联合用药较2种单药处理显示了增强的细胞活力抑制作用,而在HepG2及Huh7细胞中,联合用药没有显示显著增强的联合抑制效应。
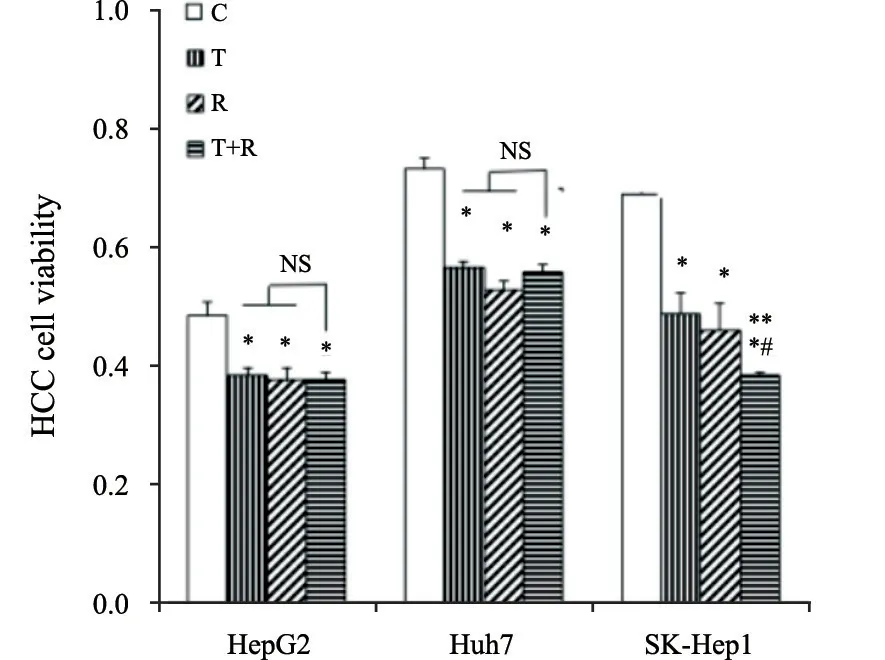
图1 REG联合TAS102处理对HCC细胞活力的影响Fig.1 The effect of REG in combination with TAS102 on liver cancer cell viability
2.2 TAS102下调REG诱导增加的CD133阳性(+)细胞亚群比例
CD133是肝癌干细胞(liver cancer stem cell,LCSC)表面重要的标志分子。流式细胞术检测结果发现,TAS102单药显著降低了3种细胞中CD133+细胞亚群比例(HepG2:Control组为53.33%±3.22%,TAS102组为13.11%±2.76%;Huh7:Contro l 组为49.14%±3.32%,TAS102组为18.28%±2.56%;SK-Hep1:Control组为58.73%±4.22%,TAS102组为15.37%±2.76%)(图2 A、B,P<0.05)。在HepG2及Huh7细胞中,5 mol/L REG单药处理显著提高了CD133+细胞亚群比例(HepG2 REG组为78.19%±4.93%;Huh7 REG组为82.46%±2.28%)(图2A、B,P<0.05)。较REG单药处理,联合用药显著减低了CD133+细胞亚群比例(HepG2 REG+TAS102组为56.32%±2.00%;Huh7 REG+TAS102组为33.28%±2.90%)(图2A、B,P<0.05)。在SK-Hep1细胞中,不同用药组均显著下调了CD133+细胞亚群比例(SK-Hep1:Control组为58.73%±4.22%,REG组为29.29%±4.28%,TAS102组为15.37%±2.76%,REG+TAS102组为18.48%±3.00%)(图2A、B,P<0.05)。
2.3 REG联合TAS102调控SOX2、ALDH1A及MCL1的表达
本研究结果发现,TAS102单药处理3 株细胞时,与对照组(SOX2:Huh7 为1.00±0.03,HepG2为0.70±0.05,SK-Hep1为1.71±0.15;ALDH1A:Huh7为1.62±0.03,HepG2为1.40±0.07,SK-Hep1为1.59±0.02)相比,SOX2(Huh7为0.50±0.09,HepG2为0.42±0.11,SK-Hep1为1.15±0.03)及ALDH1A(Huh7为0.72+0.01,HepG2为1.10±0.01,SK-Hep1为0.88±0.02)的蛋白相对表达水平显著减低(图3A~C,P<0.05)。HepG2及Huh7细胞中,REG单药处理(SOX2:Huh7为1.19±0.04,HepG2为0.78±0.02;ALDH1A:Huh7为1.48+0.03,HepG2为1.62±0.02)与control组相比,对SOX2及ALDH1A的蛋白水平调控作用不明显或轻度升高(图3A~C)。联合用药较REG单药处理(SOX2:Huh7为0.54±0.05,HepG2为0.60±0.06;ALDH1A:Huh7为0.60±0.04,HepG2为1.28±0.03)显著下调了SOX2及ALDH1A的蛋白水平(图3A~C,P<0.05)。在SK-Hep1中,不同给药组均显著下调SOX2(control组为1.71±0.15,TAS102组为1.15±0.03,REG组为1.25±0.03,REG+TAS102组为0.51+0.02)及ALDH1A(control组为1.59±0.02,TAS102组为0.88±0.02,REG组为1.08±0.02,REG+TAS102组为0.86±0.02)的蛋白水平(图3 A~C,P<0.05)。此外,3种细胞中REG单药处理(Huh7为0.17±0.03,HepG2为0.13±0.00,SK-Hep1为0.35±0.06)较对照(Huh7为0.40±0.02,HepG2为0.35±0.01,SK-Hep1为1.14±0.11)显著下调了MCL-1水平(图3A、D,P<0.05)。在HepG1及Huh7细胞中,TAS102单药处理较对照组显著提高了MCL-1水平(图3A、D,P<0.05);而联合用药处理(Huh7为0.97±0.05,HepG2为0.47±0.00)较TAS102单药处理显著减低了MCL-1的蛋白水平(图3A、D,P<0.05)。在SK-Hep1中,TAS102对MCL-1的调控不明显(control组为1.14±0.11,TAS102组为1.24±0.04)(图3A、D,P>0.05)。
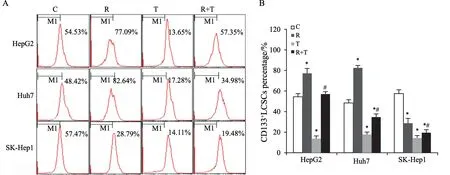
图2 REG联合TAS102处理对CD133+细胞亚群分布的影响Fig.2 The effect of REG in combination with TAS102 on the subpopulation of CD133 positive cells

图3 REG联合TAS102处理对HCC细胞SOX2、ALDH1A和MCL-1蛋白水平的影响Fig.3 The effect of REG in combination with TAS102 on the expression of SOX2,ALDH1A and MCL-1
2.4 REG及TAS102单药及联合使用抑制HCC sphere的形成
进一步我们观察了二者联合处理8 d对干细胞培养基中生长HCC sphere形成的影响。结果发现,不同用药组较对照组均显著抑制了HCC sphere的形成(图4A、B)。TAS102处理对HCC sphere形成的体积大小影响不大(图4A),但显著减少了形成的数量(图4B,P<0.05)。REG单药较TAS102单药显著抑制了HCC sphere形成的体积大小及数量(图4A、B,P<0.05)。Huh7细胞中,联合用药组与两个单给药组HCC sphere形成的数量减少,而HepG2及SK-Hep1中,联合抑制效应不明显(图4A、B)。
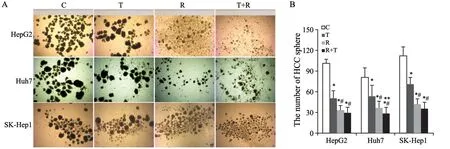
图4 REG联合TAS102对HCC sphere形成的影响Fig.4 The effect of REG in combination with TAS102 on the formation of HCC sphere
2.5 REG联合TAS102抑制动物体内HCC移植瘤的生长
将SK-Hep1及HepG2分别接种在裸小鼠两体侧,荷瘤成功后按照不同药物分别治疗动物3周。结果发现,不同药物处理组较对照组均能显著降低动物体内瘤体的生长;REG单药较TAS102单药抑瘤生长显著;二者的联合使用较单药处理进一步抑制了瘤体生长(图5A、B,P<0.05)。体内实验提示TAS102联合REG较二者单药治疗进一步抑制了动物体内移植瘤的生长。
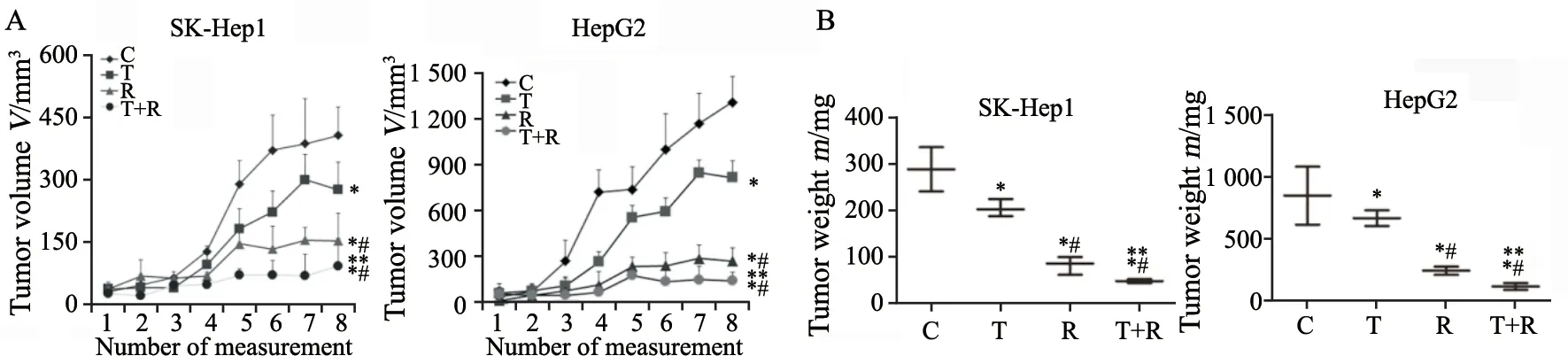
图5 REG联合TAS102对动物体内瘤体生长的影响Fig.5 The effect of REG in combination with TAS102 on tumor growth
3 讨 论
REG是一种靶向VEGFR2、VEGFR3、Ret、KIT、PDGFR及RAF等分子的多靶点酪氨酸激酶抑制剂,能够抑制肿瘤新生血管的生成及细胞增殖。TAS102是治疗消化道恶性肿瘤的新型抗瘤药物。两者分别协同其他化疗药物及靶向药物,为临床治疗晚期肿瘤提供了多种有效的联合新策略。研究[6]发现VEGFR1、VEGFR2、VEGFR3抑制剂nintedanib联合TAS102,促进FTD整合入肿瘤DNA分子,贝伐珠单抗靶向抑制肿瘤血管的生成,联合TAS102显著改善多耐药转移性结肠癌患者的生存率[7]。有研究[14]表明,FTD类似药物5-FU联合REG能有效控制多耐药转移性结肠癌的进展。本研究发现,TAS102及REG单药或联合处理能够下调肝癌细胞活力。二者的联合使用亦显著抑制了HCC sphere的形成。体内实验进一步证实二者联合使用能够显著抑制动物瘤体的生长,提示REG及TAS102的联合使用能够增强抗肝癌治疗作用。
CSC是肿瘤细胞的重要亚群。靶向CSC为治愈肿瘤提供了可能的研究途径。LCSC在无血清悬浮培养的体系中成球生长,较非干性肿瘤细胞,成球细胞的干性标志物的表达显著升高[15]。研究[12]发现FTD显著抑制了肿瘤干细胞球的生长,且较肿瘤细胞更为高效地整合入CD44/CD133阳性细胞的DNA分子,抑制了CSC的自我更新及生长。TAS102能够抑制肿瘤细胞的克隆性生长,并提高了肿瘤细胞对放疗的敏感性[11]。而REG或sorafenib处理原代软组织肉瘤细胞,诱导了ALDH阳性细胞比例升高[16]。本研究发现REG单药处理显著上调了CD133+细胞亚群比例及干细胞标志物SOX2和ALDH1A的蛋白水平,联合使用TAS102较REG单药处理显著降低了CD133+细胞比例及干细胞标志物SOX2及ALDH1A的蛋白水平。提示TAS102的联合使用可能下调了REG单药治疗诱导增强的肝癌干细胞性,从而降低或延缓肝癌细胞对REG单药治疗的耐受。
Sorafenb与REG相似,是一种靶向VEGFR、PDGFR和RAF/MEK/ERK级联的多靶点酪氨酸激酶抑制剂[17]。研究[18]发现sorafenib能够下调抗凋亡蛋白MCL-1水平促进HCC细胞的凋亡。细胞内MCL-1蛋白水平决定HCC细胞对sorafenib治疗的敏感性,高水平的MCL-1诱导HCC细胞对sorafenib治疗的耐受,靶向下调ERK1/2-MCL-1信号促进HCC细胞的凋亡并提高HCC细胞对sorafenib的敏感性[19-20]。我们报道了结肠癌细胞中REG单药能够下调FTD类似物5-FU诱导活化的ERK1/2-MCL-1信号,提高药物的联合效应及肿瘤细胞对药物治疗的敏感性[14]。本研究发现TAS102上调了细胞内MCL-1的蛋白水平,联合使用REG能够下调TAS102诱导升高的MCL-1蛋白水平,提示二者的联合机制亦涉及HCC细胞中MCL-1信号的调控。
有研究[21]表明,REG能够抑制肿瘤生长及间质反应,阻断肿瘤细胞与间质干细胞间的相互促进作用,抑制肿瘤的生长和转移。之前的研 究[22]证实SK-Hep1细胞系具有类似肝血窦内皮的细胞形态及免疫表型。提示药物治疗在肿瘤实质细胞及间质细胞中的作用及机制不同,体内实验综合评估药物作用是必要的。此外,REG处理48 h及8 d后对CD133阳性细胞亚群比例及肝癌干细胞球的生长调控变化不同,提示药物治疗对肿瘤干细胞性的作用是动态变化的。
本研究证实,REG联合TAS102能够提高抗肝癌的疗效,其协同作用机制涉及对肿瘤干细胞性及抗凋亡信号的调控。二者的联合使用为临床治疗难治性HCC提供了一种新的治疗策略。
