蛋白激酶CβⅡ通过IL-6自分泌途径促进肝细胞癌侵袭的研究
2021-06-04陈添亮高洪泉巫佳翠王玉孝
刘 敏,陈添亮,郭 娟,伊 雪,高洪泉,巫佳翠,王玉孝
1.厦门医学院基础医学部,福建 厦门 361023;2.机能与临床转化福建省高等学校重点实验室,福建 厦门 361023;3.厦门医学院临床医学系,福建 厦门 361023;4.厦门医学院附属第二医院病理科,福建 厦门 361023
肝细胞癌(hepatocellular carcinoma,HCC)是全球第七大高发和第四大致死性的恶性肿 瘤[1],中国是HCC大国,世界上每年近半数HCC新发和死亡病例均发生在中国[2],虽然近年来对HCC的基础和临床研究有诸多进展,但HCC患者预后仍然很差,5年生存率仅10%[3]。HCC的复发转移是导致HCC患者死亡率居高不下的主要原因,深入研究其转移的机制,探究更加精确有效的治疗靶点一直是HCC研究的重点和难点。越来越多的证据表明,在HCC发生、发展的过程中,肿瘤微环境与肿瘤细胞的增殖、侵袭及转移密切相关[4],肿瘤细胞或者肿瘤微环境中的细胞分泌的多种促炎因子、趋化因子等参与肿瘤的转移[5],尤其是肿瘤细胞源性细胞因子可以通过自分泌途径参与肿瘤的生长、存活及转 移[6],或通过旁分泌途径重塑基质[7],促进肿瘤的发展。蛋白激酶CβⅡ(protein kinase CβⅡ,PKCβⅡ)属于丝氨酸/苏氨酸蛋白激酶C家族,参与细胞增殖、存活、血管新生等生物学过程,PKCβⅡ在多种肿瘤中表达上调[8-10],其高表达提示患者预后不良[11]。肺癌细胞高表达PKCβⅡ可以提高细胞的增殖、迁移能力[12];胃癌中PKCβⅡ的激活参与斯钙素(stanniocalcin-1,STC-1)[13]介导的血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,促进胃癌生长及血管新生,上述研究均表明PKCβⅡ在肿瘤的发展过程中发挥重要的作用。我们前期的研究[14]发现,PKCβⅡ通过调控上皮-间质转化介导HCC的转移,然而PKCβⅡ能否通过调节炎性因子参与HCC的侵袭尚不清楚。本文通过研究PKCβⅡ对HCC侵袭的影响及相关机制,探讨PKCβⅡ与肿瘤微环境之间的关系,对深入了解HCC的转移机制、寻找HCC治疗的新靶点具有重要意义。
1 材料和方法
1.1 细胞系及主要试剂
本实验所用到的HCC细胞Huh7和Hep3B购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,transwell小室(8 μm)购自美国Costar公司,基质胶购自美国BD公司,细胞因子抗体芯片购自美国RayBiotech公司,人白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、即用型高效免疫组织化学二抗试剂盒购自爱必信(上海)生物科技有限公司,反转录试剂盒购自宝生物工程(大连)有限公司,引物由生工生物工程(上海)股份有限公司合成,FastStart Essential DNA Green Master购自瑞士Roche公司,IL-6中和抗体、IL-6受体(IL-6 receptor,IL-6R)中和抗体购自美国R&D公司,STAT3和p-STAT3购自美国Cell Signaling Technology公司,PKCβⅡ和IL-6抗体购自美国Abcam公司。
1.2 临床样本
选择2016年5月—2019年12月厦门医学院附属第二医院经病理学检查确诊的HCC患者20例,所有患者均无抗肿瘤治疗史。本研究符合厦门医学院伦理委员会相关规定,患者均自愿参与并签署知情同意书,标本切除后放置于-80 ℃冰箱保存。
1.3 实验方法
1.3.1 构建稳定高表达PKCβⅡ的HCC细胞株
将携带人PKCβⅡ基因的pLVX-puro-表达载体与pMDLg、pVSV-G、pRSV-Rev包装质粒在HEK-293T细胞中进行病毒包装,空载体作为对照组。将HCC细胞接种于2 cm细胞培养皿中,细胞密度40%~50%,第2天换液,加入终浓度为 5 mg/L的聚凝胺(polybrene),病毒冰上融化后滴加到培养液内,混匀,8~12 h后换液继续培养,以1∶5~1∶3的比例进行细胞传代,培养过夜,使用1 mg/L的嘌呤霉素(puromycin)对细胞进行筛选,2~3周后得到稳定表达细胞。
1.3.2 收集条件培养基
稳定高表达PKCβⅡ的HCC细胞及对照用无血清DMEM培养基培养24 h,收集细胞上清液,于4 ℃ 300×g离心10 min,去除悬浮细胞及碎片,-20 ℃保存。
1.3.3 Transwell侵袭实验
用无血清培养基重悬细胞,每孔5×104个细胞,上室中预先加入按1∶6稀释的基质胶,下室加入完全培养基,培养24 h,PBS洗3次,采用4%多聚甲醛室温固定30 min,PBS洗3次,结晶紫染色30 min,PBS洗3次,棉签擦掉上室内的细胞,显微镜下每组随机选取5个视野进行计数,实验重复3次,每组3个复孔。
1.3.4 细胞因子抗体芯片检测
使用细胞因子抗体芯片Human Inflammation Array C3(美国RayBiotech公司)检测细胞上清液中细胞因子的水平,实验步骤参考厂商提供的方案。简述如下:收集无血清条件培养基,每个芯片孔中加入100 µL的1×封闭液,室温摇床上温育30 min,抽去封闭液,每孔加入100 µL的样品,4 ℃震荡温育过夜,弃去样品,每孔加入 250 µL的1×洗液Ⅰ,清洗6次,每次震荡10 s,每孔加入250 µL的1×洗液Ⅱ,清洗5次,每次震荡10 s,每孔加入70 µL生物素标记抗体(事先用1×封闭液稀释),室温温育1~2 h,洗膜,每孔加入70 µL荧光剂-链霉亲和素(事先用1×封闭液1∶1 500稀释),避光室温震荡温育2 h,洗膜,利用GenePix 4000B Microarray Scanner扫描仪,532 nm激发波长进行扫描,采用AAH-INF-G3的数据分析软件计算各信号点灰度值。
1.3.5 ELISA检测
收集无血清条件培养基,各孔加入100 µL标准品和实验样品,盖上贴膜,室温温育2 h,弃去液体,加入400 µL洗涤液洗涤,重复3次,拍干,每孔加入100 µL IL-6检测抗体,室温温育 2 h,加入400 µL洗涤液洗涤,重复3次,拍干,每孔加入100 µL链霉亲和素-HRP,室温避光温育20 min,加入400 µL洗涤液洗涤,重复3次,拍干,每孔内加入100 µL显色液,室温避光温育 20 min,每孔加入终止液50 µL,终止反应,450 nm波长测量各孔的吸光度(D)值,设定 540 nm作为校正波长。
1.3.6 实时荧光定量聚合酶链反应(realtime fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测
将稳定高表达PKCβⅡ的HCC细胞及对照细胞提取总RNA,采用反转录试剂盒将等量RNA(2 μg)反转录成cDNA,应用Light Cycler 96 RTFQ-PCR仪,使用SYBR GreenⅠ嵌合荧光法,以比较CT值法(2-ΔΔCT法)计 算相对定量。所用到的引物序列I L-6 有义链为AGACAGCCACTCACCTCTTCAG,反义链为TTCTGCCAGTGCCTCTTTGCTG;I L-6R有义链为GACTGTGCACTTGCTGGTGGAT,反义链为ACTTCCTCACCAAGAGCACAGC;GAPDH有义链为5’-GTCAAGGCTGAGAACGGGAA-3’,反义链为5’-AAATGAGCCCCAGCCTTCTC-3’。预温育95 ℃ 600 s,循环条件95 ℃ 10 s,57 ℃ 10 s,72 ℃ 10 s,共45个循环,溶解95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。
1.3.7 抗体中和实验
对数生长期的细胞加入I L-6 中和抗体(5 μg/mL)或IL-6R中和抗体(5 μg/mL)预处理1 h,PBS洗3次,胰酶消化,无血清培养基重悬,用于细胞侵袭实验。
1.3.8 蛋白质印迹法(Western blot)检测
细胞用冷PBS洗3 次,加入十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDSPAGE)裂解液,提取细胞总蛋白,用二喹啉甲酸(bicinchoninic acid,BCA)试剂盒进行蛋白定量。每组取等量蛋白用10%SDS-PAGE分离蛋白后,以湿转法转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,加入5%脱脂奶粉室温封闭1 h,加入一抗4 ℃温育过夜,TBST洗膜后,加入辣根过氧化物酶标记的对应二抗,室温温育1 h,滴加电化学发光(electrochemical luminescence,ECL)显影液显影。以GAPDH作为内参。
1.3.9 免疫组织化学法检测
取临床HCC患者癌组织石蜡切片,按照试剂盒说明书进行免疫组织化学染色,DAB工作液显色,苏木精复染,盐酸乙醇分化、脱水,中性树脂封片。光学显微镜观察PKCβⅡ、IL-6的表达情况。为了进行PKCβⅡ和IL-6的相关性分析,本研究以免疫组织化学染色评分反映PKCβⅡ和IL-6的表达水平,免疫组织化学染色评分=染色强度×阳性细胞比例(%)。染色强度评分标准:不着色,0分;黄色,1分;棕黄色,2分;棕褐色,3分;阳性细胞所占观察细胞百分比评分标准:<5%,0分;5%~25%,1分;26%~50%,2分;51%~75%,3分;>75%,4分。
1.4 统计学处理
所有统计学分析均采用SPSS 22.0软件进行,结果以表示,实验两组间比较采用两个独立样本的t检验分析,方差齐且服从正态分布的组间差异采用单因素方差分析,PKCβⅡ和IL-6表达的相关性分析采用非参数Spearman检验。P<0.05为差异有统计学意义。
2 结果
2.1 PKCβⅡ高表达细胞的条件培养基增强HCC细胞的侵袭能力
本研究采用取自PKCβⅡ稳定高表达HCC细胞组和对照组细胞的条件培养基(conditioned medium,CM)处理HCC细胞Huh7和Hep3B 24 h,通过transwell法检测细胞侵袭能力的变化。结果显示,与来自对照组的条件培养基比较,PKCβⅡ高表达细胞的条件培养基能够显著增强Huh7的侵袭能力(P<0.01,图1A);在HCC细胞Hep3B中,PKCβⅡ高表达细胞的条件培养基同样能够增强细胞的侵袭能力(P<0.05,图1B)。上述结果表明,自分泌途径可能参与了PKCβⅡ的促HCC侵袭作用。

图1 PKCβⅡ高表达细胞的条件培养基提高HCC细胞的侵袭能力Fig.1 Conditioned medium from PKCβⅡ-overexpressing cells promoted the invasion of HCC cells
2.2 PKCβⅡ促进IL-6的分泌
采用细胞因子抗体芯片检测PKCβⅡ高表达组和对照组细胞因子分泌的变化,将PKCβⅡ高表达前后细胞因子的相对量进行比较,结果显示,在表达水平提高的细胞因子中,IL-6的提高最为显著(图2A)。ELISA结果显示,在HCC细胞Hep3B中高表达PKCβⅡ可以提高上清液中IL-6的含量(P<0.01,图2B),在HCC细胞Huh7中高表达PKCβⅡ也观察到了类似的结果(P<0.01,图2B);RTFQ-PCR结果显示,在HCC细胞Hep3B中高表达PKCβⅡ可以上调IL-6的转录(P<0.01,图2C),在HCC细胞Huh7中高表达PKCβⅡ也观察到了类似的结果(P<0.01,图2C)。上述结果表明,PKCβⅡ可以促进IL-6的分泌。

图2 PKCβⅡ促进IL-6的分泌 Fig.2 PKCβⅡ promoted IL-6 secretion
2.3 PKCβⅡ通过IL-6自分泌方式介导HCC细胞的侵袭
为了验证IL-6是否参与PKCβⅡ的促HCC侵袭作用,抗体中和实验结果显示,IL-6中和抗体可以抑制HCC细胞Huh7的侵袭能力(P<0.05,图3A),而对PKCβⅡ高表达的Huh7细胞,IL-6中和抗体可以更加明显地抑制其侵袭能力(P<0.01,图3A);在HCC细胞Hep3B中,IL-6中和抗体对其侵袭能力有所抑制,但差异并无统计学意义(P>0.05,图3B),而对PKCβⅡ高表达的Hep3B细胞,IL-6中和抗体可以抑制其侵袭能力的增强(P<0.01,图3B)。上述结果表明,PKCβⅡ介导HCC细胞侵袭能力的增强是通过IL-6自分泌方式实现的。

图3 PKCβⅡ通过IL-6自分泌方式介导HCC细胞的侵袭Fig.3 PKCβⅡ promoted the invasion of HCC cells by modulating the autocrine of IL-6 in vitro
2.4 IL-6/STAT3信号通路参与PKCβⅡ的促HCC细胞侵袭
通过RTFQ-PCR检测PKCβⅡ高表达HCC细胞Huh7和对照组细胞中IL-6受体的表达,结果表明,PKCβⅡ可以提高IL-6受体的转录(P<0.01,图4A);抗体中和实验的结果显示,IL-6受体中和抗体可以抑制HCC细胞Huh7的侵袭能力(P<0.05,图4B),而对PKCβⅡ高表达的Huh7细胞,IL-6受体中和抗体可以显著抑制其侵袭能力(P<0.01,图4B);通过Western blot检测p-STAT3的表达,高表达PKCβⅡ可以上调STAT3的磷酸化(P<0.05,图4C),加入IL-6受体中和抗体即可以抑制对照组STAT3的磷酸化(P<0.05,图4C),又可以抑制高表达PKCβⅡ介导的STAT3磷酸化上调(P<0.01,图4C)。上述结果表明,IL-6/STAT3信号通路参与PKCβⅡ的促HCC细胞侵袭。
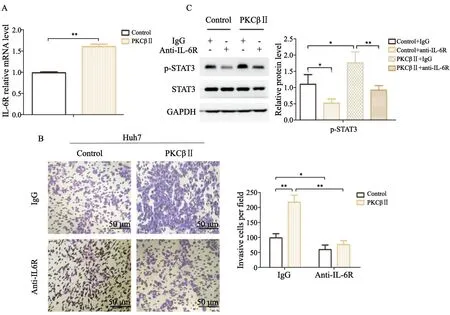
图4 IL-6/STAT3信号通路参与了PKCβⅡ的促HCC细胞侵袭Fig.4 IL-6/STAT3 signal pathway played a role in the invasion of HCC cells by PKCβⅡ
2.5 HCC临床样本中PKCβⅡ与IL-6表达的相关性分析
通过免疫组织化学法观察临床HCC患者样本中PKCβⅡ和IL-6表达的相关性。相同标本的连续切片染色反映PKCβⅡ和IL-6表达的正相关性,即随着PKCβⅡ表达的增加,IL-6的表达也增加(图5A);通过比较PKCβⅡ与IL-6的免疫组织化学评分,两者的表达呈正相关(相关系数r=0.697,P<0.01,图5B)。
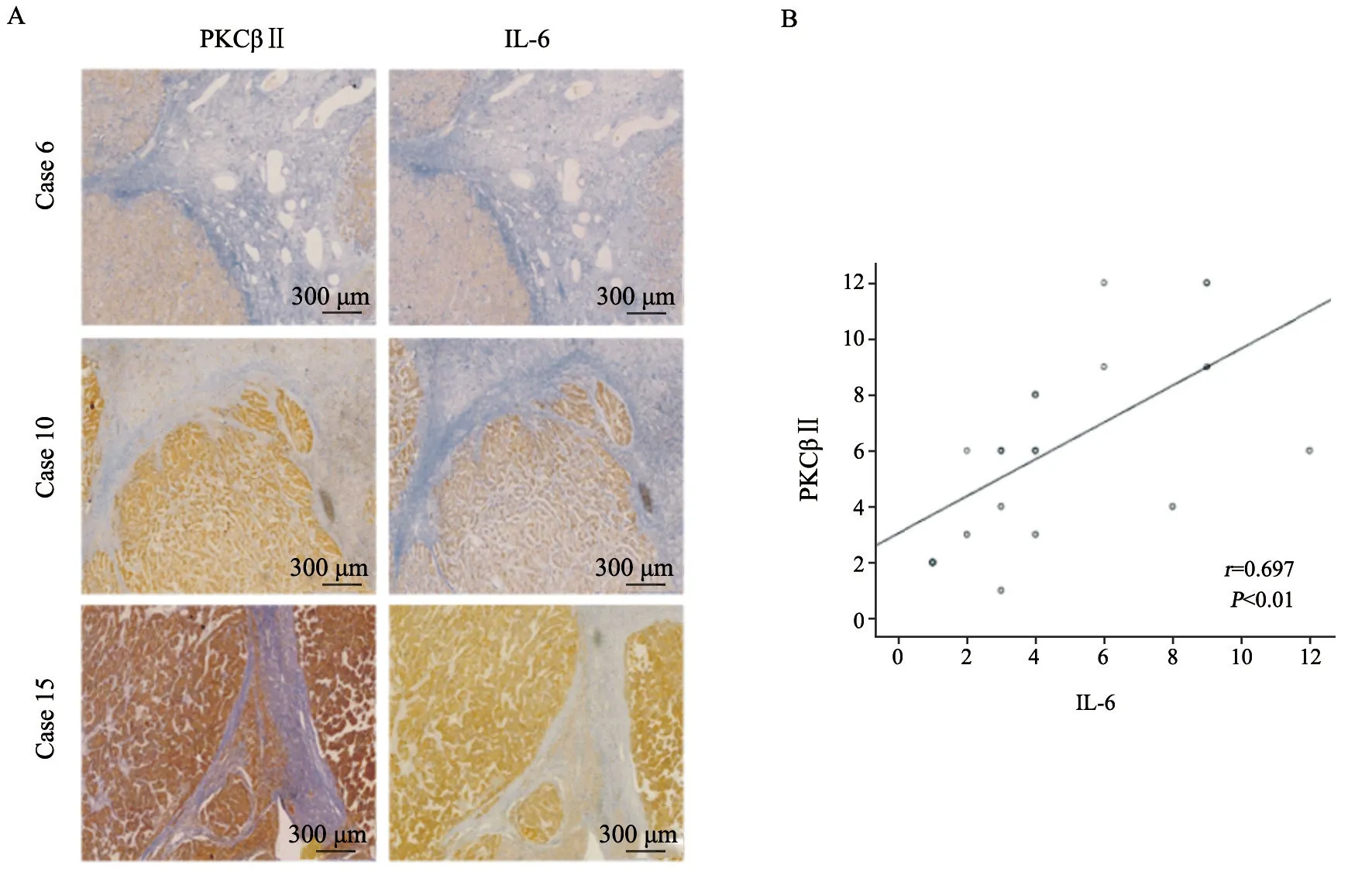
图5 HCC临床样本中PKCβⅡ与IL-6表达的相关性分析Fig.5 Correlation of PKCβⅡ with the expression of IL-6 in clinical HCC cases
3 讨 论
HCC的炎性微环境与HCC的进程是互相促进、交织共存的。在肿瘤的发展过程中,包括肿瘤细胞在内的多种细胞通过释放细胞因子,如IL-6、白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子(tumor necrosis factor α,TNF-α)以及花生四烯酸类物质等组成肿瘤的炎性微环境,参与肿瘤的增殖、侵袭和血管生成等[15]。本研究发现,PKCβⅡ通过IL-6自分泌途径促进HCC的侵袭,提示PKCβⅡ表达失调可以通过炎症性因子自分泌方式参与HCC的发展过程,揭示了PKCβⅡ调控HCC转移的新机制,为PKCβⅡ调控肿瘤微环境参与HCC发生、发展提供了依据。
我们前期的研究结果发现,高表达PKCβⅡ可以增强HCC细胞的迁移、侵袭能力[14],本研究收集PKCβⅡ高表达HCC细胞的条件培养基处理HCC细胞,可以增强细胞的侵袭能力,提示PKCβⅡ促HCC侵袭的能力也可能有自分泌细胞因子的参与。随后,应用细胞因子抗体芯片技术检测PKCβⅡ高表达后细胞因子分泌的变化,结果表明,IL-6升高最显著,普遍上调的促炎因子还包括IL-8、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)、粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)以及干扰素-γ(interferon-γ,IFN-γ)等,由此可见,PKCβⅡ促进HCC细胞产生多种促炎因子,招募炎症细胞,参与构成肿瘤炎症微环境,促进HCC的发展。
在各种炎性因子中,IL-6被认为是衔接炎症与肿瘤最核心的因子[16],在结肠癌[17]、乳腺癌[18]等肿瘤组织及患者血清中均表达升高,其高表达与肿瘤的侵袭及患者的不良预后密切相 关[19]。抗体芯片检测结果表明,PKCβⅡ高表达可以提高IL-6水平至对照组的11倍,ELISA检测也发现,PKCβⅡ高表达可以在Huh7和Hep3B中显著提高上清液中IL-6的水平,RTFQ-PCR也得到相同的结果,提示PKCβⅡ高表达后IL-6从转录到分泌水平都明显增强。关于PKCβⅡ调控IL-6转录的分子机制,本研究没有深入探究,这是本实验的不足之处。核因子κB(nuclear factor kappa-B,NF-κB)是对炎症因子具有广泛调节作用的转录因子,静息状态下,NF-κB与其抑制剂IκB结合以无活性形式存在于细胞质中,激活后的NF-κB转位入细胞核,可以与IL-6启动子中的κB序列结合,调控IL-6的转录[20],同时有研究报道PKCβⅡ可以通过经典信号通路激活 NF-κB[21],促进慢性淋巴细胞白血病细胞的存活。因此,我们推测PKCβⅡ对IL-6转录和分泌的调控可能与NF-κB信号通路有关。
接着我们用IL-6中和抗体预处理HCC细胞,发现可以抑制PKCβⅡ高表达介导的HCC细胞侵袭能力的增强,表明PKCβⅡ通过IL-6自分泌途径促进HCC细胞的侵袭。IL-6作为肿瘤炎症微环境中的重要成员,通过与IL-6R结合激活不同的信号转导通路,IL-6R在包括肿瘤细胞在内的多种细胞表面表达。本研究发现PKCβⅡ可以提高HCC细胞IL-6R的转录,用IL-6R中和抗体预处理HCC细胞,PKCβⅡ促HCC细胞侵袭的能力减弱。在IL-6激活的信号通路中,JAK/STAT3信号转导通路最重要,IL-6通过与IL6-R结合,引起 STAT3磷酸化并形成二聚体,活化的STAT3二聚体转入细胞核内调控靶基因转录[22],STAT3信号转导途径的异常与血管形成及肿瘤转移关系密 切[23],本研究发现高表达PKCβⅡ可以提高STAT3的磷酸化,加入IL-6R中和抗体则降低其磷酸化水平,表明PKCβⅡ通过IL-6/IL-6R/STAT3自分泌途径调控HCC的转移。
随着医疗水平的不断进步,针对 HCC 的治疗也取得了长足的发展,手术切除和肝移植仍是目前治疗HCC的主要手段,但仍有超过50%的患者会在5年内出现术后复发和转移[24]。目前缺少有效针对HCC的靶向治疗药物,索拉非尼是目前临床上治疗晚期HCC的一线靶向治疗药物,通过阻断肿瘤新生血管的形成,抑制肿瘤的转移和侵袭[25],尽管索拉非尼在晚期HCC的治疗中发挥极为重要的作用,但由于耐药现象的存在限制了其临床应用。因此,研发新型的精准靶向治疗药物,对提高HCC的治疗及患者预后有着重要的意义。本研究发现,PKCβⅡ通过IL-6自分泌途径促进HCC的侵袭,调控肿瘤炎症微环境参与HCC的发展,因此靶向PKCβⅡ有可能成为HCC治疗中有效的辅助治疗策略。
