PD-L1表达对晚期肺腺癌患者培美曲塞化疗效果的影响及其机制
2021-06-04施茂林柏玉娣李思琪周代君彭晶晶孙非凡
施茂林,柏玉娣,王 超,李思琪,周代君,彭晶晶,孙非凡,李 东,张 涛
1.西南医科大学临床医学院,四川 泸州 646000;2.中国人民解放军西部战区总医院肿瘤诊治中心,四川 成都 610083;3.中国人民解放军西部战区总医院病理科,四川 成都 610083;4.西南交通大学医学院,四川 成都611756
肿瘤细胞PD-L1表达水平是程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡配体-1(programmed death ligand-1,PD-L1)抑制剂主要的疗效预测生物标志物之一[1-4],最近的研究表明,PD-L1高表达的肺癌患者生存期更短[5]。同时,对于表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变型患者,PD-L1表达水平可以影响表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFRTKI)靶向治疗的效果[6-7]。
本研究重点回顾性分析了中国人民解放军西部战区总医院肿瘤诊治中心收治的一线接受培美曲塞为基础化疗的晚期肺腺癌患者癌组织中PD-L1表达对培美曲塞为基础的化疗效果的影响,并探讨其潜在机制。
1 资料和方法
1.1 临床资料
纳入标准:①患者年龄≥18岁且<85岁;② 预期寿命≥半年;③组织病理学活检确诊为肺腺癌。排除标准:①病理学诊断为非腺癌或含腺癌成分的混合型癌;② 同时合并其他肿瘤;③合并急性致死性疾病;④ 合并其他严重疾病,如肝硬化失代偿期、尿毒症、严重致死性心脏疾病等;⑤ 病历资料不完全;⑥ 组织标本不足以完善免疫组织化学检测。本研究收集了2015年10月—2018年12月中国人民解放军西部战区总医院肿瘤诊治中心确诊为肺腺癌且符合研究入组条件的患者共185例,其中51例晚期肺腺癌患者一线接受培美曲塞联合铂类药物的治疗(至少接受2个周期)。化疗前均接受叶酸、维生素B12及地塞米松预处理。培美曲塞:500 mg/m2,第1天;顺铂:75 mg/m2,第1天;卡铂:AUG=5~6,第1天;约21 d重复。所有患者治疗过程中均未接受免疫治疗。本研究通过了西部战区总医院伦理委员会的批准(批件号2020ky009)。
采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1评价疗效,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和疾病进展(progressive disease,PD)。
同时以6种肺腺癌细胞系为研究对象,检测各细胞系中PD-L1、胸苷酸合酶(thymidylate synthase,TS)的蛋白水平和mRNA表达。
1.2 随访
采用住院、门诊、电话随访,每3个月随访1次,末次随访时间为2020年5月1日。截至末次随访,全组中位随访18.1个月。PFS定义为从接受化疗开始,到出现疾病进展或出现任何原因的死亡或末次随访。OS定义为从确诊到任何原因导致的死亡或末次随访。
1.3 方法
1.3.1 细胞培养
肺腺癌细胞系A549、H1437、H1395、H1944、HCC827均购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,H3255购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。肺腺癌细胞系培养于含10%胎牛血清(以色列BI公司)的RPMI-1640培养基(以色列BI公司)中,于CO2体积分数为5%、37 ℃培养箱中培养。取对数生长期细胞提取蛋白或总RNA。
1.3.2 免疫组织化学检测
采用SP染色法检测185例肺腺癌患者癌组织中PD-L1和TS的表达水平。癌组织石蜡包埋标本做4 μm连续切片,经脱蜡、热抗原修复、淬灭内源性过氧化物酶、血清封闭,温育PD-L1兔抗人单克隆抗体(22C3,美国Agilent公司)或TS鼠抗人单克隆抗体(TS106,美国Invitrogen公司)4 ℃过夜,37 ℃温育生物素标记山羊抗兔/鼠IgG二抗、37 ℃温育辣根过氧化物酶标记链霉卵白素工作液、DAB显色、苏木精复染、盐酸乙醇分化、中性树胶封片。每次实验操作中均设置阳性对照组(PD-L1阳性对照:胎盘组织;TS阳性对照:TS表达阳性肠癌组织)和阴性对照组(PBS替代一抗)。
PD-L1结果判读:细胞膜显棕黄色的肿瘤细胞判定为PD-L1阳性细胞。PD-L1阳性细胞比例评分[8-9](tumor proportion score,TPS):判读在200倍镜下至少观察100个肿瘤细胞中PD-L1阳性肿瘤细胞占比。以TPS<1%定义为阴性,TPS≥1%定性为阳性。TS结果判读:细胞质或细胞核显棕黄色的肿瘤细胞判定为TS阳性细胞。以TPS<10%定义为阴性,TPS≥10%定性为阳 性[10]。所有染色结果均由病理科医师双盲 判读。
1.3.3 蛋白质印迹法(Western blot)检测
取对数生长期细胞用细胞裂解液充分裂解细胞,BCA试剂盒测定蛋白浓度。取20 μL蛋白样品,经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE),湿转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。5%BSA于37 ℃封闭2 h,TBST漂洗,4 ℃过夜温育PD-L1抗体(E1L3N,美国CST公司)或TS抗体(TS106,美国Invitrogen公司),TBST液漂洗,37 ℃温育二抗1 h。用洗膜缓冲液(Tris-buffered saline Tween,TBST)充分洗膜后显影。Image J行灰度值分析。
1.3.4 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测
取对数生长期细胞用TRIzol试剂提取总RNA,按PrimeScriptTMRT Master Mix[宝日医生物技术(北京)有限公司]试剂盒说明书反转录合成cDNA。10 μL RTFQ-PCR反应体系含 2.5 μL cDNA产物、0.3 μL引物、0.15 μL探针、2.05 μL DEPC水和5 μL FastStart Universal Probe Master(瑞士Roche公司)。反应条件为95 ℃预变性15 min,95 ℃变性10 s,55 ℃退火30 s,70 ℃延伸30 s,循环42个周期。以2-△△CT方法算出目的mRNA的相对表达量。引物及探针号(瑞士Roche公司):CD274(PD-L1)探针号为#25,有义链为5’-GGCATCCAAGATACAAACTCAA-3’,反义链为5’-CAGAAGTTCCAATGCTGGATTA-3’;TYMS(TS)探针号为#2 5,有义链为5’-CCCAGTTTATGGCTTCCAGT-3’,反义链为5’-GCAGTTGGTCAACTCCCTGT-3’;GADPH探针号为#25,有义链为5’-AGCCACATCGCTCAGACAC-3’,反义链为5’-GCCCAATACGACCAAATCC-3’。
1.4 统计学处理
应用SPSS 19.0统计软件进行数据分析。计量资料采用,计数资料采用例数(率);计量资料相关性分析采用Pearson相关性检验,计数资料相关性分析采用Spearman秩相关性检验;采用Kaplan-Meier法绘制生存曲线,影响预后因素的单因素分析采用log-rank检验,多因素分析采用COX回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 51例晚期肺腺癌患者癌组织PD-L1表达对培美曲塞为基础的化疗疗效的影响
51例晚期肺腺癌患者一线接受培美曲塞联合铂类的治疗,其基线特征见表1。在一线治疗中,接受培美曲塞联合顺铂治疗的患者 38例(74.5%),接受培美曲塞联合卡铂治疗的患者13例(25.5%),无培美曲塞单药治疗病例。在维持治疗阶段,12例(23.5%)患者接受培美曲塞单药的维持治疗。
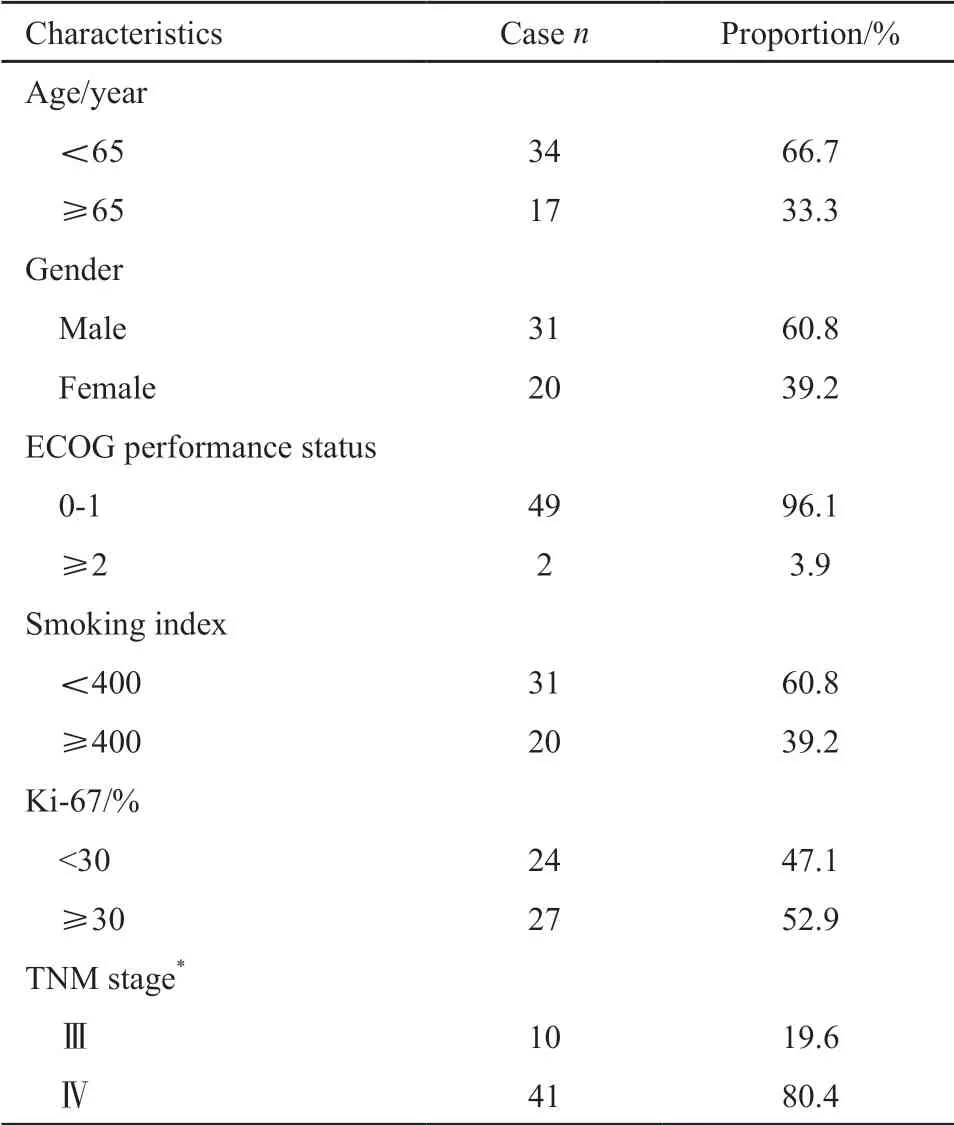
表1 51例晚期肺腺癌患者的临床病理学基线特征Tab.1 Clinicopathological baseline characteristics of 51 patients with advanced lung adenocarcinoma
PD-L1主要表达于肿瘤细胞膜(图1)。在51例患者中,20例(39.2%)患者PD-L1表达阳性,31例(60.8%)患者PD-L1表达阴性。PD-L1表达阳性患者接受培美曲塞为基础化疗的客观有效率(objective response rate,ORR)和疾病控制率(disease control rate,DCR)与PD-L1表达阴性患者相比差异无统计学意义(ORR:20.0%vs35.5%,χ2=1.404,P=0.236;DCR:60.0%vs80.6%,χ2=2.602,P=0.1 0 7;表2)。PD-L1表达阴性患者的PFS显著优于PD-L1表达阳性患者(mPFS:5.6 个月vs4.1个月,log-rank=5.406,P=0.020;图2A)。两组患者的OS差异无统计学意义(mOS:15.9个月vs12.7个月,log-rank=0.525;P=0.469,图2B)。上述结果表明,PD-L1表达阴性患者相对PD-L1表达阳性患者可以从培美曲塞为基础的化疗中取得更多PFS生存获益,PD-L1表达可能影响晚期肺腺癌患者培美曲塞为基础的一线化疗的效果。
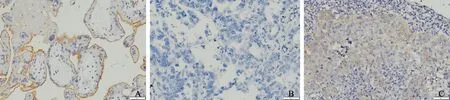
图1 肺腺癌患者癌组织中PD-L1免疫组织化学染色情况Fig.1 Immunohistochemical staining of PD-L1 in cancer tissues of patients with lung adenocarcinoma
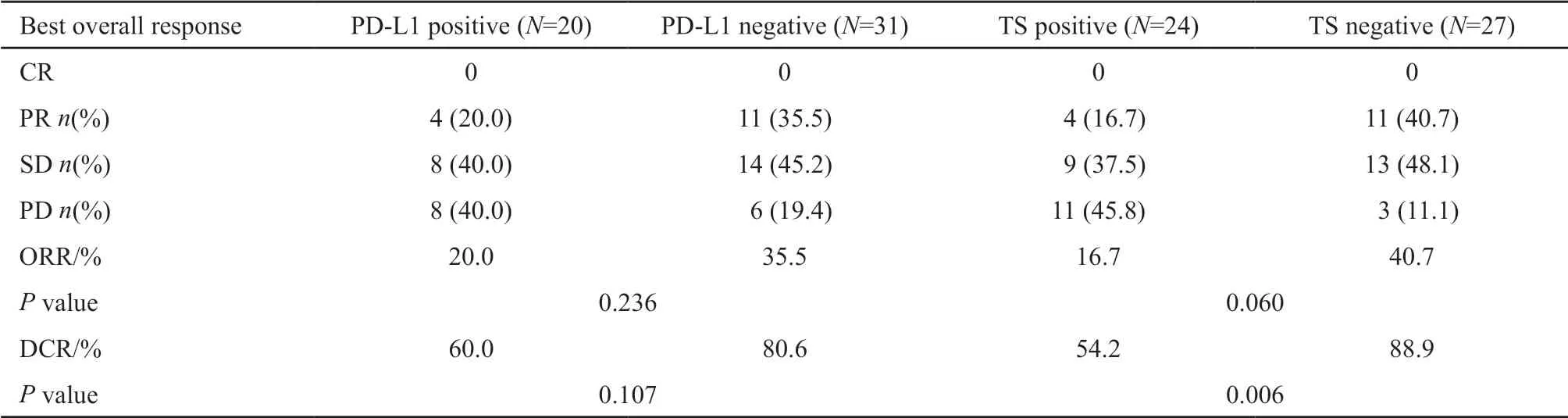
表2 51例晚期肺腺癌患者的治疗评价Tab.2 Responses of 51 patients with advanced lung adenocarcinoma assessed by RECIST version 1.1

图2 PD-L1表达对51例晚期肺腺癌患者培美曲塞为基础化疗疗效和OS的影响Fig.2 Effect of PD-L1 expression on the efficacy of pemetrexed-based chemotherapy and OS in 51 patients with advanced lung adenocarcinoma
2.2 51例晚期肺腺癌患者癌组织TS表达对培美曲塞为基础的化疗效果的影响
TS表达于细胞质或细胞核(图3)。在51例患者中,24(47.1%)例患者TS表达阳性,27(52.9%)例患者TS表达阴性。TS表达阳性患者的DCR显著劣于TS表达阴性患者(DCR:54.2%vs88.9%,χ2=7.692,P=0.006),而两组患者的ORR差异无统计学意义(ORR:16.7%vs40.7%,χ2=3.547,P=0.060)。TS表达阴性患者的PFS显著优于TS表达性组(mPFS:6.9个月vs4.1个月,log-rank=9.471,P=0.002;图4A,表2)。两组患者的OS差异无统计学意义(mOS:15.9个月vs12.4个月,log-rank=0.647,P=0.421;图4B)。

图3 肺腺癌患者癌组织中TS免疫组织化学染色情况Fig.3 Immunohistochemical staining of TS in cancer tissues of patients with lung adenocarcinoma
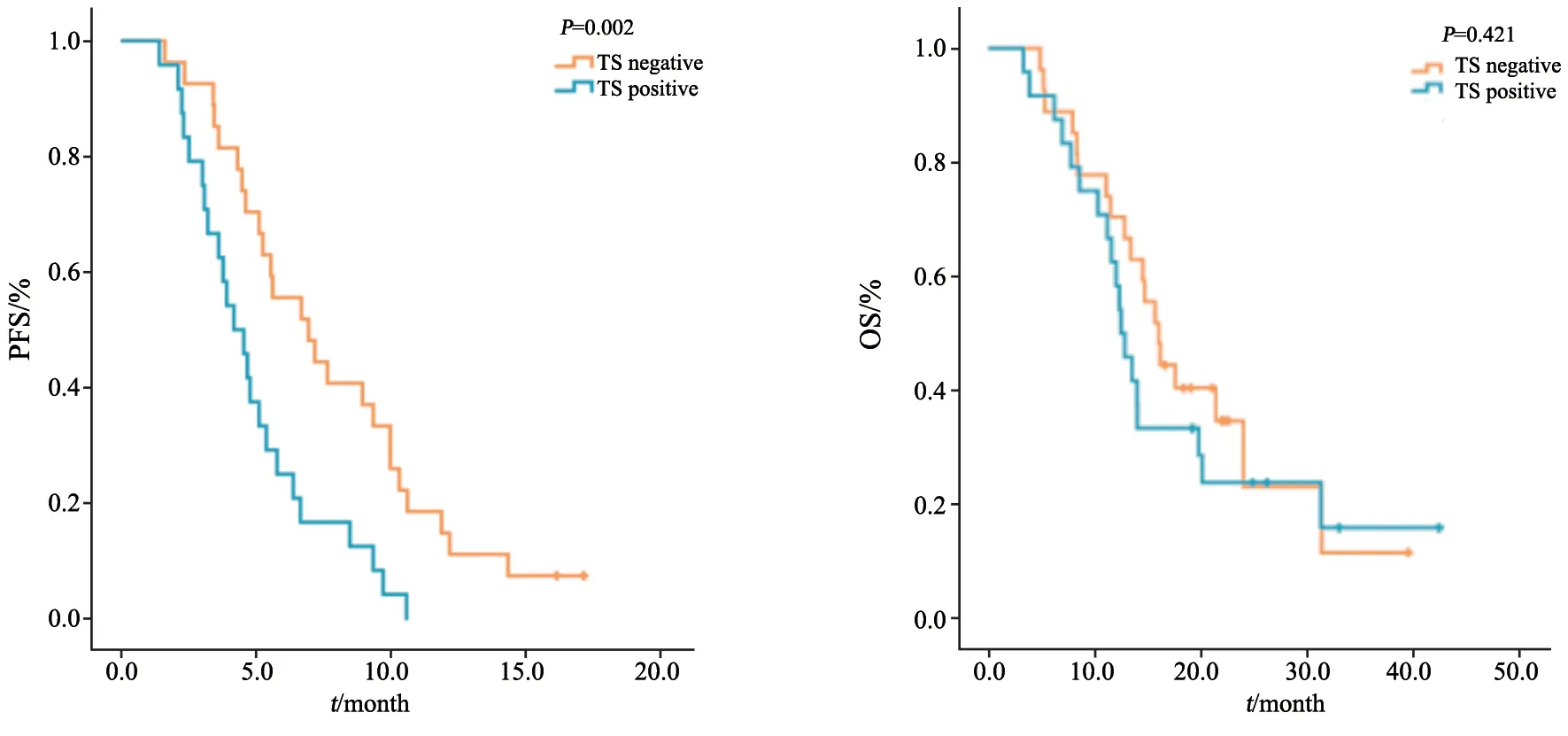
图4 TS表达对51例晚期肺腺癌患者培美曲塞为基础化疗疗效和OS的影响Fig.4 Effect of TS expression on the efficacy of pemetrexed-based chemotherapy and OS in 51 patients with advanced lung adenocarcinoma
2.3 影响51例晚期肺腺癌患者PFS的单因素和多因素分析
单因素分析发现:PD-L1和TS表达阳性是影响晚期肺腺癌患者PFS的危险因素[PD-L1阴性vs阳性:HR=2.002(1.100~3.645),P=0.023;TS阴性vs阳性:HR=2.205(1.367~4.587),P=0.003;表3]。多因素分析发现:TS表达阳性是影响晚期肺腺癌患者PFS的独立危险因素[TS阴性vs阳性:HR=3.245(1.091~9.652),P=0.034;表3]。

表3 影响51例晚期肺腺癌患者PFS的单因素、多因素分析Tab.3 The effect of clinicopathological characteristics,PD-L1 and TS expression on PFS of 51 advanced lung adenocarcinoma patients
2.4 肺腺癌组织和肺癌细胞系中PD-L1与TS表达的相关性分析
本研究结果显示,在51例一线接受培美曲塞为基础化疗的晚期肺腺癌患者中,癌组织PD-L1表达与TS表达显著相关(rs=0.691,P<0.001;表4)。进一步把研究对象拓展到185例肺腺癌患者,其中包括了不同肿瘤分期和接受多种不同的一线治疗模式的肺腺癌患者,其基线特征见表5,Spearman秩相关性检验结果同样提示肺腺癌组织中PD-L1表达与TS表达显著相关(rs=0.588,P<0.001)。

表4 51例晚期肺腺癌患者肺癌组织PD-L1与TS表达的相关性分析Tab.4 Correlation between PD-L1 and TS expression in 51 patients with advanced lung adenocarcinoma
表5 185例肺腺癌患者的临床病理基线特征Tab.5 Clinicopathological baseline characteristics of 185 patients with lung adenocarcinoma
Western blot和RTFQ-PCR检测结果提示,在6种肺腺癌细胞系中,PD-L1与TS无论在蛋白表达水平还是mRNA表达水平均呈显著正相关性(蛋白水平:rs=0.899,P=0.015;mRNA表达:rs=0.861,P=0.028;图5、图6、表6)。

图5 肺腺癌细胞系中PD-L1和TS蛋白水平的表达及其相关性Fig.5 Protein expressions and correlation of PD-L1 and TS in lung adenocarcinoma cell lines
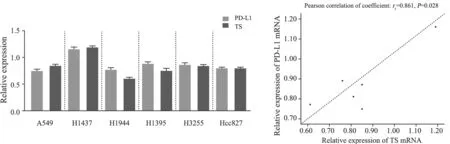
图6 肺腺癌细胞系中PD-L1和TS mRNA水平的表达及其相关性Fig.6 RNA expressions and correlation of PD-L1 and TS in lung adenocarcinoma cell lines
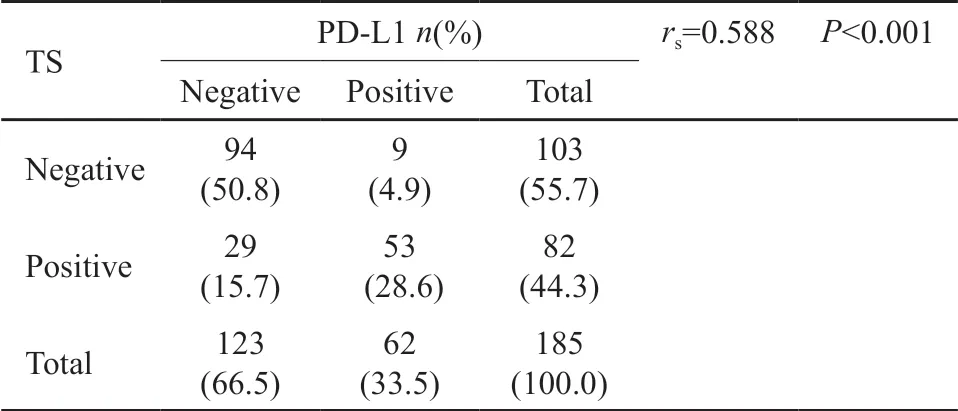
表6 185例肺腺癌患者肺癌组织PD-L1与TS表达的相关性分析Tab.6 Correlation between PD-L1 and TS expressions in 185 patients with lung adenocarcinoma
3 讨 论
抗肿瘤治疗的疗效预测相关生物标志物研究是目前肿瘤学临床和科研领域的焦点和前沿。在免疫治疗领域,PD-L1作为目前PD-1/PD-L1免疫检查点抑制剂治疗效果预测的伴随或补充诊断标志物已在肺癌临床诊疗实践中广泛应用[1-4]。近年来,PD-L1表达对于EGFR敏感突变型肺癌患者EGFR-TKI靶向治疗效果的影响也逐渐引起诸多学者的关注。多项研究[6-7]发现:EGFR-TKI原发耐药的EGFR敏感突变型肺腺癌患者相对于非原发耐药的患者具有更高的PD-L1表达水平,癌组织PD-L1高表达的患者相对于PD-L1低表达或表达阴性的患者接受EGFR-TKI治疗的ORR更低、PFS更短,而EGFR-TKI原发耐药患者相对于获得性耐药患者具有更高的PD-L1阳性率,表明PD-L1表达水平不仅能够预测PD-1/PD-L1免疫检查点抑制剂的疗效,同时也可以影响EGFR敏感突变型患者EGFR-TKI靶向治疗的疗效。然而,这些研究虽然观察到了PD-L1表达水平能够影响EGFR敏感突变型肺癌患者EGFR-TKI靶向治疗的疗效这一现象,但并没有对其潜在生物学机制进行进一步的分析和解释。
培美曲塞是目前驱动基因阴性非鳞非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的一线化学药物。前期多项前瞻性临床研 究[10-12]表明TS表达水平是预测NSCLC患者培美曲塞化疗效果最重要的生物标志分子,TS高表达的患者相对于TS低表达或阴性患者接受培美曲塞为基础化疗的疗效更差。近年来,培美曲塞为基础的化疗联合PD-1单抗联合治疗的优势已经得到多项大型前瞻性Ⅲ期随机对照研究[8-9]的证实,而PD-L1的表达水平能否影响培美曲塞为基础的化疗效果引起研究者的关注。Zhang 等[13]首先报道了晚期肺腺癌患者中PD-L1表达对培美曲塞为基础的化疗效果的影响,发现PD-L1表达阳性的患者相对于PD-L1阴性的患者接受培美曲塞为基础的化疗后具有更长的PFS。而我们的研究结果却与之恰恰相反。进一步分析两项研究结论存在差异的可能原因,我们注意到两项研究肺癌组织PD-L1免疫组织化学检测所采用的PD-L1抗体和阳性判断阈值不同。Zhang等[13]的研究主要采用SP142抗体(Ventana/Roche)及检测平台,以TPS≥5%为PD-L1表达阳性阈值;我们研究采用22C3抗体(Dako/Agilent)及检测平台,以TPS≥1%为PD-L1表达阳性的阈值。不同PD-L1检测抗体和阳性阈值设定可能会对检测结果产生一定影响。最近的一项关于不同PD-L1检测抗体检测分析效能的临床研究蓝印计划(BluePrint)[14-15]研究结果显示,22C3抗体可能较SP142抗体具有更好的检测效能和检测结果一致性。其次,两项研究都对肺腺癌患者肺癌组织中培美曲塞疗效主要预测标志分子TS进行了检测和疗效分析,但结果并不一致。我们的研究发现肺癌组织TS高表达患者相对于TS低表达患者培美曲塞化疗效果较差,DCR更低、PFS更短,这与前期文献报道结果相一 致[10-12]。最后,我们的研究不仅观察到PD-L1阳性表达影响培美曲塞为基础化疗效果,而且进一步探索和分析了其潜在的分子机制,并提出了可能的生物学解释。然而,由于两项研究都是单中心回顾性研究分析,都受制于样本量等客观因素的影响,研究证据级别均存在一定局限性。随后我们也将继续开展前瞻性临床研究,扩大研究样本量,进一步细化不同PD-L1表达水平(如PDL1≥1%、25%、50%)对于晚期肺腺癌患者培美曲塞化疗效果的影响,明确二者之间是否存在一定的量效关系。
