实体瘤中靶向药所致间质性肺病管理的复旦大学附属肿瘤医院标准
2021-06-04沈维娜季冬梅王磊苹龚成成胡夕春
张 剑,沈维娜,季冬梅,王磊苹,龚成成,胡夕春
1.复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032;2.上海市抗癌协会肿瘤药物临床研究专业委员会,上海 200032
部分抗肿瘤药物会导致药物所致间质性肺病(drug-induced interstitial lung disease,DILD),随着抗肿瘤靶向药物在实体瘤治疗中的广泛应用,靶向药物所致间质性肺病(targeted druginduced interstitial lung disease,TDILD)日益受到关注,早发现、早干预TDILD至关重要,其不仅影响患者的肺功能,也关系到肿瘤治疗的效果。目前,国内外还未有适用性广泛的处理模式,治疗多凭个人经验,往往造成患者错失最佳干预时间、间质性肺病(interstitial lung disease,ILD)失控、激素暴露量过多、后续肿瘤治疗受限等不良后果。因此,复旦大学附属肿瘤医院肿瘤内科依据既往经验,总结出一套有效的诊疗方法,即实体瘤中TDILD管理的复旦大学附属肿瘤医院标准(简称复旦肿瘤标准),供各位同行 参阅。
1 TDILD的定义和概况
ILD最早在1975被提出,是一组累及肺间质、肺泡或细支气管的肺部弥漫性疾病,以活动性呼吸困难、限制性通气障碍、肺弥散功能降低和低氧血症为临床表现,不同种类疾病构成的临床-病理实体的总称[1-2]。ILD主要可以归为两大类:①已知病因类型,如尘肺病、结缔组织相关间质性肺病、DILD等;② 未知病因类型,如结节病、特发性间质性肺病(表1)[3]。以DILD为例,部分化疗药物如抗癌抗生素类(博来霉素)、烷化剂类(环磷酰胺)、抗代谢类(吉西他滨)和植物类(紫杉醇、多西他赛)治疗后可引起肺间质损伤[4-6]。对于DILD应给予充分重视,如吉西他滨的药物说明书中明确指出,在吉西他滨治疗过程中,肺毒性如果考虑由该药物引起或无法排除由吉西他滨引起,须永久停药。

表1 ILD的主要分类Tab.1 Major categories of ILD
TDILD是一组由不同种类靶向药物引起的弥漫性肺疾病,以肺泡、肺间质和肺小血管的炎症和纤维化为主要表现。TDILD并不少见,从轻微的肺部浸润到危及生命的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),呈现多样化的临床特征。实体瘤治疗中引起TDILD的常见药物有小分子靶向药、抗体药物偶联物(antibody-drug conjugate,ADC)、免疫检查点抑制剂(immune checkpoint inhibitor,ICI)等。
针对表皮生长因子受体(epidermal growth factor receptor,EGFR)的小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)吉非替尼(gefitinib)和厄洛替尼(erlotinib)可用于EGFR突变的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC),但一项接受吉非替尼治疗的日本地区回顾性分析[7]发现,526例接受治疗的患者中有17例(3.2%)发生TDILD,其中有7例死亡,TDILD的致死率高达41.2%;厄洛替尼的TDILD发生情况与吉非替尼相似。一项接受厄洛替尼治疗的3 488例患者回顾性分析[8]结果显示,有158例(4.5%)发生TDILD,其中有55例死亡,TDILD的致死率为34.8%。mTOR抑制剂依维莫司(everolimus)广泛应用于肾癌、胰腺神经内分泌肿瘤、乳腺癌的治疗中[9],但Gong 等[10]研究指出,在转移性乳腺癌患者中应用依维莫司的TDILD发生率达52.3%(45/86),且主要发生在前4个月;此外,Kurokawa等[11]研究发现,服用依维莫司的肾癌患者TDILD发生率高达63.6%。
ADC是一类通过特定的连接将单克隆抗体与细胞毒性药物偶联,从而能特异性地将小分子细胞毒性药物靶向运输至肿瘤细胞中。维布妥昔单抗(brentuximab vedotin,BV,CD30抗体偶联药物)、恩美曲妥珠单抗[T-DM1,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)抗体偶联药物]、trastuzumab deruxtecan(DS-8201,HER2抗体偶联药物)、sacituzumab govitecan(TROP2抗体偶联药物)都是ADC类药物。由于抗体和细胞毒性药物各有不同,ADC药物的不良反应也不尽相同。以 DS-8201为例,其DESTINY-Breast01乳腺癌临床研究中TDILD发生率为13.6%(25/184),其中1~2级为10.9%,3~4级为0.5%,中位发生时间为193 d,4例(2.2%)患者因TDILD死亡[12]。在DESTINYGastric01 Ⅱ期胃癌临床试验[13]中,TDILD发生率为9.6%(12/125),其中1~2级为7.2%,3~4级为2.4%,中位发生时间为84.5 d,无死亡病例。值得注意的是,sacituzumab govitecan在Ⅰ/Ⅱ期临床研究中未见明显的肺毒性[14],故这类ADC药物引起的TDILD需要特别关注,如何在早期诊断和合理治疗已成为肿瘤科医师面临的新挑战。
ICI如程序性死亡[蛋白]-1(programmed death-1,PD-1)抗体、程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)抗 体、细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)抗体等,使用后会出现TDILD,单药治疗一般发生率<5%,联合治疗发生率则略高于5%,Ⅲ级及以上TDILD发生率为1%[15-16],中位发生时间约为3个月,联合治疗发生时间相对更早[17]。
2 TDILD的可能发病机制
TDILD的发病机制目前尚未完全清楚。细胞毒药物如吉西他滨等引起ILD的原因可能是对肺上皮细胞或肺毛细血管内皮的直接损伤,也有可能是细胞因子或炎症因子的募集导致的间接损 伤[18]。博来霉素会产生氧自由基从而引起肺部损伤[18]。对于TDILD,小分子药物如吉非替尼引起的原因尚在探索中,已知EGFR参与肺部损伤的修复,故推测EGFR-TKI可能通过抑制EGFR表达、减少组织中EGFR含量、降低EGFR的活性、抑制气道上皮细胞的生长和修复、妨碍肺部损伤的修复从而导致TDILD[19]。有研究[20]指出,依维莫司导致的TDILD可能是因为细胞介导的自身免疫反应。DILD与ICI的相关机制仍未明确,有研究者认为其涉及肺间质中免疫效应分子和T细胞的失调,从而导致随后的炎症反应[21]。ADC相关的DILD目前多报道于HER2靶点,相关机制仍未明确[22]。
3 TDILD管理的复旦肿瘤标准
考虑到相当一部分肿瘤治疗是在类似复旦大学附属肿瘤医院的肿瘤专科医院进行的,下面将以一般肿瘤专科医院的硬件条件为基础,基于满足临床易于使用的需求,从4个维度来介绍TDILD管理的复旦肿瘤标准。这4个维度包括:①ILD的检查;② ILD的鉴别诊断;③TDILD的严重程度分级;④ TDILD的治疗及后续靶向药物应用管理。因ICI相关DILD已有多个指南提供管理建议[21,23],复旦肿瘤标准目前仍按照这些指南进行TDILD的处置,后文将不再赘述。同时基于ADC药物和小分子靶向药引起TDILD的诸多差异,后文将分为ADC所致ILD管理的复旦肿瘤标准和小分子靶向药所致ILD管理的复旦肿瘤标准两部分予以阐述。
3.1 ILD的检查
告知患者在肿瘤靶向药的治疗过程中,如出现咳嗽、咳痰、发热、胸痛、活动气促或呼吸困难等任何不适时应及时回医院就诊。主治医师根据患者描述评估在治疗过程中出现的任何可疑肺部毒性事件,评估的辅助检查推荐胸部CT、血常规、C反应蛋白(C-reactive protein,CRP)检测、降钙素原(procalcitonin,PCT)、结核感染T细胞(CT-SPOT)检测、G试验、血培养等。医师根据胸部CT影像结合各检查指标,排除病原体感染性肺炎。需要排除的病原体包括细菌、结核杆菌、真菌、支原体、衣原体、病毒等,医师可根据患者临床表现结合当地医院条件行对应检测,鉴于后续的治疗手段迥异,需重点排除结核杆菌与真菌感染,因为这两种疾病不宜采取大剂量激素治疗。如考虑肺部疾病与感染相关,可给予抗生素治疗。如考虑与肿瘤进展有关,可换用治疗方案积极进行抗肿瘤治疗。
3.2 ILD的鉴别诊断
在诊断为TDILD之前,需考虑与以下疾病进行鉴别:①感染性肺炎,患者在肿瘤治疗期间,由于化疗导致骨髓抑制或免疫力降低,可出现肺部感染,通常其病变伴随高热、咳黄痰,血液检查白细胞增高、CRP增高、PCT增高,细菌培养阳性,胸部CT可出现肺叶实变、渗出。② 癌性淋巴管炎,这是肺转移病变的一种,指肿瘤组织沿淋巴管生长、蔓延,淋巴管内充满肿瘤细胞,淋巴管周围纤维组织增生,临床常有呼吸困难和气促等症状,血液检查白细胞计数正常、CRP正常或略高、PCT正常,肿瘤指标升高,胸部CT表现为小叶间隔呈串珠形增厚。
3.3 TDILD的严重程度分级
TDILD的严重程度清晰分级有助于对其进行流程化管理。复旦大学附属肿瘤医院曾经尝试运用如下两种标准进行TDILD分级:①借用美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)免疫相关不良事件(immune-related adverse events,irAEs)中的肺炎进行TDILD分级(表2)[23];② 采用不良事件通用术语评价标准(common terminology criteria for adverse events,CTCAE)5.0版中肺炎的标准进行TDILD分级(表3)。使用一段时间后发现,前一种分级方式主要侧重于ILD所影响肺叶的程度,但由于TDILD常会累及多个肺叶,而患者仍可能无症状,易导致分级较高造成过度干预,也不易于临床操作;但后一种CTCAE肺炎分级临床易用性高,且后续经过复旦大学附属肿瘤医院验证可行。这里特别需要指出的是,CTCAE 5.0 3级的定义中“需要吸氧”容易受到主观因素干扰,为此建议在静息状态下测定氧饱和度或氧分压,低于标准则认为患者属于“需要吸氧”,如高于标准即便进行吸氧治疗仍不考虑判定为“需要吸氧”,即不符合3级的定义。

表2 ASCO irAEs的肺炎分级标准Tab.2 ASCO irAEs grading criteria for pneumonitis

表3 CTCAE 5.0的肺炎分级标准Tab.3 CTCAE 5.0 grading criteria for pneumonitis
3.4 TDILD的治疗及后续靶向药物应用管理
3.4.1 ADC所致ILD管理的复旦肿瘤标准(图1)
在DS-8201的临床研究中,患者一旦出现咳嗽、呼吸困难、发热和(或)任何新的、恶化的呼吸道症状时,需及时进行氧饱和度检测、胸部CT等检查。如果出现2级TDILD,需立即开始 ≥1 mg/kg泼尼松龙或同等剂量效价的其他肾上腺皮质激素类似物治疗,并至少维持4周,且患者后续必须完全终止用药[12]。然而,复旦大学附属肿瘤医院主导了多个ADC药物的研发,在研发过程中发现2级和部分3级TDILD发生后,可以通过及时诊断、干预和后续减量实现ADC的持续安全使用和患者获益,按照该模式管理的患者无一例死亡,且肺炎得到长期控制(举例见病例报告1)。ADC所致ILD管理的复旦肿瘤标准与DS-8201管理模式也有一些不同之处,读者可仔细比较,在此不再赘述。
病例报告1:69岁老年女性,诊断左侧乳腺癌术后胸壁转移,多线抗HER2治疗失败。2020年9月开始给予ARX788(抗HER2 ADC)治 疗[24-25]。2020年11月胸部CT出现两肺多发斑片影,当时无咳嗽、咳痰、胸闷等症状,考虑为CTCAE 5.0标准的1级TDILD,暂停给药并给予泼尼松0.5 mg/kg干预。1周后复查胸部CT两肺斑片影较前增多,出现气促,考虑TDILD加重至 2级,予泼尼松加量至1 mg/kg治疗,后症状缓解,并予以激素减量,3周后复查胸部CT两肺斑片影较前有所吸收。2020年12月,患者予ARX788减低1个剂量等级恢复给药,患者用药至今,TDILD未再复发和加重。患者治疗期间疗效评价为持续部分缓解(partial response,PR)。这期间患者的CT影像图见图2。
3.4.2 小分子靶向药所致ILD管理的复旦肿瘤标准(图3)
建议患者一旦出现咳嗽、呼吸困难、发热和(或)任何新的、恶化的呼吸道症状时,需及时进行氧饱和度检测、胸部CT等检查。复旦大学附属肿瘤医院回顾性分析了既往多个小分子靶向药所致ILD的发生、发展情况(例如病例报告2和3),结合文献制定了小分子靶向药所致ILD管理的复旦肿瘤标准,读者可仔细阅读,在此不再 赘述。
病例报告2:68岁老年女性,诊断右侧乳腺癌术后,骨及淋巴结转移。复发后经历氟维司群一线内分泌治疗,进展后于2015年1月开始依西美坦联合依维莫司口服。2015年4月胸部CT示肺部少许间质性改变(图4A),患者无咳嗽、胸闷、气急等症状,诊断为1级TDILD,继续治疗。2015年10月患者出现频发干咳,伴胸闷、气急,无发热、咳痰、胸痛等症状,查血常规、CRP、PCT、血培养均正常,复查胸部CT示双肺间质性炎症较前加重(图4B),诊断为2级TDILD,暂停用药,并予以泼尼松 1 mg/kg口服治疗1周后症状明显好转,胸部CT示炎症已明显好转(图4C),后依维莫司减量至5 mg/d继续治疗。
病例报告3:66岁老年女性,诊断右侧乳腺癌术后,胸壁复发,骨、胸膜、淋巴结转移。复发后经历2线内分泌治疗和2线化疗。2021年1月起予以三苯氧胺联合西达本胺内分泌治疗,2021年2月患者出现胸闷,无法平躺,查胸部CT示两肺多发斑片影(图5A),考虑存在3级TDILD。予以大剂量甲泼尼龙琥珀酸钠360 mg(每天1次)冲击3 d后激素减量≥4周,同步采用头孢曲松钠抗感染、改善通气、补液营养支持等积极治疗,1周后患者胸闷症状逐渐好转,复查CT提示间质性肺炎基本消退(图5B)。
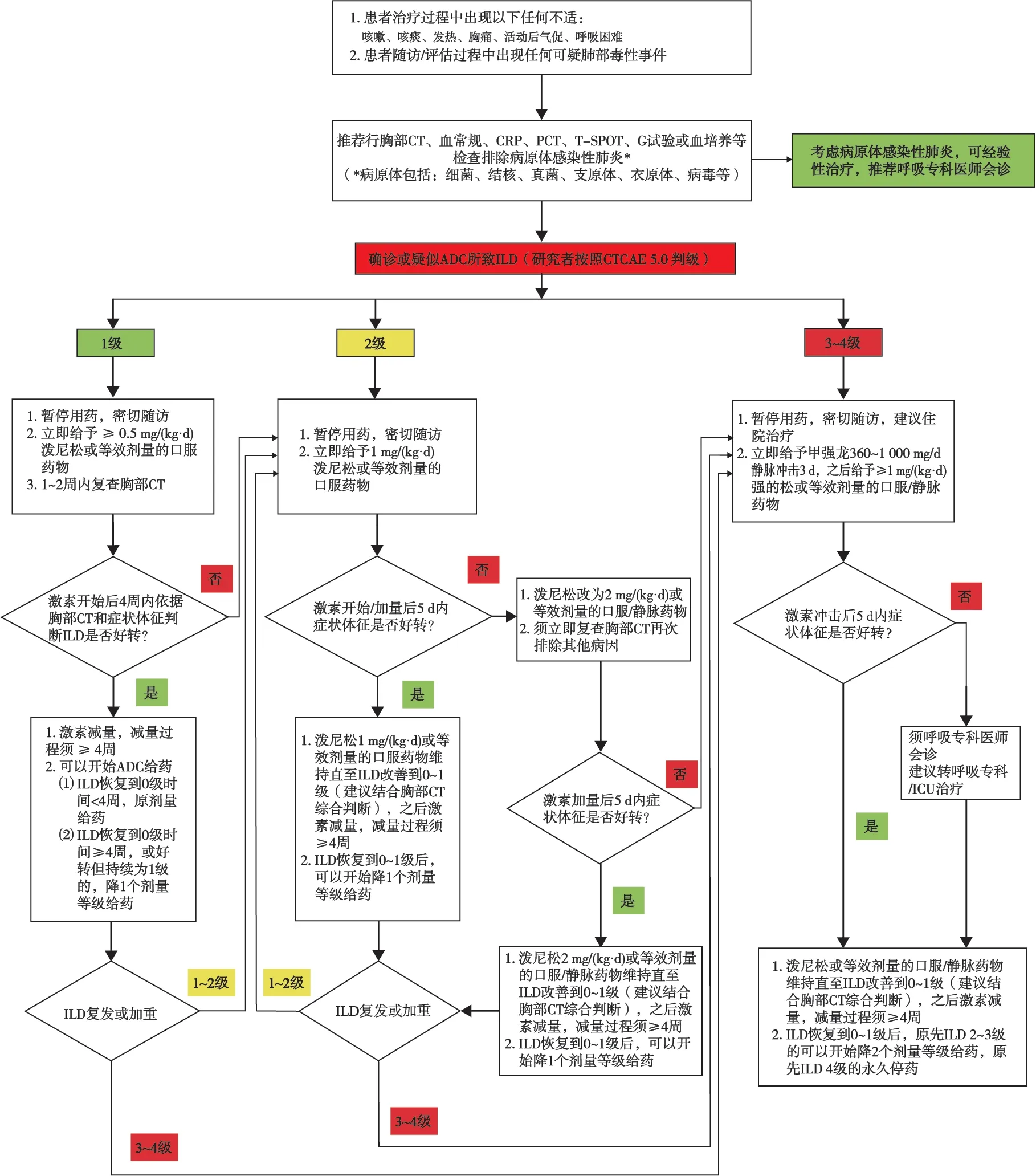
图1 ADC所致ILD管理的复旦肿瘤标准Fig.1 Fudan University Shanghai Cancer Center (FUSCC) criteria for the management of ADC-induced ILD
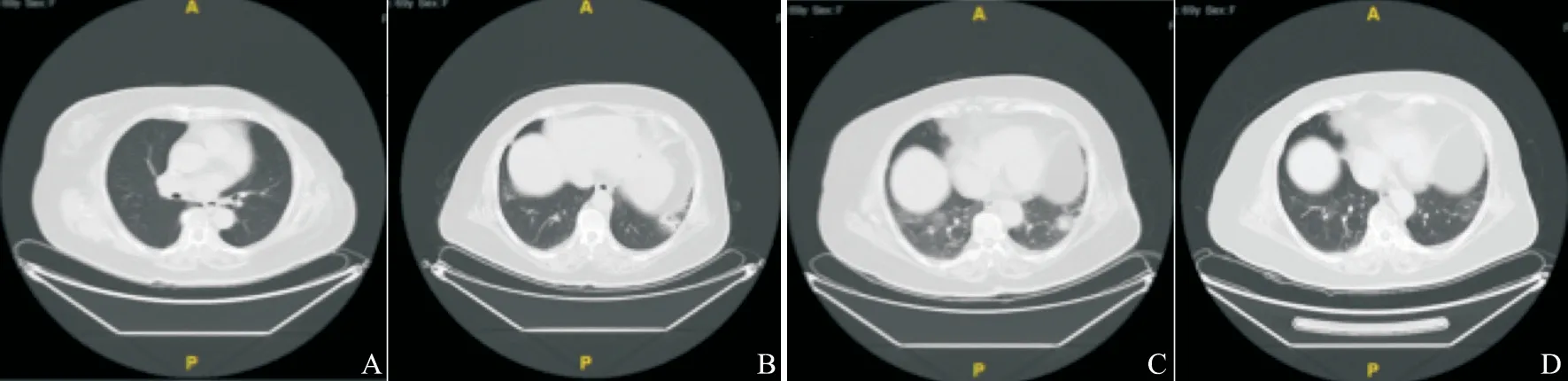
图2 病例报告1中患者的诊断图像Fig.2 CT images of the patient in case report 1
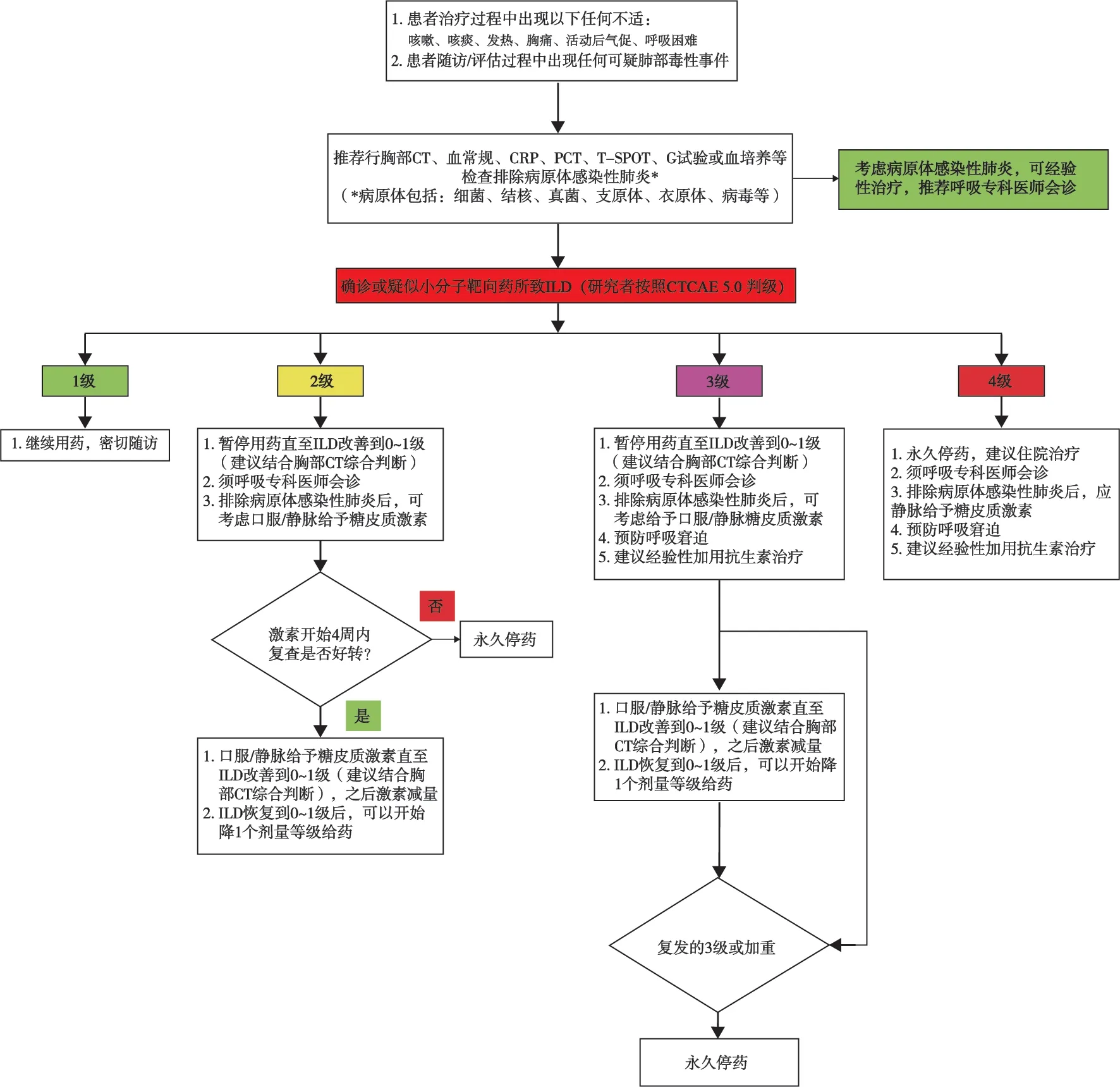
图3 小分子靶向药所致ILD管理的复旦肿瘤标准Fig.3 FUSCC criteria for the management of small molecule targted drug-induced ILD
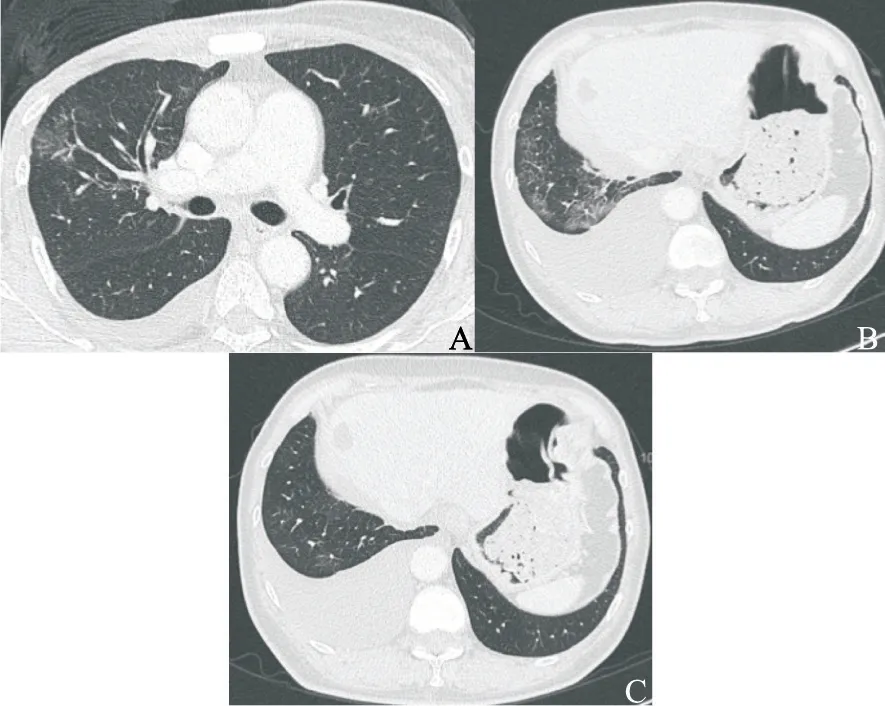
图4 病例报告2中患者的CT诊断图像Fig.4 CT images of the patient in case report 2
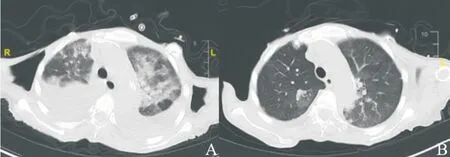
图5 病例报告3中患者的CT诊断图像Fig.5 CT images of the patient in case report 3
4 总结
值得注意的是,尽管前文已就TDILD给出了详尽的管理建议,但这仍不能涵盖临床上遇到的所有情况。TDILD的复旦肿瘤标准有建议的适用范围,各位医护人员在临床实践和临床试验参考时需结合患者自身的诊疗情况做出合理判断。此外,对患者和医护人员的教育是TDILD管理的重要准则,治疗之前评估患者的肺部疾病史必不可少,早发现、早干预是影响患者结局的最关键因素。我们将根据不断积累的临床经验,不断总结,及时更新复旦肿瘤标准,以便使TDILD的管理日臻完善。
