紫薇F3H基因的克隆与生物信息学分析
2021-06-04陈可欣乔中全曾慧杰李永欣王晓明
陈可欣, 乔中全, 曾慧杰, 李永欣,3, 蔡 能,陈 艺, 王晓明,何 钢
(1.中南林业科技大学生命科学与技术学院, 湖南 长沙 410004; 2.湖南省林业科学院, 湖南 长沙 410004;3.长沙市木本花卉工程技术研究中心, 湖南 长沙 410004 )
紫薇(Lagerstroemiaindica)为千屈菜科紫薇属木本植物,别名“痒痒树”“百日红”[1],在我国华北、华南、西南地区分布广泛[2]。“紫韵”紫薇是湖南省林业科学院选育的,于2016年12月获得国家林业局植物新品种权证书的彩叶紫薇新品种。其嫩叶呈深红色,老叶呈紫灰色[3],叶片中花青素含量丰富。花青素为水溶性的天然色素,在抗氧化、抗癌、清除自由基等方面具有卓越功效[4]。黄烷酮-3-羟化酶(Flavanone-3-hydroxyase,F3H)是花青素合成过程的中间产物,在C3位置羟基化生成二氢黄酮醇化合物[5]。JIANG F等[6]在草莓中构建F3H基因的RNAi沉默载体后,发现其果实表皮变成了绿色,而内部变成了白色。NISHIHARA M等[7]在白色蓝猪耳F3H基因的上游区域插入一段长重复序列是致使花瓣未着色的原因,导入外源F3H基因后花瓣呈粉红色。这说明F3H基因对植物花色、叶色的形成具有关键作用。目前关于彩叶紫薇育种的研究主要集中在杂交育种、诱变育种、选择育种。由于自交不亲和,人工授粉率低,诱变后遗传性状不稳定,因此,传统方法培养新彩叶紫薇品种需耗费大量物力和时间。采用基因工程技术在转录调控水平上改变叶色、花色基因的表达将开启紫薇育种的新模式。目前已从矮牵牛[8]、独行菜[9]、茶树[10]、芒果[11]等植物中克隆出F3H基因,而在紫薇中的相关研究未见报道。本研究通过同源克隆和RACE技术克隆了紫薇F3H基因的cDNA序列,并进行生物信息学分析,以期为进一步研究F3H基因在紫薇花青素生物合成中的功能奠定基础,也为后续“紫韵”紫薇分子育种提供参考。
1 材料与方法
1.1 实验材料
实验材料为湖南省林业科学院选育的紫薇新品种“紫韵”。于2019年6月在湖南省林业科学院实验基地取其新鲜叶片进行速冻处理,保存于-80 ℃的冰箱。
1.2 总RNA的提取与cDNA第一条链的合成
利用艾德莱公司RNA快速提取试剂盒提取总RNA,然后用1%的琼脂糖凝胶电泳检测其完整性。按照HIScript II Q RTSuperMix for qPCR(+gDNA wiper)(南京诺唯赞)说明书上的方法合成cDNA第一条链,再使用酶标仪测定其初始浓度并稀释到终浓度200 ng·μL-1,保存在-20 ℃度的冰箱备用。
1.3 紫薇的F3H(LiF3H)基因的保守片段合成
在NCBI上通过木本植物(茶树、石榴、柑橘、核桃、梨、苹果、桃子)选择F3H基因保守片段较高的部分序列设计简并性引物。25 μL PCR反应体系:2×EsTaq MasterMix(Dye)12 μL,正反向引物各0.8 μL,“紫韵”紫薇嫩叶cDNA 2.5 μL,无菌水8.9 μL。设置PCR反应程序:94 ℃ 2 min,94 ℃ 2 min,55 ℃ 30 s,72 ℃ 30 s,72 ℃ 3 min,32个循环;经过电泳跑胶,得到与预期差不多大小的片段;利用琼脂糖凝胶纯化回收试剂盒切胶回收,送至长沙擎科生物公司测序。
1.4 LiF3H基因的全长克隆
根据保守片段测序结果,设计5′和3′内侧、外侧各两条引物,按照TAKARA SMARTER®RACE 5′/3′Kit Components(宝日医生物技术(北京)有限公司)说明书上的方法将完整性质量较好的RNA分别进行逆转录成cDNA,并设置PCR反应程序:94 ℃变性30 s,68 ℃退火30 s,72 ℃延伸2 min,35个循环。将最后一轮PCR扩增条带切胶回收,与pTOPO-TA载体连接转化至大肠杆菌感受态DH5α中,经摇床过夜培养;挑单克隆,送至生工生物工程(上海)股份有限公司测序。
1.5 LiF3H蛋白的生物信息学分析
通过ORF Finder预测其最大开放阅读框;利用在线网站ProtParam预测LiF3H蛋白的基本理化性质;通过Conserved Domains分析LiF3H蛋白的保守结构域。利用SOPMA、Swiss-Model对LiF3H蛋白进行二级结构和三级结构的空间结构预测;利用SignalP4.1和TMHMM Sever 2.0工具进行LiF3H蛋白质信号肽和跨膜区的预测。通过DNAMAN软件进行多序列比对,利用MEGA构建进化树。
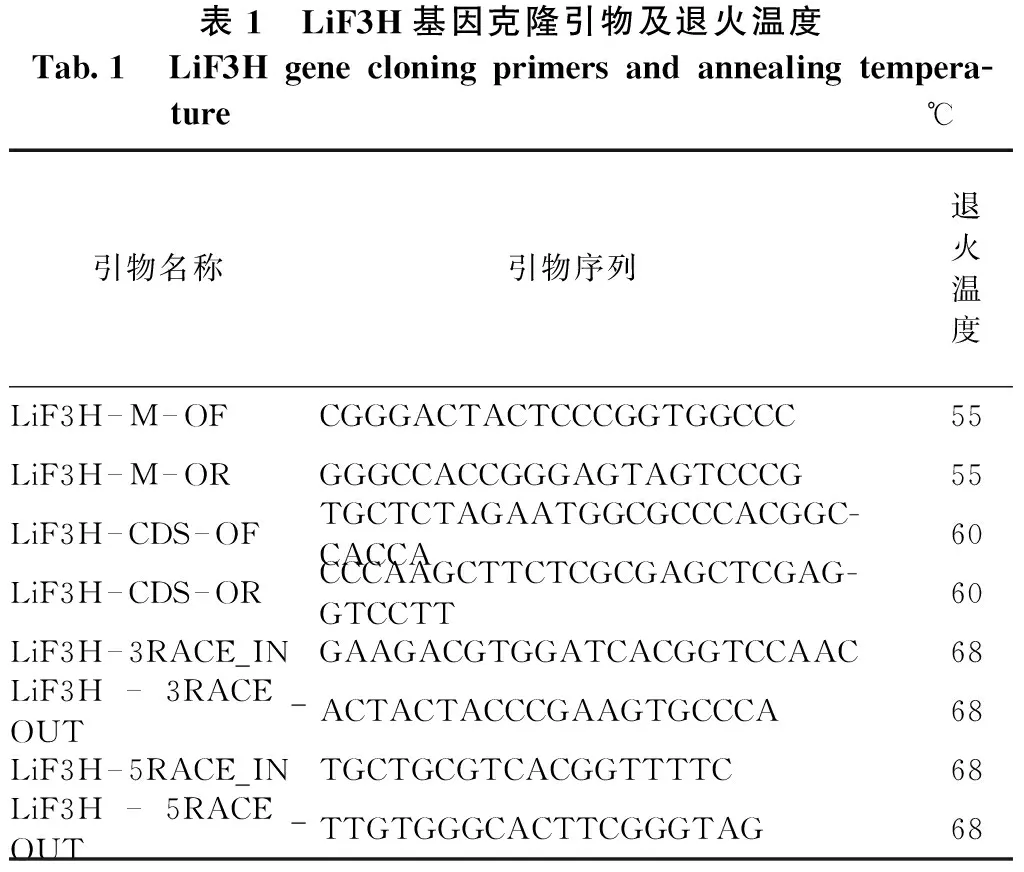
表1 LiF3H基因克隆引物及退火温度Tab.1 LiF3H gene cloning primers and annealing tempera-ture℃引物名称引物序列退火温度LiF3H—M—OFCGGGACTACTCCCGGTGGCCC55 LiF3H—M—ORGGGCCACCGGGAGTAGTCCCG55LiF3H—CDS—OFTGCTCTAGAATGGCGCCCACGGC-CACCA60LiF3H—CDS—ORCCCAAGCTTCTCGCGAGCTCGAG-GTCCTT60LiF3H—3RACE_INGAAGACGTGGATCACGGTCCAAC68LiF3H—3RACE_OUT ACTACTACCCGAAGTGCCCA68LiF3H—5RACE_IN TGCTGCGTCACGGTTTTC68LiF3H—5RACE_OUT TTGTGGGCACTTCGGGTAG68
2 结果与分析
2.1 LiF3H基因保守片段的克隆
对LiF3H基因保守片段进行扩增得到其测序正确大小为345 bp的条带(见图1),将其在NCBI数据库上比对。结果显示,该基因片段与石榴的F3H基因相似度最高,可以确定已经克隆得到紫薇的F3H基因的一部分。
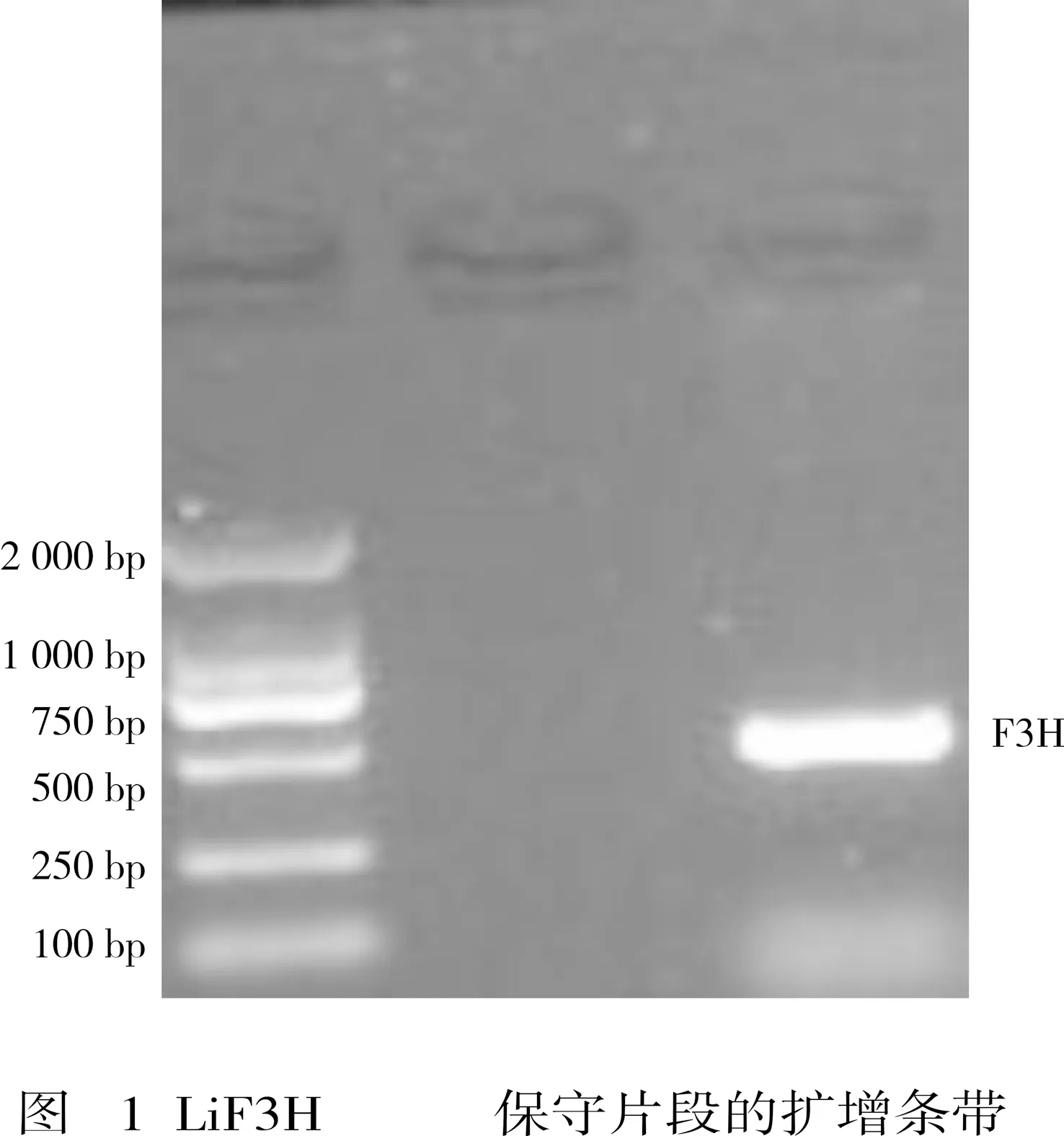
图1 LiF3H基因保守片段的扩增条带Fig.1 Cloning of LiF3H conserved fragment
2.2 LiF3H基因的全长克隆
对LiF3H基因的保守片段设计5′和3′内外侧特异性引物,经过切胶回收与pTOPO-TA连接转化以及测序,得到大小都为563 bp的片段(见图2、图3);将5′、3′序列和保守片段进行拼接得到LiF3H基因的cDNA序列,通过ORF Finder在线预测LiF3H基因最大CDS序列,设计引物测序得到大小为1116 bp的条带(见图4),与预期的结果一致。
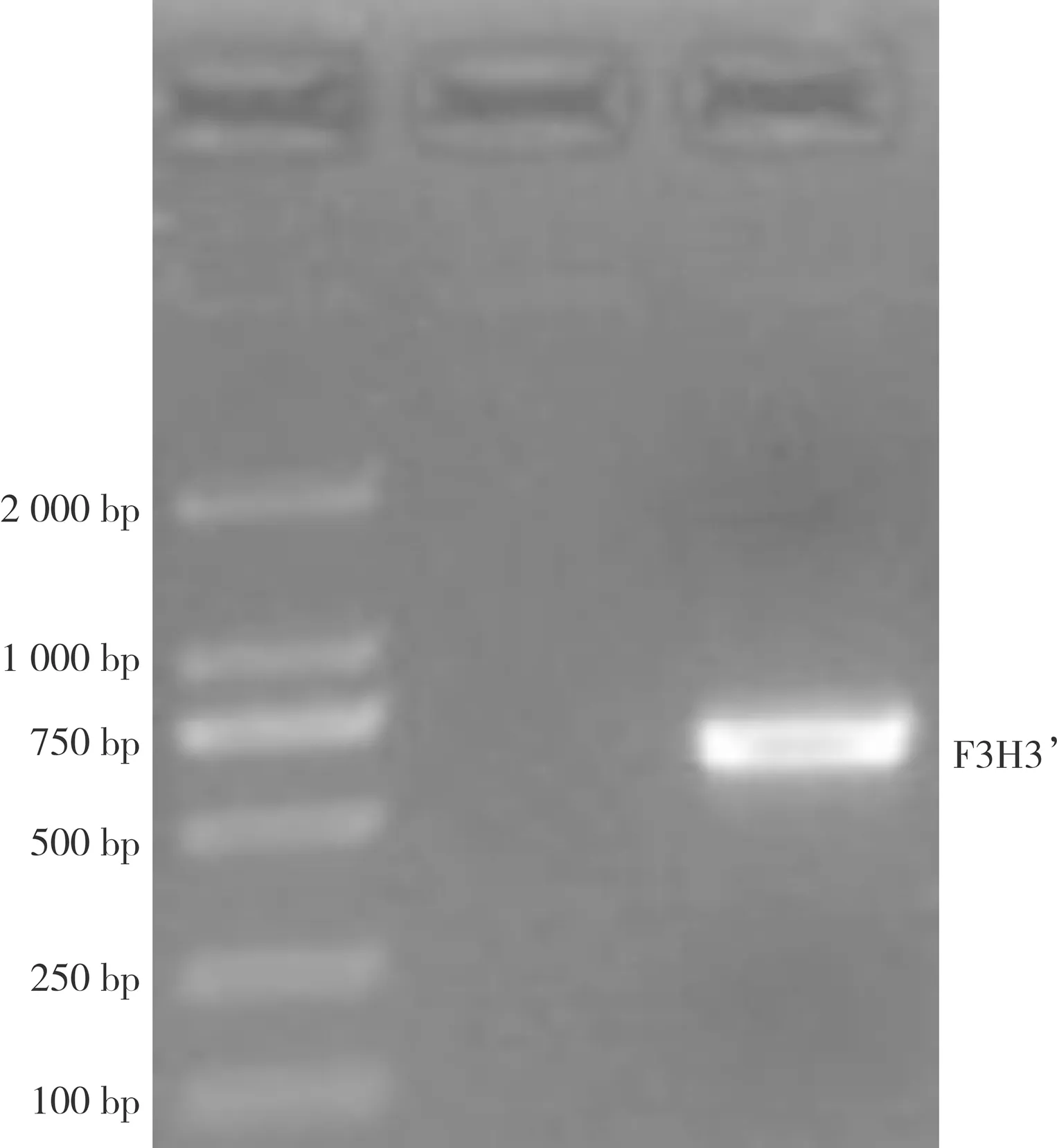
图2 LiF3H基因3′RACE扩增条带Fig.2 Amplified band of LiF3H gene 3'RACE
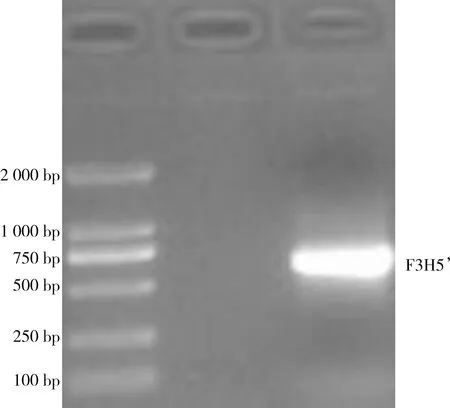
图3 LiF3H基因5′RACE扩增条带Fig.3 Amplified band of LiF3H gene 5'RACE
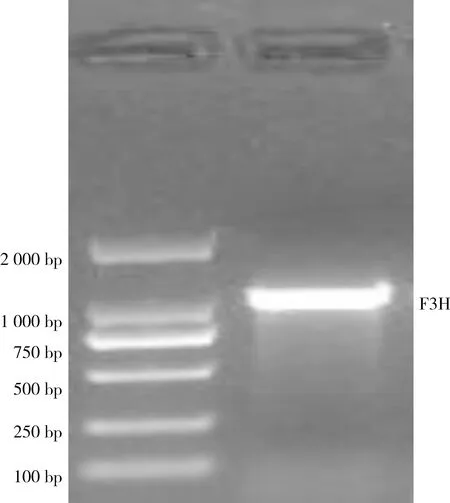
图4 LiF3H基因CDS扩增条带Fig. 4 Amplified band of LiF3H gene CDS
2.3 LiF3H蛋白的基本理化性质
将LiF3H蛋白序列输入ProtParam在线网站进行分析。结果显示,该蛋白的分子量为41.600 36 KD,分子式为C1842H2923N505O563S14,等电点为5.26,不稳定系数为45.4,亲水性为-0.427,说明该蛋白为不稳定的亲水性蛋白。
2.4 LiF3H蛋白的保守结构区域预测
利用NCBI上的Conserved Domains分析LiF3H蛋白的保守结构域,结果显示,该蛋白含有的PcbC保守结构域位于37~315,2OG-Fell-Oxy结构域位于200~294。其中 His(220,278)、Asp222是依赖 Fe2+的活性结合位点,Arg288和 Ser287是依赖2-酮戊二酸的活性结合位点。
2.5 LiF3H蛋白的信号肽、跨膜区预测
利用SignalP 4.1工具进行预测,结果显示,LiF3H蛋白无信号肽;利用TMHMM Sever 2.0工具进行预测该蛋白无跨膜区域,属于非膜蛋白。
2.6 LiF3H蛋白的二级结构和三维结构预测
利用SOPMA在线网站对LiF3H蛋白序列进行二级结构预测,结果显示:该蛋白以α-螺旋和不规则盘绕为主,分别占39.62%和37.74%;延伸链占17.79%,β-转角占4.85%(见图5)。
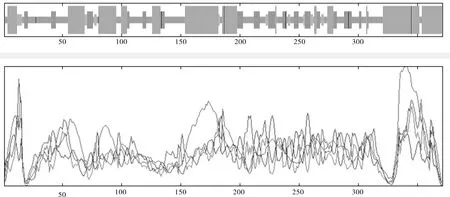
图5 LiF3H蛋白二级结构的预测Fig.5 Prediction of secondary structure of LiF3H protein
利用Swiss-Model在线网站对LiF3H蛋白的三级结构进行建模,以拟南芥花青素合成酶(anthocyanidin synthase,ANS,PDB ID:1gp4)为模版,结果显示,该蛋白的三维模型覆盖率为88%,序列的一致性为29.97%(见图6)。
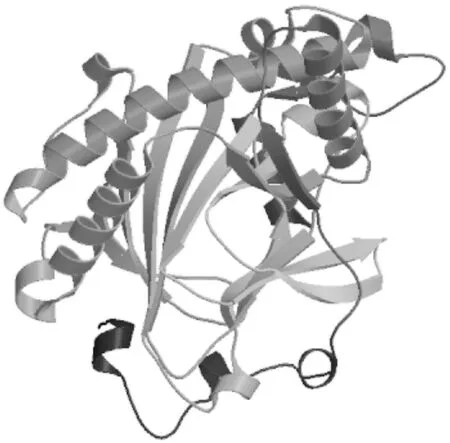
图6 LiF3H蛋白的三级结构预测Fig.6 Prediction of the tertiary structure of LiF3H protein
2.7 LiF3H蛋白的多序列对比及系统进化树
通过DNAMAN软件进行多序列比对,结果显示,LiF3H蛋白与石榴、杨梅、榴莲、巨桉、木槿的F3H蛋白同源性分别为90.39%、87.06%、86.25%、84.91%和81.13%,说明LiF3H蛋白在进化上较为保守(见图7)。

图7 LiF3H蛋白的保守结构域预测Fig. 7 Prediction of the conserved domain of LiF3H protein
在MEGA上用邻接法将LiF3H蛋白的氨基酸序列与其他12种植物F3H蛋白的氨基酸序列构建系统进化树,发现LiF3H蛋白与同属千屈菜科的石榴F3H蛋白的亲缘关系最近,其次为月季的(见图8、图9)。

图8 LiF3H蛋白与其它物种F3H蛋白的多序列比对Fig.8 Multiple sequence alignments between LiF3H protein and F3H protein of other species
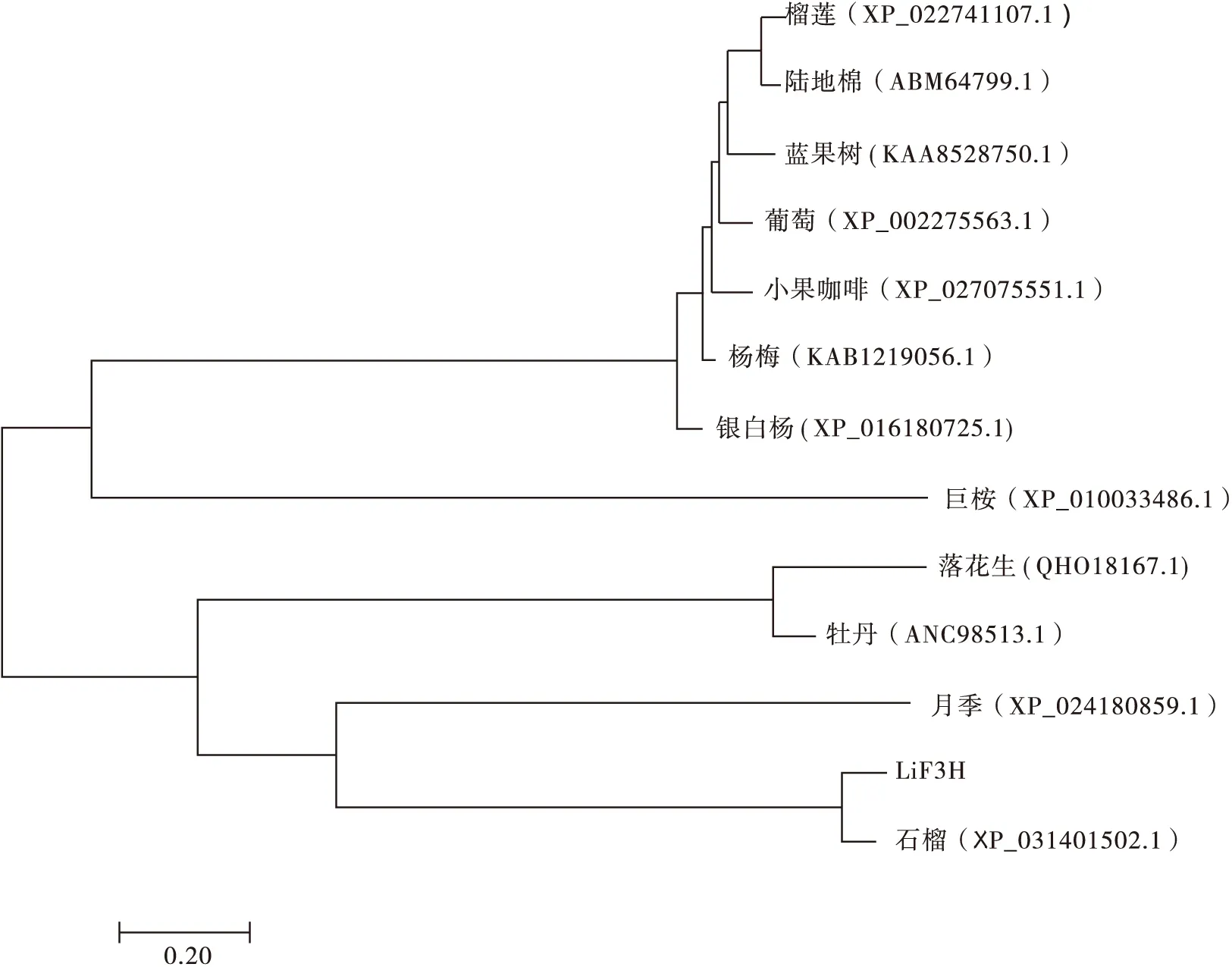
图9 LiF3H蛋白与其它物种F3H蛋白的系统进化树Fig.9 Phylogenetic tree of LiF3H and F3H proteins of different species
3 结论与讨论
花青素苷在植物体内是通过糖苷键结合从而稳定存在于细胞的液泡中[12]。花青素合成途径的起始前体是苯丙氨酸,经过苯丙氨酸解氨酶(PAL)、肉桂酸羟化酶(C4H)、4-香豆酸 CoA连接酶(4CL)、查尔酮合酶(CHS)、查尔酮异构酶(CHI)、黄烷酮-3-羟化酶(F3H)、花青素合成酶(ANS)等一系列酶的作用下生成各色花青苷[13]。黄烷酮-3-羟化酶(F3H)是花青素苷合成途径的一个中间枢纽。有研究表明,F3H基因的表达量与花青素含量密切相关,从而影响植物呈色的变化。师守国等[14]研究枣的F3H基因发现其红熟期表达量最大,绿熟期表达量最低,且表达量变化与花色苷含量变化有相同趋势。范月婷等[15]通过在烟草中表达HbF3H基因,其颜色显著加深,同时促进了花青素的积累。本研究中,“紫韵”紫韵嫩叶时期为深红色,推测可能紫薇的F3H(LiF3H)基因在叶片生长初期表达量较高,酶活性较强,积累了较多的花青素,从而使叶片呈现出不同于常见的绿色。这些还需进一步做荧光定量表达与花青素含量关系的实验来验证。
在本研究中,克隆得到了LiF3H基因长度为1372 bp的cDNA序列,5′非翻译区长113 bp,3′非翻译区长106 bp,包含了30 bp的polyA,表明在紫薇中成功克隆到了F3H完整基因。得到的最大开放阅读框为1116 bp,编码为371个蛋白。该蛋白为2-酮戊二酸双加氧酶超家族成员,其保守结构域与其他植物F3H蛋白的相类似。系统进化树分析表明,LiF3H蛋白与同为千屈菜科的石榴F3H蛋白的亲缘关系最近。本研究为进一步深入研究LiF3H基因在紫薇花青素合成中的功能奠定了基础,也可为紫薇转基因育种提供参考。
