化学链概念在共沸物分离中的应用
2021-06-03高鑫耿雪丽
高鑫,耿雪丽
1.引言
在石油和精细化工行业,从下游分离过程中分离出的共沸物,对于生产高纯度产品或回收增值物质至关重要[1,2]。然而,传统的精馏分离技术对于共沸物的分离已经不能有效发挥作用,应采用特殊的分离技术来实现共沸物分离[3,4]。目前,已经使用和开发了许多特殊的分离技术,且每种技术都有自己的应用范围,如特殊精馏[5,6]、膜分离[7,8]、萃取[9,10]、吸附[11,12]和结晶[13,14]。膜分离法和吸附法主要用于溶剂回收和低碳数烯烃/烷烃体系的气体分离[15,16]。膜分离的机理有很多种,其中一种是基于分子水平上的分子通过半渗透膜时不同粒径的大小,虽然由于分子结构相似,对烯烃/烷烃的产物分离可能存在一些不可避免的限制,但是其高效、节能、环保的优点在特殊共沸物的分离中起着重要作用。结晶和萃取主要用于医药和精细化工领域,适用于溶点或分配系数差异较大的体系[17,18]。
与其他分离方法相比,共沸精馏、萃取精馏、变压精馏等特殊精馏方法,已被广泛应用于共沸物的分离[19-25]。共沸精馏和萃取精馏采用质量分离剂来实现混合物分离,但这两种分离方法需要较高的能量[26]。当共沸物组成随着压力的变化发生显著改变时,变压精馏的方法是有利的。但该方法的弊端是要求在压力变化不超过1.01 × 106Pa时,共沸物组成必须至少变化5%(最好超过10%)[27]。几十年来,人们利用共沸物的特殊性质,采用上述特殊的精馏分离方法来实现分离。然而,对于某些特殊的共沸体系,如乙二醇(EG)和1,2-丁二醇(1,2-BD)混合物,这些分离方法效果不明显并且能耗高[28,29]。一种潜在的基于化学链概念的特殊分离方法,引起了学术界和工程界的关注。化学链方法通过与添加的反应物进行可逆反应,实现了混合物分离。添加的反应物选择性地与共沸物的一种组分反应形成另一种物质,打破了原有的共沸,实现了共沸物的分离。
化学链的概念最早于20世纪50年代提出[30]。在化学链中,化学物质的反应和再生循环进行,以实现生产或分离的目标。更详细地说,可以使用化学链物质将给定的过程分为多个子反应,该化学链物质在子反应的过程中进行反应和再生。早期,化学链的概念被用于从氢气和氧气中生产过氧化氢[31,32]。最近,Fan和Li [33]综述了化学链在化石燃料能源转换中的应用,并提出化学链有潜力成为一种高效且环保的过程。化学链在氧化反应中最重要的作用是反应本身的安全性,因为基于氧气或基于空气的氧化反应通常是剧烈的,并且可能会发生爆炸[34-37]。Fan等[38]也指出了碳燃料转化过程中为二氧化碳捕集的化学链过程的前景和机遇。此外,化学链在共沸物分离过程中的应用也逐渐出现[39-41]。绿色化学之父Anastas等在《科学》杂志中提出了未来化学领域必须做出的12项变革[42]。未来化学的第一个变革主要是从线性过程到循环过程,也就是化学链过程。尽管此概念尚未被广泛应用于共沸物分离过程,但它是基于共沸物中一种或两种组分与另一种添加的反应物(即化学链物质)的反应速率之间的差异。
本文综述了化学链概念在共沸物分离中的基本理论和应用。本文第二部分阐述了化学链分离(CLS)方法分离共沸物的基本概念。第三部分分析了用于挑选适当的反应物来实现有效共沸物分离的必要原则。第四部分通过案例分析,阐述CLS方法在共沸物分离中的应用。本文旨在对这种基于化学链的新型共沸物分离方法进行一种系统的概述和分析,并指出发展该共沸物分离方法的新的研究方向。
2.共沸物的CLS
CLS利用一种反应物进行反应-分离-可逆反应的循环过程,来实现共沸物的分离[43]。在这个过程中,这种反应物会通过正向和逆向反应过程进行反应和再生。这种基于化学链概念的共沸物分离方法称为CLS。CLS过程的可视化阐述如图1所示。首先,共沸物中的两个组分A和B,分别与反应物C反应生成相应的产物D和E。接着,相应的产物可以很容易地从反应混合物中分离出来。最后,可以通过相应产物的逆过程得到高纯度的A和B,而反应物C也可通过逆过程回收并再循环。
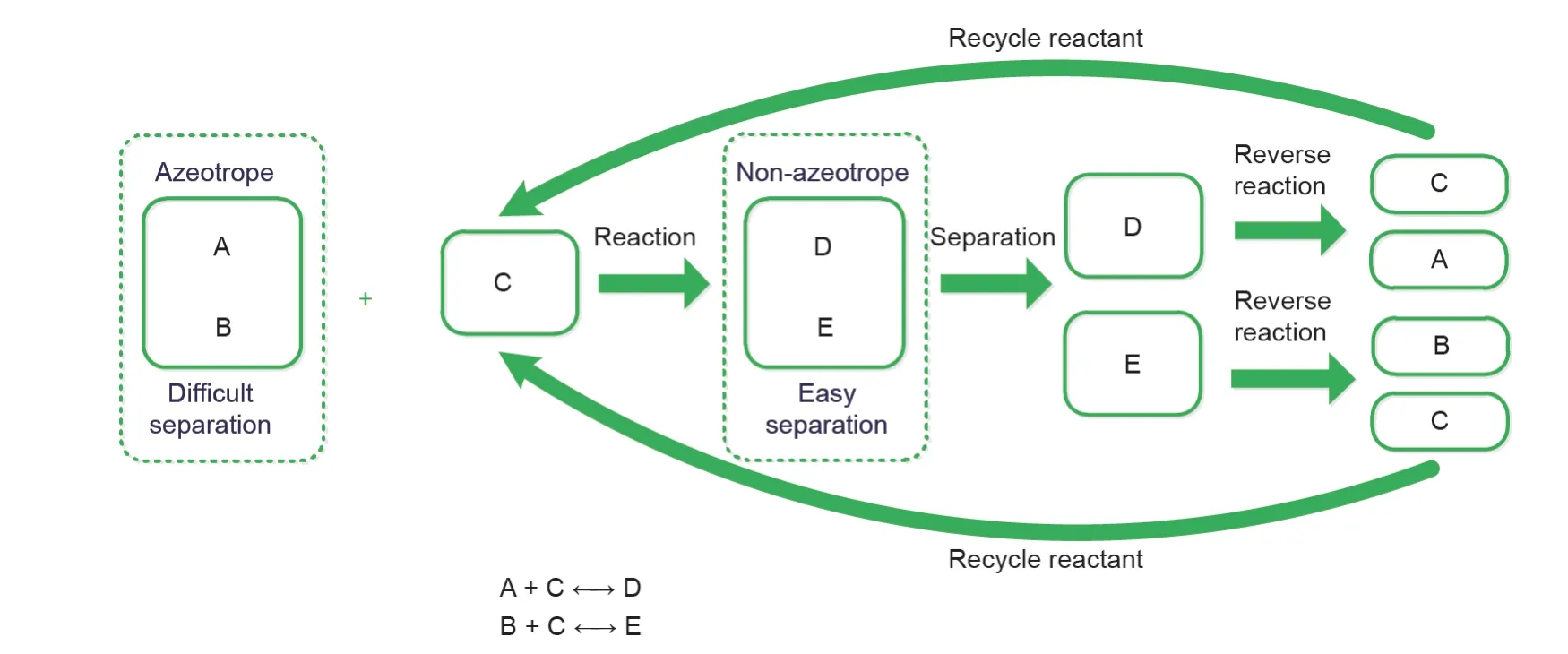
图1.CLS过程的可视化阐述。
在利用CLS方法分离共沸物的过程中,最好的情况是,只有一种共沸物化合物与反应物发生反应生成相应的产物,这种产物与其他组分不存在共沸,例如,通过结晶分离二甲苯异构体[44]。然而,这个反应物必须与共沸物组分之间具有不同的反应性,这样的反应物是很难获得的。在很大程度上,反应物可以与共沸物的两种组分发生不同程度的反应,如多元醇的分离[28]。幸运的是,不同物质之间的反应速率通常不同,这表明可以利用反应速率的差异来实现共沸物的分离。如果共沸物中的一个组分与反应物发生反应的程度比共沸物中的另一个组分慢,那么在混合物中只会形成一小部分不需要的产物。因此,这对目标产物的分离及其纯度的影响很小。利用反应速率差异来分离共沸物是第二个最佳的情况。此外,如果无法找到用于共沸物分离的反应物,那么选择与共沸物中的两个组分均可以发生反应的反应物是最简单的情况。因为获得具有相似性质的同源或异构共沸物分离的反应物更容易。基于以上分析,共沸物组分与反应物之间的反应可分为三种类型,不同的反应类型具有不同的分离过程。
在图2中,I型(单一反应)表示分离过程存在一个可逆反应,反应物C仅与二元共沸物的一个组分A发生反应生成产物D,这时无共沸行为的B和D混合物就很容易被分离,最后借助反应精馏(RD)通过将相应的产物D逆过程再生得到组分A。如图3所示,II型是指所选反应物C与共沸物中的两个组分反应,但是它们的反应速率显著不同。与组分B相比,A与C的反应速率明显更快。这个差异导致产物D的量远大于产物E的量,并且需要进一步纯化产物D。最后,可通过RD回收组分A。如图4所示,III型(无转化率差异的两个反应)是指所选反应物C与共沸物中的A和B两个组分均发生反应,且这两个反应的反应速率相同。通过分离和分解相应的产物D和E,可分别得到纯的A和纯的B。尽管反应速率不同,但I型和III型属于II型的特殊形式。从经济的角度来看,I型共沸分离方式是很有前景的。因此,反应物在共沸物分离中起着重要的作用,而反应物的选择也是基于CLS法的共沸物分离的关键。反应物选择的原则将会在下一节内容中进行详细的讨论。
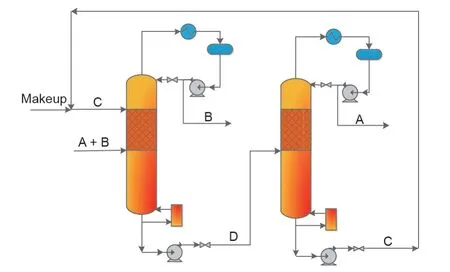
图2.单一反应Ⅰ型CLS法。
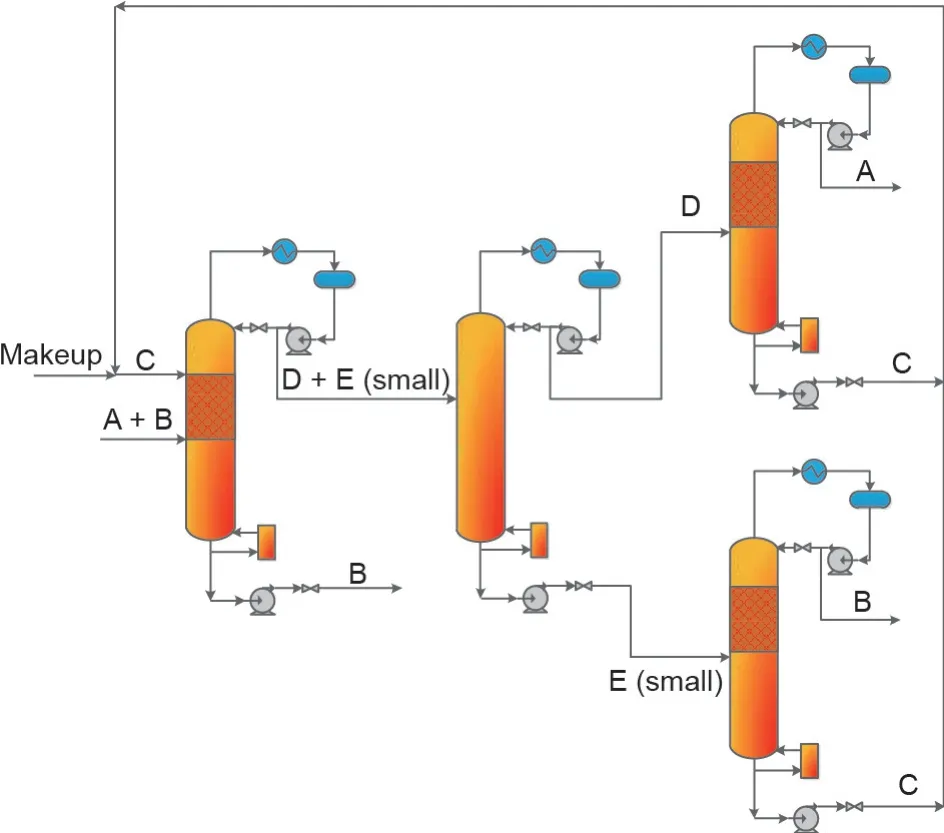
图3.两个反应转化率不同的II型CLS法。
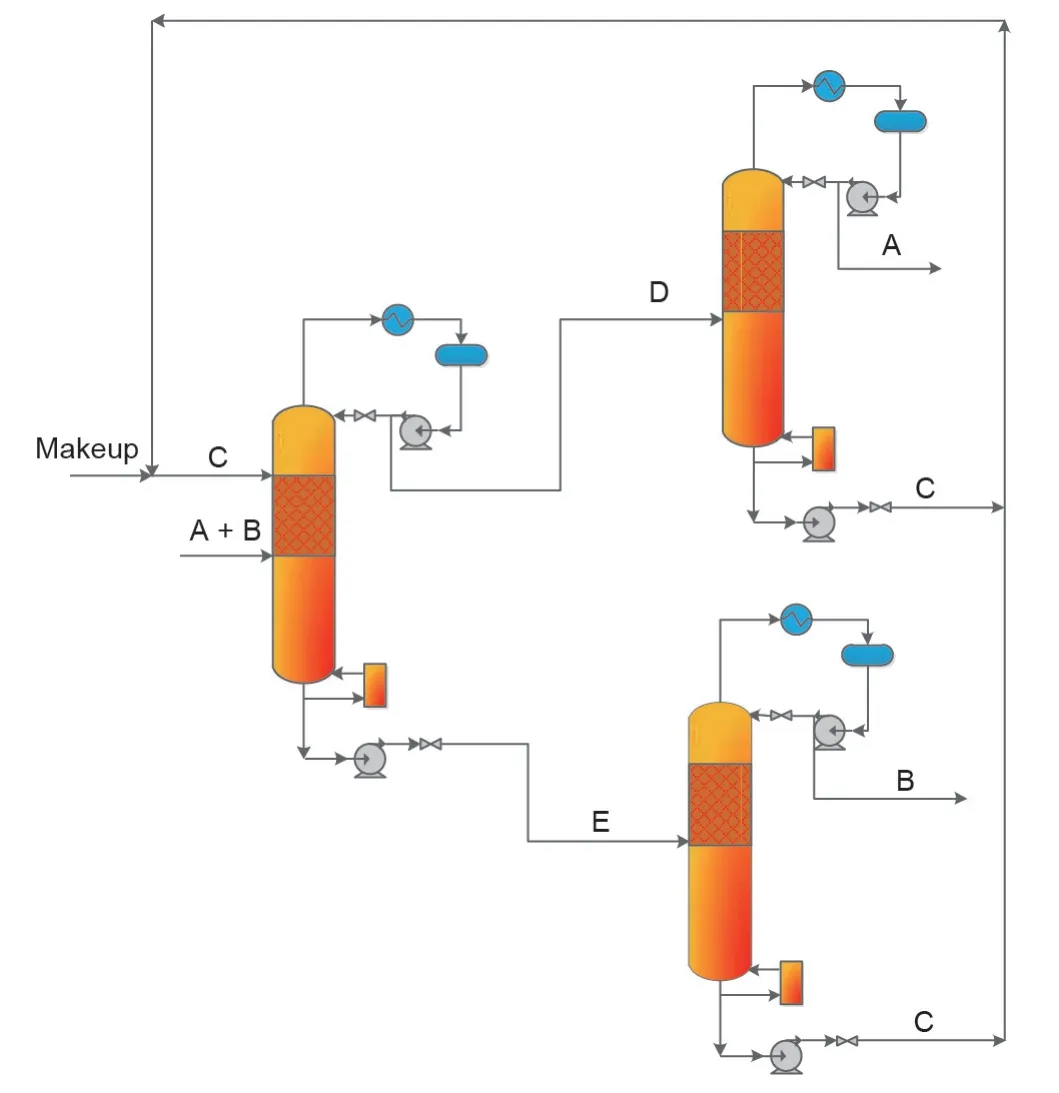
图4.两个反应转化率相同的III型CLS法。
3.反应物的选择
众所周知,在化学链燃烧过程中有效生产纯合成气/氢气的关键,是从单金属氧化物系统中选择氧载体[45-47]。同样地,在利用CLS的可逆反应辅助分离共沸物时,反应物的选择也是至关重要的。利用CLS法的共沸物分离过程包括反应、分离和逆反应。因此,在整个CLS中,反应物在分离效率和可持续性方面起着主要作用。基于我们之前的工作[48],本研究提出了一种利用CLS法分离共沸物的反应物选择方法,相应的流程图如图5所示。
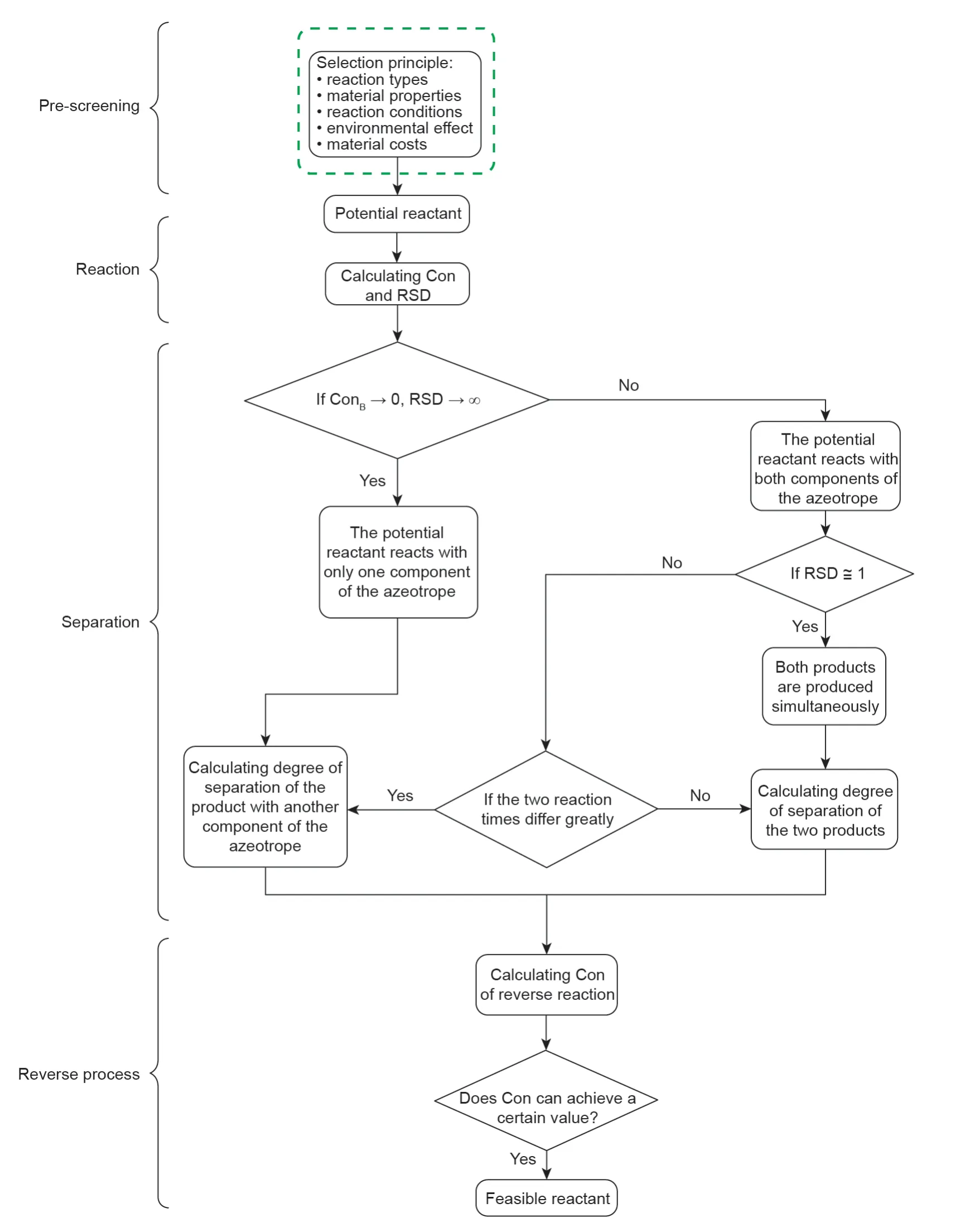
图5.利用CLS法分离共沸物的反应物选择方法路线图。Con:转化率;RSD:反应选择性差异。
3.1.预选择
首先,基于某些选择原则,采用预选择的方法来缩小反应物的范围。如下所示,预选择将从反应类型、材料性质、反应条件、环境影响和材料成本等方面考虑,选择作为化学链物质的潜在反应物。
· 反应类型:可逆、高选择性(无副反应)和微不足道的反应热。
· 材料性质:稳定和适宜的热力学性质。
· 反应条件:反应条件温和(低温低压),能耗低。
· 环境影响:无毒且绿色。
· 材料成本:易于生产且成本低廉。
如果反应类型是可逆的且具有高选择性(无副反应),则可以在一定程度上减少共沸物组分的额外消耗和过程能耗[49]。尽管放热反应和吸热反应都会影响能耗,但精馏过程中的相变会消除反应热对过程的影响。如果反应是放热反应,可能会促进组分在反应精馏塔(RDC)中的分离。尽管逆反应可能是吸热反应,并且其发生需要更高的再沸器热负荷,但反应的放热和吸热对反应物的选择没有显著影响。反应物的稳定和适宜的热力学性质可以最大程度地减少混合物中杂质的产生,并减轻吸热或放热反应对工艺过程的影响[33]。温和的反应条件,可以减少能耗和总成本。使用无毒和绿色的反应物,不仅能够减少其对人类健康和环境的影响,而且从运输和存储的角度来看,可使整个过程更加具有经济性。最后,低成本和易于放大的反应物合成方法,可以促进CLS法在分离共沸物方面的工业应用进程。
3.2.反应
计算共沸物组分和所选反应物(通过预选择确定)的反应转化率(Con)和潜在反应选择性差异(RSD),以确定反应物的适宜性。此外,确定共沸物中的一个或两个组分是否会与反应物发生反应也是很重要的。Con和RSD分别反映了反应程度和反应选择性差异[46],如等式(1)、(2)所示。
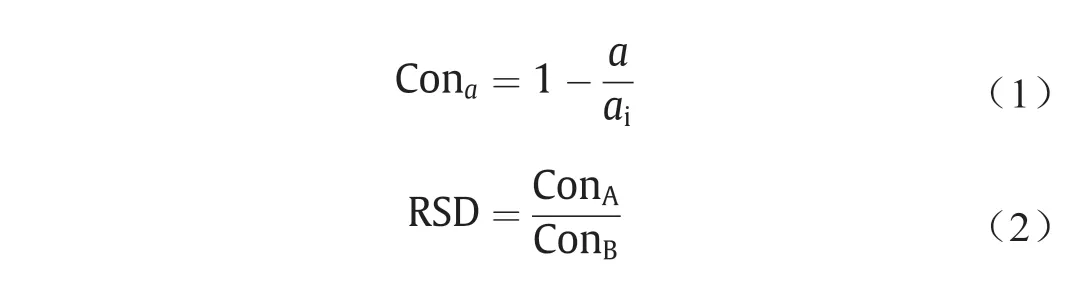
式中,a是反应系统中的A或B;ai是反应系统中的初始A或B。A和B是共沸物中的组分。这里,我们假设转化率高的组分为分子,转化率低的组分为分母。
根据RSD值和不同的Con值,潜在反应物与共沸物中的组分之间存在两种关系。在I型CLS中,潜在反应物主要与共沸物中的一个组分发生反应,而与另一个组分发生反应的程度要小得多。在这种情况下,由于这个化合物和反应物之间没有发生反应,分母的值接近零,因此RSD的值趋于无穷大。然而,因为通常情况下化学组分之间具有相似的性质,所以一般很难找到满足I型要求的潜在反应物。在II型和III型中,潜在反应物与共沸物中的两个组分均发生反应。在III型中,发生两个反应,同时得到两种产品,即两个化合物的Con值相差不大,RSD值大约为1。此时,过程中就会包含相应产品的分离过程。在II型中,一种产品的生成速度比另一种快得多,即一种化合物的Con值高于另一种,而RSD值则稍大于1。可以通过改变反应条件对转化率低的反应组分进行选择性回收,这不仅促进转化率高的反应组分的转化,而且也能有效地抑制共沸物中该组分的转化。因此,在选择反应物时,RSD值越大预示反应过程进行的越好。
3.3.分离和逆过程
分离度越高,表明混合物分离效果越好。分离度受混合物中两组分的热力学性质,以及相对挥发度和分配系数的影响,在精馏和萃取过程中,相对挥发度和分配系数必须大于1。
如果潜在反应物主要与共沸物中的一个组分发生反应,而极少与另一个组分发生反应,则可计算产物与其他组分的分离程度,以评估潜在反应物的适用性。如果潜在反应物与共沸物中的两个组分同时反应,则必须计算两种产物的分离度。当分离度大于1时,值越大表示分离效果越好,能耗越低。最后共沸物中的两个组分可以通过逆反应获得。对于此过程,有必要计算逆过程的Con。如果Con能达到一个设定值,则可以在CLS方法中使用潜在的反应物。在下一节中,本研究将借助具体的案例研究来证实这些观点。
4.CLS的应用
本节详细介绍了用于共沸物分离的化学链法,研究包括烯烃/烷烃、芳烃和多元醇产品的分离。
4.1.烯烃/烷烃的分离
4.1.1.1-烯烃分离
1-烯烃是通过费托(F-T)合成工艺生产的,该工艺已被广泛应用于含氧醇和聚合物的生产,如线性低密度聚乙烯[50-53]。在F-T合成工艺中,会形成一系列副产品,这些副产品一般有链烷烃、支链烯烃和直链内烯烃[54,55]。从副产物中回收和纯化1-烯烃[如1-己烯(HE)]具有挑战性,这是因为HE和典型副产物2-甲基-1-戊烯(2-MP)的相对挥发度仅有1.06 [56,57]。尽管现在Sasol公司(南非)[58]已经使用廉价的原材料进行该产品回收过程的商业化,但因为所有异构体都会以相似的方式与溶剂发生相互作用[59,60],因此1-烯烃回收过程仍然是一个比较困难和昂贵的操作。为了提高HE的回收率,分支异构体2-MP与甲醇(MeOH)反应生成醚,而醚的沸点相对较高,易于精馏分离[61,62]。然而,如果需要高纯度的HE,由于必须一个一个移除不需要的副产物,因此过程需要较多的分离塔板数。为了克服这一情况,研究人员开发了一种新的化学链替代技术,该技术借助可逆反应辅助精馏的手段,利用功能反应物将HE形成π-络合物。该技术是基于对金属-配体络合物、相平衡模型和π-络合效应的研究而开发的,这个概念设计是由Kuipers等[58]和Wentink等[56,57]开发的。功能性溶剂是金属-配体配合物,它不仅能使配体将金属保留在溶液中,而且还保留了其与所需烯烃形成π-络合物的能力。例如,在HE和2-MP的分离中,所需的1-烯烃(HE)比2-MP能更快地形成π-金属-配体络合物。这种使用功能性溶剂作为反应物的近沸点烯烃异构体的CLS概念,如图6所示[56-58]。
如图6所示,金属-配体络合物起到功能反应物的作用。HE和2-MP均通过π络合作用与金属-配体络合物发生反应,但HE与金属-配体络合物的反应速率大于2-MP。因此,利用反应速率的差异可以连续移除2-MP,以促进HE与该反应物的进一步反应。HE在分解塔中再生,金属-配体络合物则作为反应物被回收到RDC。Kuipers等[58]采用简单的正己烷(NH)、2-MP和HE进料混合物(摩尔比为1∶1∶2),并且通过CLS法从该混合物中纯化获得HE(大多数实验都使用该进料混合物)。使用此方法,可从塔顶获得纯度为99.5 %(摩尔分数)和最低回收率为99%的HE。
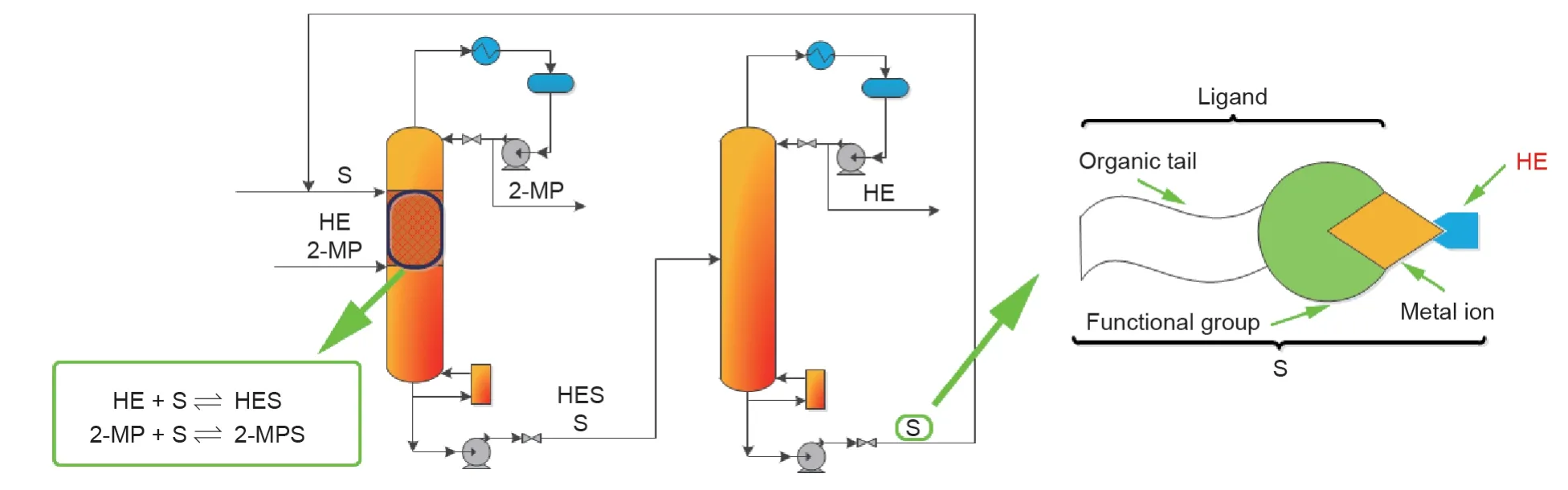
图6.以功能性溶剂为反应物分离近沸点HE和2-MP的概念设计。经American Chemical Society ©2005和Elsevier ©2007许可,转载自参考文献[56-58]。
4.1.2.高纯异丁烯的生产
异丁烯(IB)存在于碳氢化合物中,主要用于合成添加剂[63],如用作汽油中的辛烷值促进剂和清洁空气组分的甲基叔丁基醚(MTBE)[64-66]。然而,由于MTBE对环境有不利的影响,其在美国已被禁止使用。因此,取代MTBE的主要候选物质被认为是平均辛烷值为93~96的烷基化物[67,68]。由IB的二聚形成的异辛烷是潜在的烷基化物来源[69]。IB也是丁基橡胶聚合或共聚的有价值的起始材料[70]。因此,从惰性C4碳氢化合物的混合物[以1-丁烯(nB)为代表]中分离IB及其异构体具有重大的实际意义[71]。
在各种可能的反应体系中,IB与MeOH醚化生成MTBE是一个特别有价值的过程[72]。MTBE的生产过程已经得到了充分的研究,也是一种工业上已经被建立的RD过程[73-75]。此外,通过MTBE分解回收IB是经济的,并且已经得到了充分的研究。IB与nB的整个分离过程可分为IB混合物与MeOH反应生成MTBE,MTBE与nB的分离,以及MTBE分解获得IB。在这个过程中,MTBE是一个中间产物,而MeOH就是化学链物质。
理想情况下,通过使用化学链/可逆反应的概念,两个RDC可以实现IB和nB混合物的分离。图7展示了采用两个RDC进行IB和nB混合物分离的理想过程。在第一个RDC中,混合物的IB和MeOH进行MTBE的转化,其中酸性催化剂被添加至塔的上半部分,在这里IB和MeOH完全转化为MTBE。不与甲醇反应的惰性组分nB将从塔顶产出,高纯度MTBE将会在塔底获得。来自第一个塔底产品进入第二个RDC进行MTBE逆向过程,也就是在第二个塔中,通过分解MTBE并在塔顶获得IB。相对高沸点的MeOH,即化学链物质,从塔底抽出并循环回到第一个塔。该分离过程属于一种I型CLS方法。
4.2.芳烃的分离
二甲苯是从石油或煤炭中生产的重要化学品,其在现代工业中主要用于生产汽车燃料[76,77]。由于二甲苯异构体[间二甲苯(MX)和对二甲苯(PX)]的沸点非常接近(412.25 K和411.55 K),因此采用传统精馏的方法来分离它们显然是不可行的[78-79]。主要原因是传统精馏的分离过程是非常耗能的,但是采用化学链可以分离该沸点的混合物。在温和的烷基化条件下,MX可以在催化剂条件下被选择性地叔丁基化,形成高沸点的叔丁基间二甲苯(TBMX)。显然,这属于I型CLS方法。Saito等[44]通过结合化学反应和精馏,借助实验研究和理论计算,研究了以叔丁烯(TB)为反应物分离MX和PX混合物的过程。但是他们没有开发出一个连续的方案,而是提出采用间歇过程对MX和PX混合物进行反应和分离。所以,本文使用化学链的概念来分析二甲苯异构体的连续分离过程。
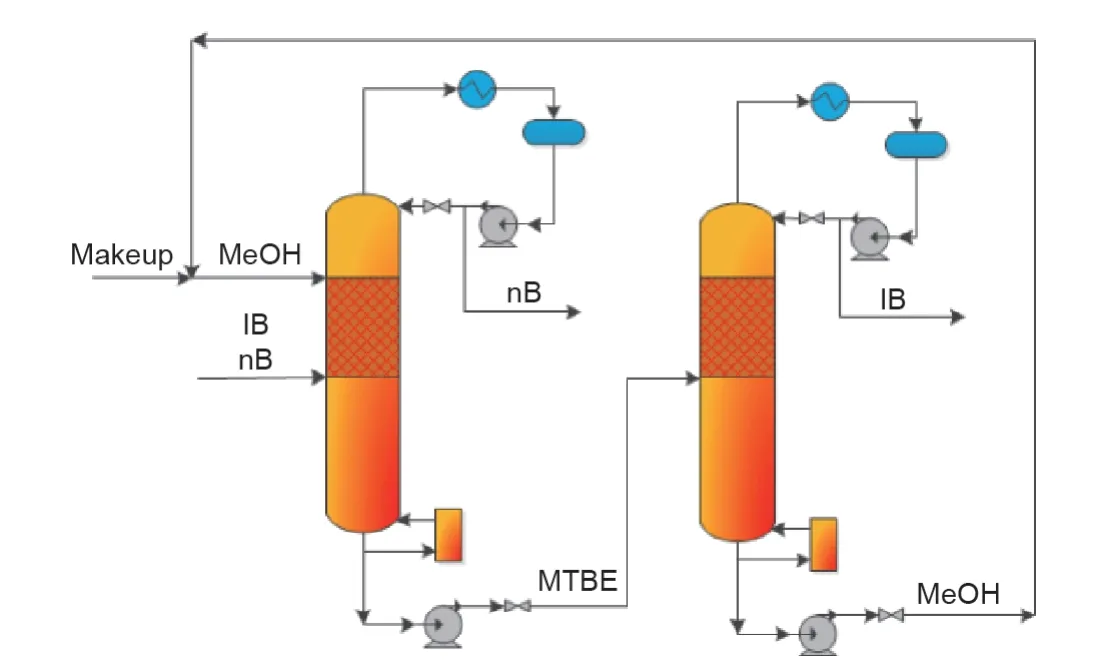
图7.以MeOH为化学链物质采用CLS法分离IB和nB。
实际上,采用CLS法分离MX和PX混合物的过程是一个理想过程。图8展示了以TB为反应物分离MX和PX混合物的流程图。
如图8所示,MX和PX混合物的分离可分为三个阶段:①将TB加入MX和PX混合物中,由于仅有MX与TB反应,因此反应会生成TBMX和苯(B),此时反应器中存在PX、TBMX和B的混合物。②由于PX、TBMX和B的沸点差异很大,采用精馏分离后在塔顶得到PX和B,在塔底得到TBMX。并且PX和B二者沸点相差较大,很容易能够再次通过精馏实现PX和B混合物的分离,获得的PX可进一步用于生产重要化学品。③MX是通过将在上一步加入B生成的TBMX进行逆过程而被重新获得的。因此,整个分离过程是以B为化学链物质,通过一系列正反应-分离-逆反应来实现二甲苯异构体的分离。事实上,可以通过反应精馏来完成正反向和逆反应过程,因此,整个过程是基于CLS方法的RD可逆反应辅助分离过程。
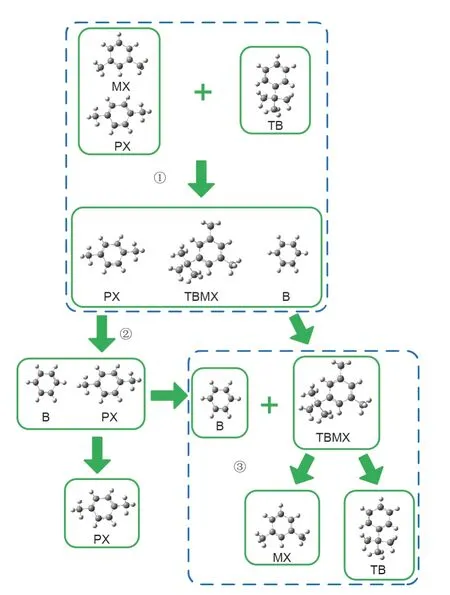
图8.以TB为反应物分离MX和PX混合物的化学链过程。B:苯。
4.3.多元醇的分离
由于C1化学的进步和全球范围内石油的短缺,在石化工业中广泛使用的EG主要是由煤合成气生产的[80-82]。由于由间接合成气制EG获得EG和1,2-BD混合物的分离,带来了越来越多的环境问题,因此需要选择一种经济和节能的分离方法[83-85]。由于EG和1,2-BD混合物存在最低共沸物,因此很难分离[86-88]。目前,采用传统精馏塔分离该混合物,所需要的回流比和理论塔板数均较大,使得该传统分离方法存在能耗高、成本高的缺点[89,90]。为了增强分离过程并提高煤基EG生产的竞争力,Li等[91]比较了常规精馏、共沸精馏、液-液萃取精馏和反应辅助精馏,并使用了基于年度总成本(TAC)和年度利润对这些方法进行经济性评价。从图9可以看出,即使CLS法的TAC略高于其他分离方法,但因其高的年利润,因此该方法优于其他分离方法。基于乙醛(ALE)作为循环反应物的CLS法分离EG和1,2-BD混合物的化学链概念如图9所示。EG和1,2-BD与ALE反应分别生成2-甲基-1,3-二氧六环(2-MD)和2,4-二甲基-1,3-二氧六环(2,4-DMD),该反应分离过程属于III型CLS法。图9给出了分离EG和1,2-BD混合物的反应辅助精馏过程的流程图和模拟结果。
如图9所示,在分离过程中,使用ALE作为反应物形成的缩醛是比较易于分离的,而缩醛通过RDC过程发生水解可以得到高纯度EG和1,2-BD。Huang等[92]研究了EG的反应动力学,将ALE与EG的摩尔比设定为2∶1,以确保EG的转化[28]。精馏塔DC1用于回收未反应的ALE和EG,DC2用于分离缩醛。在RDC1和RDC2中,2-MD和2,4-DMD发生水解再生分别得到EG和1,2-BD,而回收的ALE将循环回到反应器。通过去除DC3和DC4中的副产物水,就会分别得到纯的EG和1,2-BD。EG和1,2-BD分离过程包括一个反应器和多个精馏塔,分别利用Rstoic和RadFrac模块(Aspen Tech,美国)进行设计和模拟。
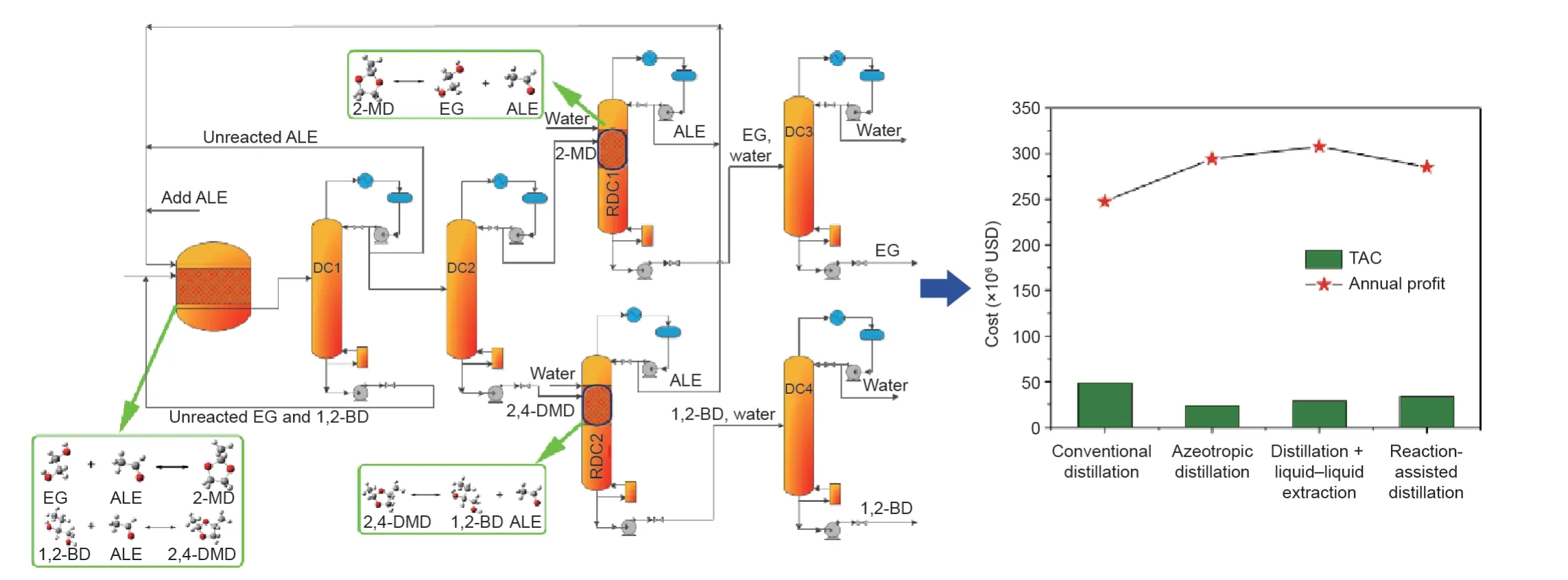
图9.以ALE为循环反应物的CLS法分离EG和1,2-BD混合物的过程。2-MD:2-甲基-1,3-二氧六环;2,4-DMD:2,4-二甲基-1,3-二氧六环。经American Chemical Society许可,转载自参考文献[91],©2018。
Li等[93]研究了分离EG和1,2-BD混合物的反应物选择方法,发现丙醛(PLE)是一个合适的可用于可逆反应分离EG和1,2-BD混合物的反应物。Li等[48]还研究了共沸物中两个组分与PLE反应物之间的反应速率,结果表明,当1,2-BD与EG的摩尔比为1∶2时,几乎所有的1,2-BD都转化为相应的产物,但EG的转化率却不到30%。为了促进工业化,Li等[93]还进行了中试试验和过程分析。由于PLE与1,2-BD的反应速率比EG快的多,因此可以假设1,2-BD完全反应,采用两种概念设计方法来分离1,2-BD和EG混合物。一种是1,2-BD被完全转化,而EG没有转化,即Ⅱ型CLS;另一种是1,2-BD和EG与PLE完全发生反应,即Ⅲ型CLS。以上设计过程分别如图10、11所示,而这两个过程的关键是添加的PLE反应物的量。1,2-BD和EG与PLE反应分别生成2,4-二乙基-1,3-二氧六环(2,4-DED)和2-乙基-1,3-二氧六环(2-ED)。
如图10所示,如果1,2-BD与PLE反应物速率较快,则所有1,2-BD会转化为2,4-DED。由于PLE反应得到2,4-ED的逆反应所施加的限制,EG没有明显发生转化。因此,可以在RDC底部得到EG,并且可以通过2,4-DED的逆反应再生1,2-BD,并将PLE回收循环至RDC进行再利用。在这个过程中,纯的EG和1,2-BD是根据反应速率的差异获得的。
如图11所示,如果反应物的量能同时满足两个组分反应,则EG和1,2-BD可分别与PLE反应转化为2-ED和2,4-DED,2-ED和2,4-DED的逆反应经RDC后,可分别再生得到纯的EG和1,2-BD,再生获得的反应物PLE也可以被重新回收利用。尽管这些基于CLS的概念设计可以生产获得纯的产品,但这些分离过程的经济性需要进一步进行对比,以评估其在工业上的潜力。最近,Wang等[94]从经济角度指出,EG和1,2-BD完全转化为缩醛的工艺过程具有更大的工业发展潜力。
5.结论和展望
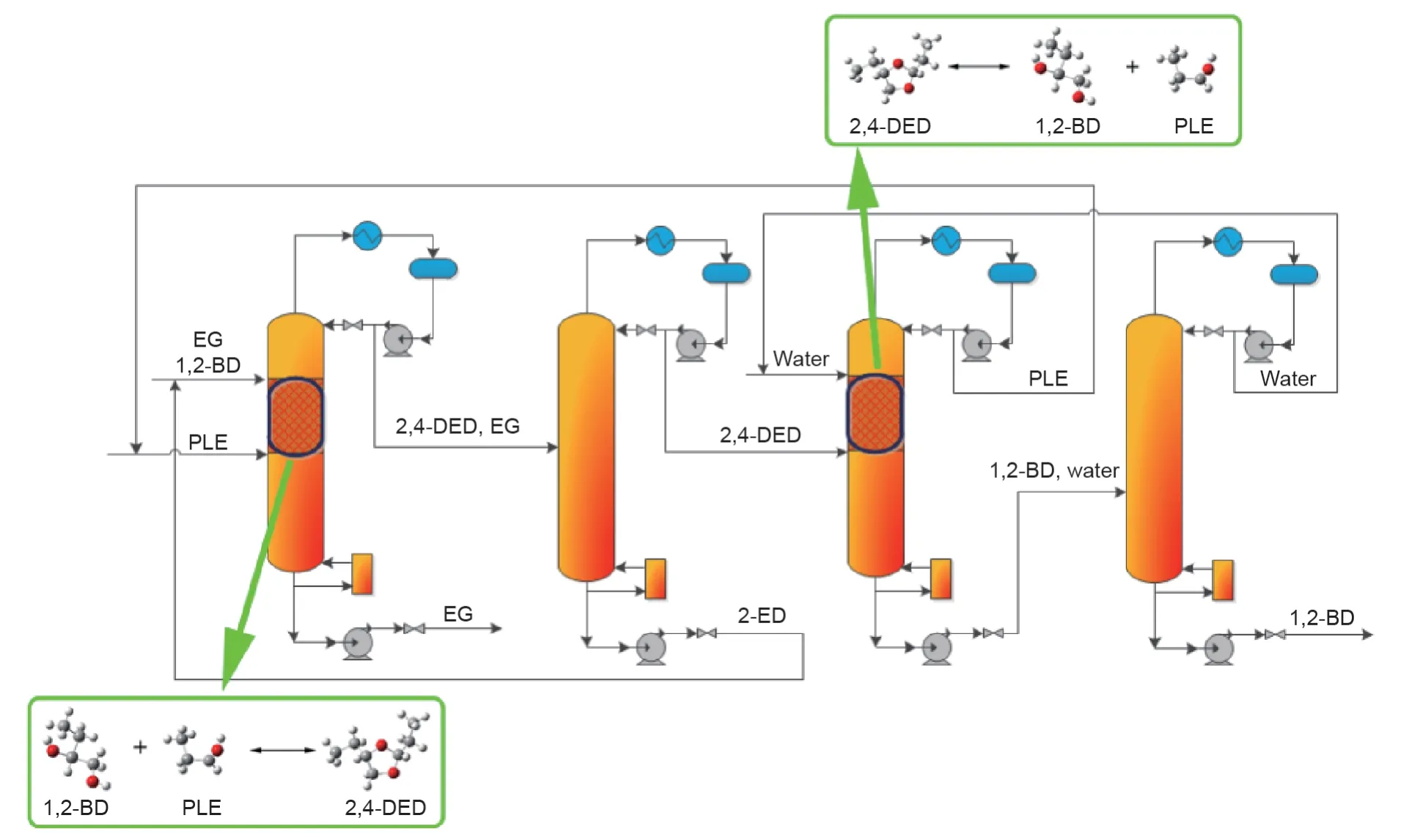
图10.采用PLE作为化学链反应物使得1,2-BD转化而EG不转化的过程。2,4-ED:2,4-二乙基-1,3-二氧六环;2-ED:2-乙基-1,3-二氧六环。
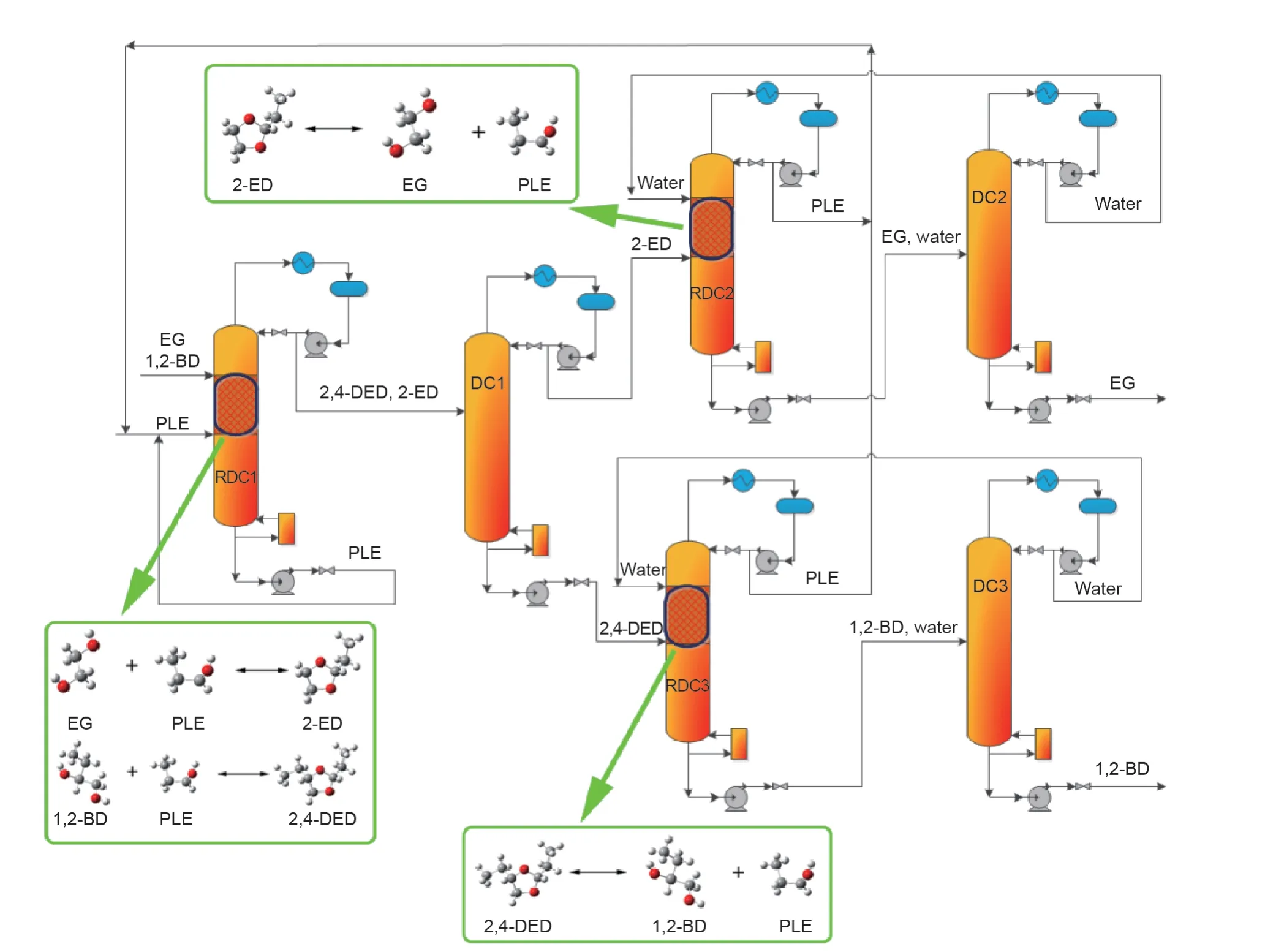
图11.采用PLE作为化学链反应物使得1,2-BD和EG的完全转化的工艺过程。
用传统分离技术分离由性质相似组分组成的共沸物既困难又不经济。本研究提出的CLS法,是一种新兴的、有发展前途的技术,它是基于化学链概念所提出的一种经济高效、可持续的共沸物分离方法。CLS的关键是加入的反应物引起了其与共沸物组分之间的化学反应,从而打破原来的共沸行为。本文系统地总结了CLS法在分离共沸物时反应物的选择原则,以期为后续研究者提供一定的指导。基于实验研究的成功案例揭示了CLS法是可行的,其在化工共沸物的分离纯化方面具有巨大的潜力。这些研究可为基于化工过程强化、资源利用和环境保护提供一种新的共沸物分离方法。
同时,CLS法也可用于药物的纯化,如异构体的分离。CLS方法也可为生产高端化工产品提供一种新的思路。然而,不同的分离方法均有其适用范围。对于CLS法,由于分离复杂度的增加,具有低选择性的反应势必增加工艺成本。在CLS过程的规模化中,如何确保反应的选择性是一个挑战,这需要研究者的进一步研究。因此,没有一种方法是万能的,对于特殊的共沸体系,选择绿色、经济和可持续的分离方法是至关重要的。工程师应具体问题具体分析,并根据体系需要分离的目标,选择和评估适宜的方法。依据共沸物的分离特点,CLS法能够在一定程度上弥补其他分离方法的不足。
致谢
感谢国家重点研究计划项目(2018YFB0604900)和国家自然科学基金项目(21690084、21878219)的资助。
Compliance with ethics guidelines
Xin Gao and Xueli Geng declare that they have no conflict of interest or financial conflicts to disclose.
