快速康复外科对胃癌根治术患者术后恢复的影响
2021-06-03曹艳张玲李娜乔琼显
曹艳,张玲,李娜,乔琼显
南阳市第一人民医院1手术室,2CCU,河南南阳473000
胃癌属于常见的消化系统恶性肿瘤,与遗传、饮食、环境等因素有关,且存在地区差异。临床研究表明,胃癌由慢性胃炎、萎缩性胃炎、肠上皮化生、异性增生逐渐进展而来,治疗以手术切除为主。胃癌根治术术后患者常发生出血、感染、吻合口瘘等并发症,严重影响患者的生理和心理健康,并带来一定的经济负担。为减少患者的创伤、促进患者的术后快速恢复,快速康复外科(enhanced recovery after surgery,ERAS)模式被应用于外科手术领域。ERAS主要目的是优化患者的围手术期治护过程,减少患者的创伤应激,促进康复。临床研究显示,ERAS用于结直肠手术中效果显著,患者的住院时间由原来的8~13天缩短至4~5天。本研究探讨ERAS理念在胃癌根治术患者围手术期中的应用效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2019年6月南阳市第一人民医院收治的胃癌根治术患者。纳入标准:①经影像学及病理学检查确诊为胃癌;②首次行根治术治疗,术前未接受放化疗;③生存期>3个月;④临床资料完整。排除标准:①合并其他恶性肿瘤;②合并心、肝、肾功能不全;③合并全身性系统疾病;④合并凝血功能障碍。依据纳入和排除标准,本研究共纳入90例胃癌患者,依据围手术期干预模式分为对照组(n
=33)和观察组(n
=57),对照组患者围手术期接受常规护理干预,观察组患者围手术期接受ERAS模式干预。对照组中男19例,女14例;年龄38~72岁,平均(46.58±11.27)岁;肿瘤部位:胃体9例,胃窦11例,贲门-胃底13例。观察组中男31例,女26例;年龄35~70岁,平均(46.11±10.36)岁;肿瘤部位:胃体17例,胃窦18例,贲门-胃底22例。两组患者性别、年龄和肿瘤部位比较,差异均无统计学意义(P
﹥0.05),具有可比性。1.2 干预方法
对照组患者围手术期接受常规护理干预,术前6 h禁水、术前12 h禁食、术前1天及手术当天进行灌肠。术中保持手术室温度为25℃,湿度为50%,覆盖薄毯保温,常规放置胃管和引流管。术后采用静脉自控式镇痛泵镇痛,视患者疼痛程度调整药量,首次排气后拔掉胃管,饮食由流食转为半流食、普食,拔出导尿管后适量活动。
观察组患者围手术期接受ERAS模式干预,具体包括以下五个方面:①术前协助患者进行全面检查,根据检查结果评估患者的身体状况,并针对性改善患者的身体机能。②手术前1天与患者及家属详细交谈,向患者介绍疾病相关知识(包括发病原因、治疗方式、手术过程、术后并发症及相应的处理措施等),了解患者的心理情绪并及时进行疏导,对于异常紧张的患者可给予镇定药帮助睡眠。③术前10小时口服10%葡萄糖溶液800 ml,并于术前2小时再次口服400 ml;术前0.5~1.0 h给予抗生素预防感染。④术中,在患者血容量、组织灌注稳定的条件下,尽早进行液体复苏;不常规放置胃管,仅保留1根引流管;术中提供保温毯保暖。⑤术后采用多模式镇痛方案,同时减少阿片类镇痛药的使用;使用缓泻剂、促动力剂促进胃肠道功能恢复;尽早拔出胃管、导尿管,并做好管理;患者清醒后少量饮水,术后1天开始给予少量流食,逐步增量过度至普食;术后1天鼓励下床活动,直至患者进行功能锻炼。
1.3 观察指标和评价标准
①比较两组患者的一般手术指标,包括首次下床时间、首次排气时间、首次进食时间、术后住院时间等。②术后2 h和术后1周,比较两组患者的炎性因子水平,包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-8、IL-10。③术后2 h和术后1周,比较两组患者的免疫功能指标,包括 CD3、CD4、CD8,计算CD4/CD8。④比较两组患者的术后并发症发生情况,包括出血、感染、深静脉血栓、吻合口瘘和肠梗阻。
1.4 统计学方法
2 结果
2.1 一般手术指标的比较
观察组患者首次下床时间、首次排气时间、首次进食时间及术后住院时间均明显短于对照组患者,差异均有统计学意义(P
﹤0.01)。(表1)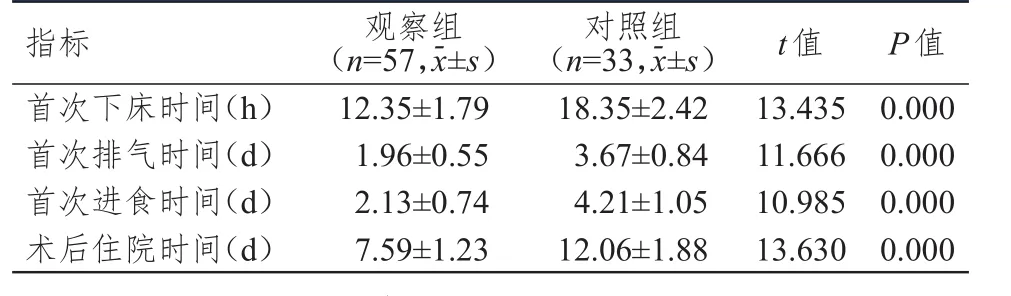
表1 两组患者一般手术指标的比较
2.2 炎性因子的比较
术后 2 h,两组患者TNF-α、IL-1β、IL-8、IL-10水平比较,差异均无统计学意义(P
﹥0.05)。术后1周,两组患者TNF-α、IL-1β、IL-8、IL-10水平均明显低于本组术后2 h,且观察组患者TNF-α、IL-1β、IL-8、IL-10水平均明显低于对照组患者,差异均有统计学意义(P
﹤0.01)。(表2)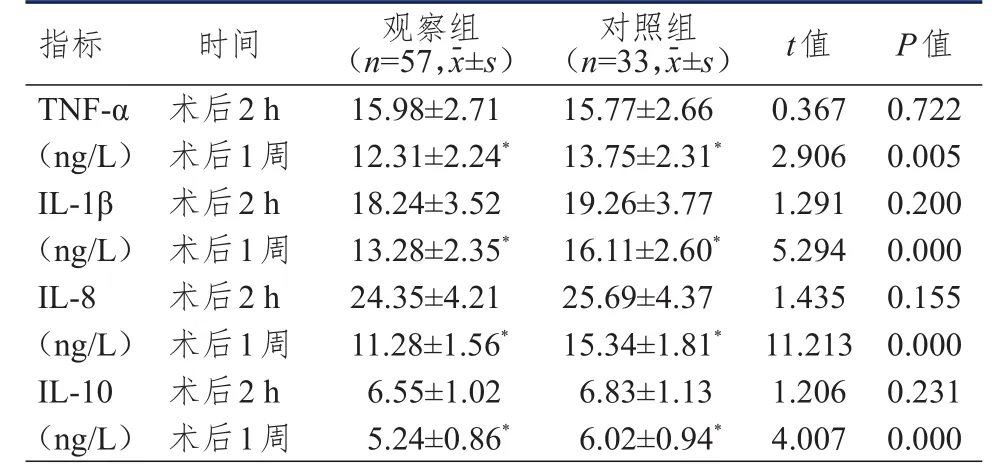
表2 两组患者术后不同时间炎性因子水平的比较
2.3 免疫功能指标的比较
术后 2 h,两组患者 CD3、CD4、CD8水平及CD4/CD8比较,差异均无统计学意义(P
﹥0.05)。术后1周,两组患者CD3、CD4水平和CD4/CD8均高于本组术后2 h,观察组患者CD8水平低于本组术后2 h,且观察组患者CD3、CD4水平和CD4/CD8均高于对照组患者,CD8水平低于对照组患者,差异均有统计学意义(P
﹤0.05)。(表3)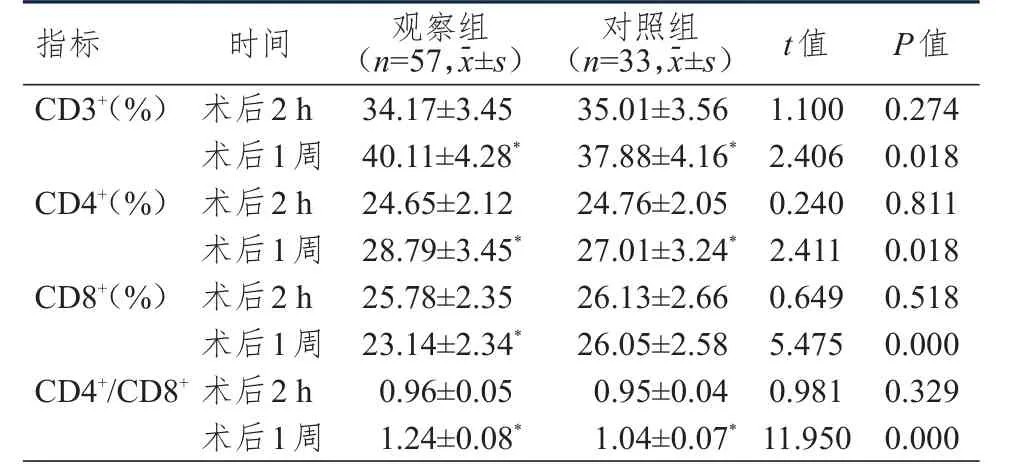
表3 两组患者术后不同时间免疫功能指标的比较
2.4 并发症发生情况的比较
观察组患者的术后并发症总发生率为5.26%(3/57),低于对照组患者的18.18%(6/33),差异有统计学意义(χ
=3.876,P
﹤0.05)。(表4)
表4 两组患者的术后并发症发生情况[ n(%)]
3 讨论
ERAS是于1997年由Kehlet首次提出,并于2007年引入中国,此后被应用于临床多个领域。ERAS模式是在循证医学的基础上对传统管理方法进行优化,以减少应激反应,达到快速康复的目的。本研究结果显示,观察组患者首次下床时间、首次排气时间、首次进食时间及术后住院时间均明显短于对照组,表明ERAS模式能促进患者的功能恢复。既往研究表明,术前与患者进行沟通交流和知识宣教,不仅能够增加患者对医护人员的信任,还能使患者在手术过程中保持良好的心态、积极配合治疗。临床研究显示,术前12 h禁食、术前6 h禁水,不仅不会减少术后并发症的发生风险,还会增加胰岛素抵抗和不适感,术前适当补充液体葡萄糖可提高患者耐受性。针对围手术期的液体治疗,可避免器官功能损伤,减少组织损伤和心脏负荷,同时还能增加循环血容量和组织供氧,因此,可达到快速康复的目的。本研究结果显示,观察组患者的术后并发症总发生率为5.26%,低于对照组患者的18.18%,差异有统计学意义(P
﹤0.05)。出血、吻合口瘘、肠梗阻等均是胃癌患者术后的常见并发症,围手术期营养支持,胃管、导尿管和胃肠道功能管理均可减少并发症的风险;长期卧床的患者易发生深静脉血栓,通过优质管理让患者尽早下床活动,有助于降低DVT发生率。本研究结果显示,术后1周,观察组患者TNF-α、IL-1β、IL-8、IL-10水平均明显低于对照组患者,表明ERAS模式干预可降低胃癌患者围手术期的炎性反应发生率。IL-1β是由位于2号染色体的IL-1B
基因编码,与肿瘤新生血管生成和胃酸分泌有关,而胃酸分泌可能与萎缩性胃炎的发生有关。TNF-α是常见的促炎因子,通过激活NF-κB通路产生炎性反应,已证实其与肿瘤细胞的增殖、分化有关。IL-8主要由单核巨噬细胞、淋巴样细胞分泌,通过激活中性粒细胞,诱导释放溶酶体,从而激活T淋巴细胞,加强机体免疫功能。研究显示,IL-8在胃癌患者的胃黏膜组织中高表达。IL-10通过抑制辅助性T细胞1和B淋巴细胞在炎性反应中发挥免疫抑制作用,且临床研究已证实,IL-10的表达与胃癌进展有关,可联合其他炎性因子评估治疗效果和预后。魏雪莲探讨腹腔镜辅助胃癌根治术对胃癌患者炎性因子的影响,结果发现,观察组患者C反应蛋白、IL-6、IL-8水平均明显低于对照组,表明优化手术过程可达到降低炎性反应的作用。T淋巴细胞在慢性胃炎的发生发展中发挥重要作用,CD3可直接反映机体的免疫功能;CD4通过刺激其他免疫细胞产生免疫应答;CD8可直接作用于靶细胞,杀伤作用强,同时还参与免疫抑制过程;CD4/CD8可直接反映机体的免疫功能。研究显示,胃癌患者外周血CD3、CD4水平及CD4/CD8均明显低于健康者,且与胃癌临床分期呈负相关。本研究结果显示,术后1周观察组患者外周血CD3、CD4水平及CD4/CD8均高于对照组,CD8水平低于对照组,表明ERAS模式可改善患者的免疫功能。
综上所述,ERAS模式干预可降低胃癌根治术患者围手术期的应激反应、降低炎性因子水平,增强免疫功能,从而促进患者康复。
