来源于Bacillus sp.AR9 D-海因酶半理性设计的研究
2021-06-02樊帅刘坤金媛媛杨兆勇
樊帅, 刘坤, 金媛媛, 杨兆勇
中国医学科学院医药生物技术研究所, 北京 100050
D-对羟基苯甘氨酸是一种重要的精细化工品,广泛应用于药学领域。β-内酰胺类抗生素类药物(如阿莫西林、头孢拉定和头孢立新等)的侧链化合物、肽激素和拟除虫菊酯的合成都需要D-对羟基苯甘氨酸[1],并可以用作磷和硅的分析试剂。目前D-对羟基苯甘氨酸采用酶法制备,即由D-海因酶和D-氨甲酰水解酶偶联酶法制备D-对羟基苯甘氨酸[2](图1),该方法具有环境友好、底物转化率高、产物光学活性单一和反应条件温和等特点。D-海因酶(D-hydantoinase,EC 3.5.2.2,HYD)作为酶法制备D-对羟基苯甘氨酸的关键酶,广泛存在于细菌、真菌和植物中。HYD能特异性地将D-单替代海因水解为N-氨甲酰基-D-氨基酸,而L-单替代海因在碱性条件下消旋转化为D-单替代海因,进而使得HYD能够将D,L-单替代海因 100 %转化为光学纯的N-氨甲酰-D-氨基酸。
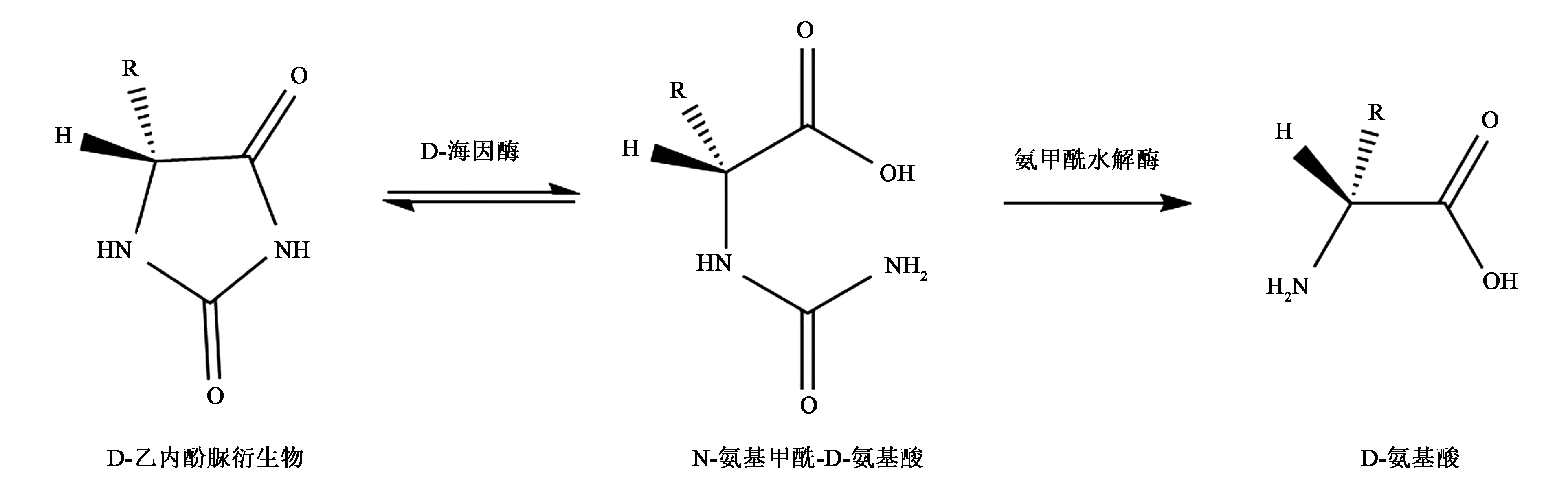
图1 D-海因酶和氨甲酰基水解酶催化过程
D-海因酶主要来源于微生物,如Burkholderiapickettii[3]、Bacillusstearothermophilus[4]、Pseudomonasfluorescens[5]和Pseudomonasputida[6]等,不同来源的HYD最适反应温度一般为30~60 ℃,耐热性较差,限制了其在工业酶法制备D-对羟基苯甘氨酸中的应用。现阶段,针对D-海因酶活性和耐热性较差的缺点,不同研究者利用不同方法对D-海因酶进行改造。Chern 等[7]对源于BacilluscirculansHYD的C-末端连入几丁质结合结构域,利用几丁质固定化重组HYD,将其45 ℃ 的半衰期延长至270 h;Kim等[8]构建了D-海因酶和D-氨甲酰水解酶的融合酶,并利用定向进化筛选获得活性提高的突变体;Aganyants 等[2]通过对底物结合的关键氨基酸Phe159和Trp287突变,改变了来源于BacillusstearothermophilusHYD的底物特异性。
来自Bacillussp.AR9的HYD[9]热稳定性突出,最适反应温度为65 ℃,在70 ℃下的半衰期为80 min,且最适pH为9.0,能够满足海因酶法生产D-对羟基苯甘氨酸的需要,具有工业化生产D-对羟基苯甘氨酸的应用潜力。为了解决D-海因酶的工业化应用中存在活性较低和稳定性较差的问题,从而获得高催化活性和高稳定性的D-海因酶,本研究通过研究来源于Bacillussp.AR9的D-海因酶空间结构,分析其底物通道,对底物通道瓶颈的关键氨基酸进行点饱和突变,结合高通量筛选方法,最终获得活性提高的突变体,为该酶应用于工业化生产提供了理论基础。
1 材料与方法
1.1 菌株、质粒及试剂
表达HYD蛋白的hyd基因(PDB登录号:4KIR)由华大基因公司合成,并对其密码子优化使其适于大肠杆菌表达。表达菌株BL21(DE3)购自Novagen,表达质粒pET-21a(+)购自Novagen,对羟基苯海因购自Sigma,其余试剂均为国产分析纯。
1.2 突变文库的构建与筛选
采用Mut Express II Fast Mutagenesis Kit V2(诺维赞)试剂盒进行点饱和突变文库的构建,点饱和突变引物如表1所示。每个位点随机挑取190个转化子进行筛选,具体步骤如下:将转化子接种到每孔含200 μL LB液体培养基(含100 μg·mL-1的氨苄西林,Amp)的96孔细胞培养板中,于37 ℃条件下200 r·min-1摇床培养,当OD600达到1.0,向每个孔中加入IPTG(终浓度0.2 mmol·L-1),在18 ℃下诱导12 h。将培养物添加溶菌酶处理(终浓度 1 mg·mL-1)30 min并反复冻融2次(-80 ℃,15 min;37 ℃,15 min),然后在4 000 r·min-1下离心10 min去除沉淀,将上清转移到另一块96孔板中,添加1%(质量体积分数)对羟基苯海因在37℃反应30 min,最终加入等体积的 10%对二甲氨基苯甲醛(溶于6 mol·L-1盐酸)进行显色反应,在430 nm下测定吸光度,数值越高代表活性越高。
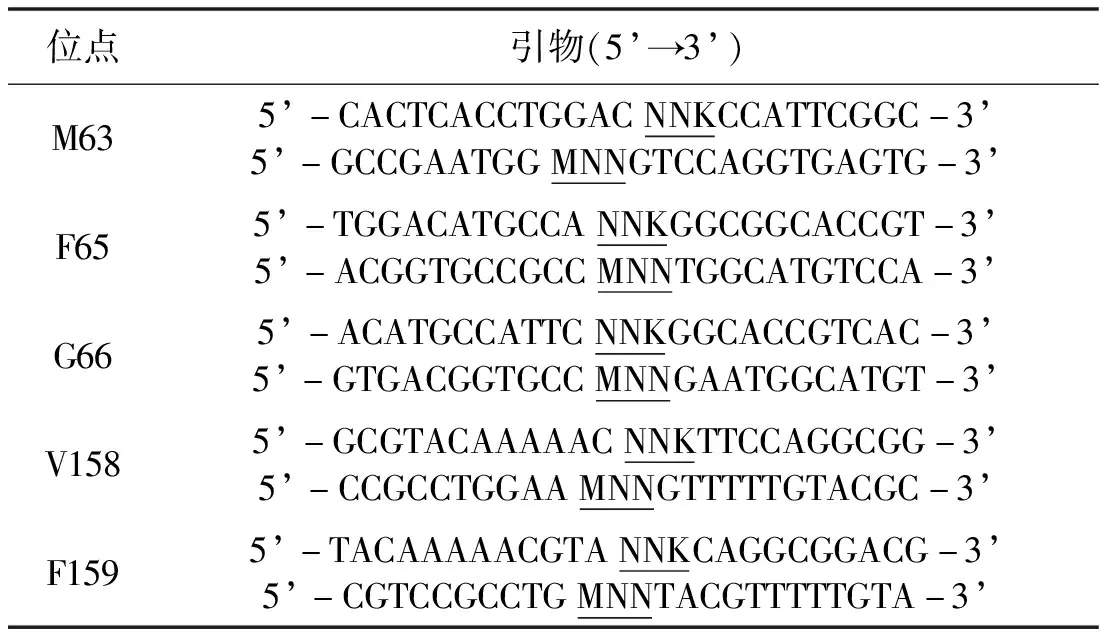
表1 饱和突变引物
1.3 HYD和突变体的表达与纯化
将HYD和突变体的表达菌株接种在LB培养基(Amp终浓度为100 μg·mL-1),37 ℃,200 r·min-1培养到OD600值为0.6~0.8,然后加入终浓度为0.2 mmol·L-1IPTG,18 ℃,200 r·min-1诱导过夜。将诱导后的培养物4 000 r·min-1,4 ℃离心10 min,收集菌体用Lysis buffer(20 mmol·L-1磷酸缓冲液,500 mmol·L-1NaCl,10 mmol·L-1咪唑,pH 7.4)重悬,经高压均质机破碎后,18 000 r·min-1,4 ℃离心30 min,收集上清。pET-21a(+)带有His6标签,因此选用Ni-NTA Agarose(Qiagen)来进行第一步纯化,纯化过程如下:将破碎上清用0.45 μm滤膜过滤,然后注入经Lysis buffer平衡的亲合层析住,并将滤出液重复上样一次;随后用Washing buffer(20 mmol·L-1磷酸缓冲液,500 mmol·L-1NaCl,20 mmol·L-1咪唑,pH 7.4)5倍柱体积冲洗,最后用Elution buffer(20 mmol·L-1磷酸缓冲液,500 mmol·L-1NaCl,500 mmol·L-1咪唑,pH 7.4)洗脱目的蛋白。随后将洗脱的蛋白在30 K超滤浓缩管(Millipore)进行脱盐浓缩,经SDS-PAGE检测后,选取有单一目的条带的蛋白超滤浓缩后以备后续实验使用。
1.4 酶活性的测定
D-海因酶反应体系如下:5 mmol·L-1对羟基苯海因,20 mmol·L-1Tris(pH 8.0),100 mmol·L-1NaCl,5 mmol·L-1ZnCl2,反应时间10 min,反应结束用10%三氟乙酸终止反应,上清液经0.22 μm滤膜过滤后利用高效液相色谱仪(Agilent technologies 1200 series, USA)进行测定反应产物D-对羟基苯甘氨酸的含量。所用色谱柱为:Hypersil GOLD C8(250 mm × 4.6 mm)色谱柱;流动相为水∶甲醇∶三氟乙酸=95∶5∶0.01(体积比),流速1 mL·min-1,进样量10 μL,柱温30 ℃;紫外检测器,检测波长267 nm。酶活力定义:1 min内催化底物生成1 μmol N-氨甲酰氨基酸所需的酶量为一个活力单位(U)。
1.5 酶学性质和动力学的测定
1.5.1最适反应温度的测定将D-海因酶在不同温度(40、50、60、65、70和80 ℃),pH 8.0的条件下测定酶活性,将最高活力定为100%。
1.5.2最适反应pH的测定在不同pH(6.0、7.0、8.0、9.0、10.0和11.0),50 ℃下测定D-海因酶的活性,将最高活力定为100%。
1.5.3米氏常数Km的测定不同浓度对羟基苯海因(0.2、0.5、1.0、3.0、7.0、10.0和30 mmol·L-1),20 mmol·L-1Tris(pH 8.0)、100 mmol·L-1NaCl、5 mmol·L-1ZnCl2为底物,分别加入适量的D-海因酶,50 ℃,反应10 min,测定D-海因酶在不同底物浓度反应体系中的活性,通过软件GraphPad Prism v5.0(GraphPad Software, San Diego, CA, USA)中Michaelis-Menten方程以计算酶反应的Vmax和Km。
1.5.4催化常数kcat值的测定已知酶浓度,根据测得的Vmax值以及公式1-1计算kcat值。
Vmax=kcat[E]
(1)
式中,[E]代表酶的浓度。
2 结果与分析
2.1 HYD定点饱和突变
来源于Bacillussp.AR9的HYD晶体结构已被报道[9],利用Caver软件(http://www.caver.cz/)对HYD底物通道进行模拟分析,结果如图2所示,通道长度10.0 Å,主要由M63、P64、P65、F92、L94、F152、Y155、V158、F159、V238、S288、P289、C317、F319和I335组成,瓶颈氨基酸残基为M63、F65、G66、V158和F159。由于组成底物通道的部分氨基酸保守且与底物有潜在的相互作用,改变这部分氨基酸不利于反应的进行,而底物通道瓶颈处的氨基酸的改变可能有利于催化的发生,故针对底物通道瓶颈氨基酸构建点饱和突变文库,配合96孔板筛选,获得了活性提高的突变体。
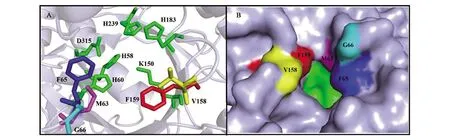
A:HYD催化氨基酸和底物通道瓶颈氨基酸;B:HYD蛋白表面结构。粉色:Met63;蓝色:Phe65;浅蓝色:Gly66;黄色:Val158;红色:Phe159;绿色:催化氨基酸残基(His58,His60,Lys150,His183,His239和Asp315)
在本研究中,对M63、F65、G66、V158和F159 5个位点作为突变位点,通过兼并引物在对应位点上引入突变,从而构建单位点的饱和突变文库。HYD催化产物N-氨甲酰氨基酸可以与显色剂对二甲氨基苯甲醛在酸性条件下反应生成黄色物质,由此可通过96孔板来筛选高活性的HYD突变体,最终通过对M63、F65、G66、V158和F159 5个位点的筛选和测序确定活性提高的突变体如图3所示,与野生型HYD(来源于Bacillussp.AR9)相比,突变体表现出更好的活性,其中突变体F159S、F159A和F65V的活性相较于野生型HYD分别提高了51%、40%和17%。
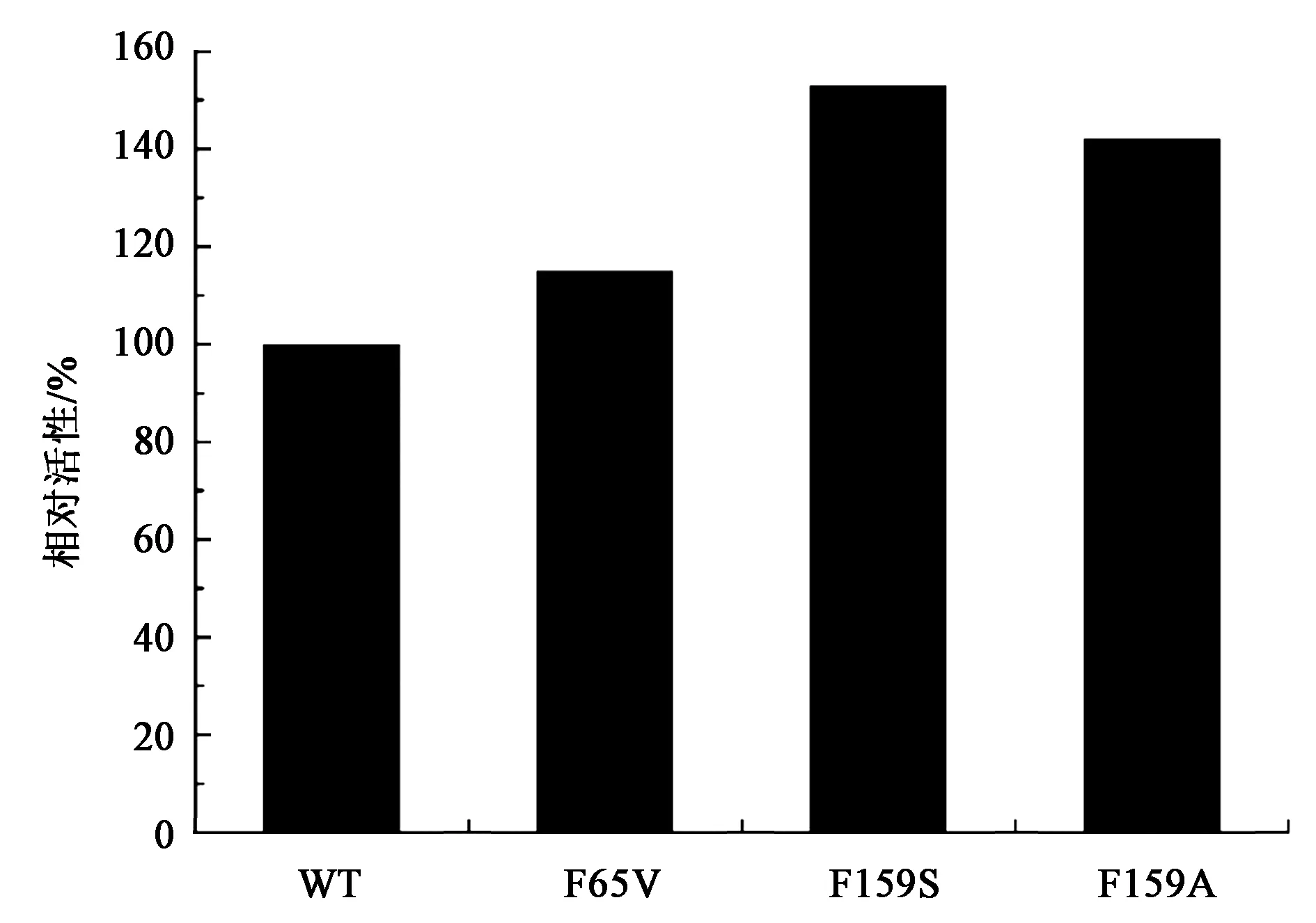
图3 点饱和文库筛选结果
2.2 HYD及其突变体的表达与纯化
为了进一步研究HYD及其突变体的酶学性质,以F159S为基础通过定点突变构建了双位点突变体F65V/F159S,对野生型HYD、F65V、F159S和F65V/F159S进行了镍柱纯化,纯化结果如图4所示。目的蛋白大小位于50 kD位置处,与预期相符,并且目的蛋白纯度在90%以上。
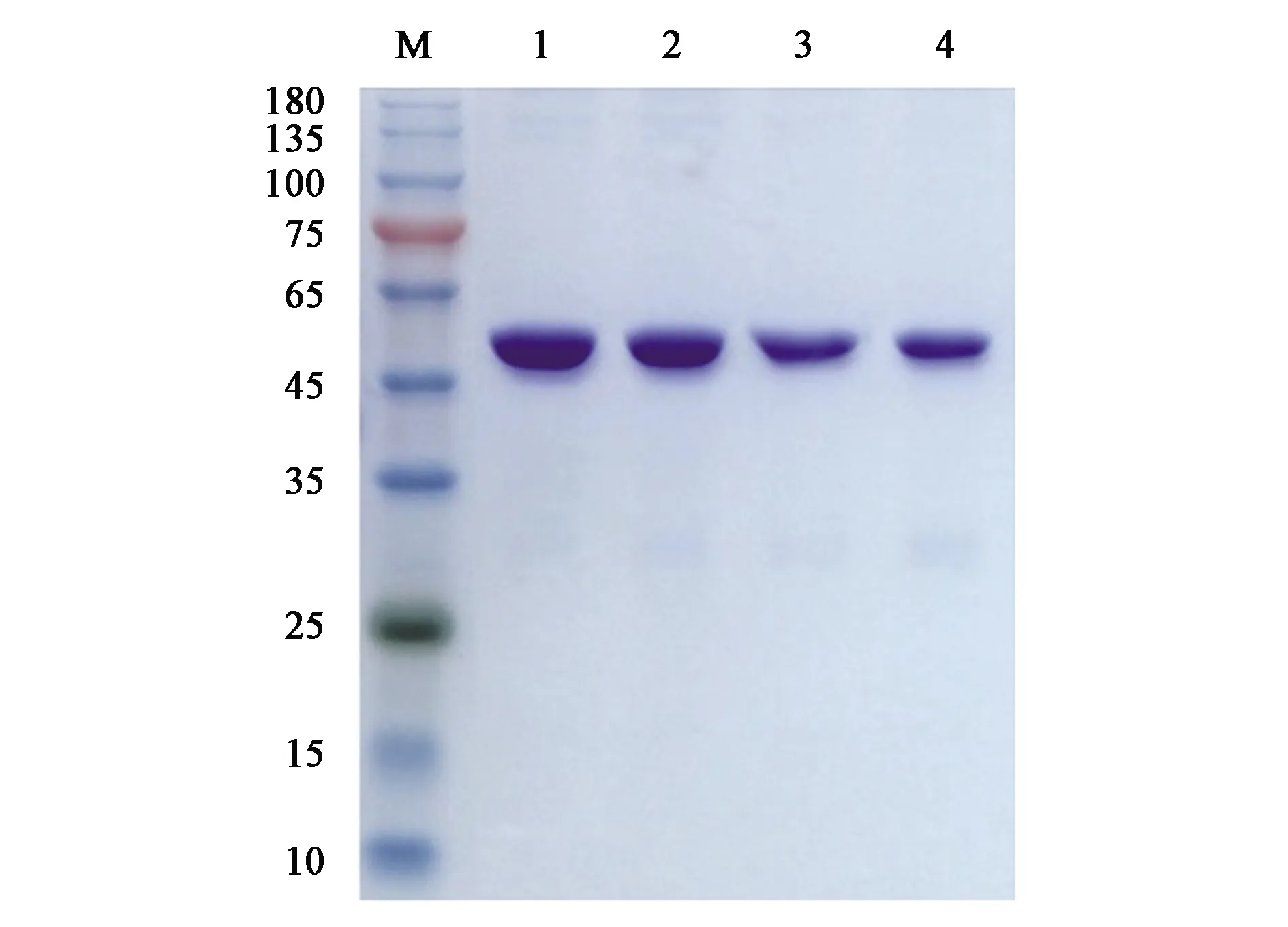
M:Marker;1:HYD(WT);2:F65V;3:F159S;4:F65V/F159S
2.3 HYD及其突变体的酶学性质研究
对HYD及其突变体的酶学性质进行了检测,结果如图5所示,野生型HYD的最适温度为65 ℃,最适pH为9.0,突变体与野生型HYD相比,没有明显的变化。
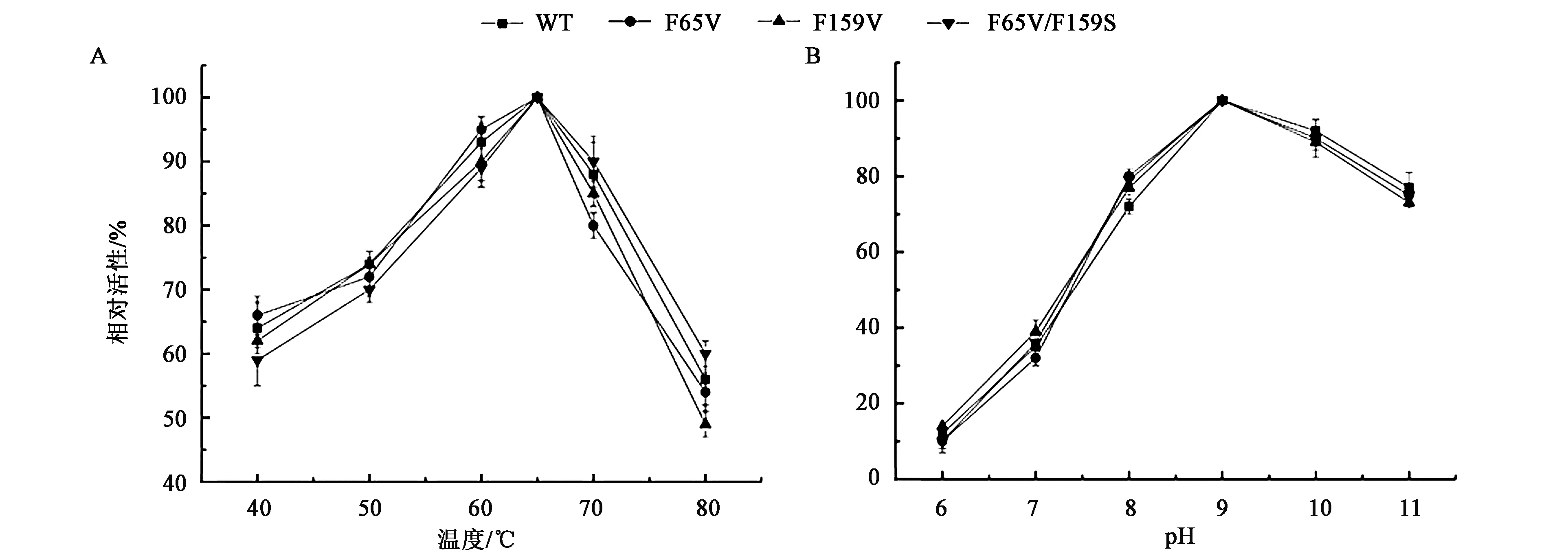
A:温度对酶活性的影响;B:pH对酶活性的影响
2.4 HYD及其突变体的酶学性质研究
以对羟基苯海因为底物,对野生型HYD及其突变体的酶动力学进行了研究,结果如表2显示,野生型HYD的Km为7.5 mmol·L-1,kcat为23 s-1,而突变体与野生HYD型相比,Km未有较大的变化,表明突变体与野生型HYD对底物的亲和力近似。对于kcat值,F65V、F159S和F65V/F159S是野生型HYD的1.3、1.9和2.0倍,最终双位点突变F65V/F159S的催化效率kcat/Km是野生型HYD的2.4倍。

表2 HYD(WT)及突变体催化动力学常数
2.5 HYD和突变体F65V/F159S结构分析
以HYD的晶体结构为模型,对突变体F65V/F159S三维结构建模,并对两者的底物通道进行分析,结果如图6所示,在野生型HYD中,F65与F159位于底物通道的两侧,由于苯丙氨酸较大的侧链限制了底物通道出口的大小,F65与F159之间的最小距离为7.5 Å,而突变体F65V/F159S中,突变后V65和S159同样位于底物通道出口处,且V65和S159之间的最小距离为11.8 Å,由此可知突变体F65V/F159S通过在两个位置上引入侧链体积更小的氨基酸,扩大了底物通道瓶颈处的距离。

A:HYD底物通道;B:突变体F65V/F159S底物通道
3 讨论
酶法制备D-氨基酸,由于其经济性、高效性和环保性而被广泛用于光学纯D-氨基酸的合成,目前酶法制备的D-氨基酸年产量可达几千吨[10-11],市场前景广阔。D-海因酶和D-氨甲酰水解酶偶联酶催化合成D-氨基酸工艺已有报道。D-海因酶的主要底物为D-苯甘氨酸[12]和D-对羟基苯甘氨酸[13-14],也可用于生产D-缬氨酸、D-丙氨酸和D-色氨酸等其他D-氨基酸[15-17]。现阶段D-海因酶作为一种具有工业应用价值的生物酶催化剂,可极大加速化学反应且还拥有高度的区域和立体选择性,但该酶对温度的耐受性不高且仍需提高反应速度。通过人工模拟自然进化的过程,可加速D-海因酶的进化过程,但由于定向进化需要筛选大量突变体且有效阳性突变率非常低,近十年科学家发展了多种方法来设计库容小但质量高的突变体文库,从而简化筛选的过程。应用Caver软件[18]分析底物通道,找出底物进出口的瓶颈氨基酸作为目标氨基酸,然后进行定点突变,这种策略可减少突变体文库的数量并提高筛选效率。该方法被广泛应用于多种酶活性、稳定性提高和选择性改造[19-21]。本文通过对来源于Bacillussp.AR9的D-海因酶HYD底物通道的分析,找到底物通道瓶颈处的5个氨基酸(M63、F65、G66、V158和F159),对这5个位置的氨基酸应用饱和突变构建单点饱和突变文库,辅以96孔板筛选手段筛选高活性突变体,并对活性较高的突变体进行了组合,最终双位点突变体F65V/F159S的催化效率是野生型HYD的2.4倍。分析野生型HYD和突变体F65V/F159S底物通道,在野生型HYD中,F65与F159之间的最小距离为7.5 Å,而突变体F65V/F159S中V65和S159之间的最小距离为11.8 Å,突变体F65V/F159S通过在两个位置上引入侧链体积更小的氨基酸,扩大了底物通道瓶颈处的距离,加快了底物进出的速度,这与突变体kcat数值的提高相符,由此可以看出通过Caver找寻底物通道瓶颈处的氨基酸,设计饱和突变文库筛选高活性的突变体是一个成功的策略,可在海因酶家族乃至整个酶进化中应用。
