优化CD115稳定性因素以精确检测小鼠单核细胞及其亚群
2021-06-02刘怡宁宋濬哲蒋晓陈超周圆邢文
刘怡宁, 宋濬哲, 蒋晓, 陈超, 周圆, 邢文
中国医学科学院血液病医院(中国医学科学院血液学研究所),北京协和医学院,实验血液学国家重点实验室,国家血液系统疾病临床医学研究中心,天津 300020
单核细胞(monocyte)在抵御病原微生物入侵和免疫调节等方面发挥重要作用[1]。研究发现,在伤口愈合以及肝脏、肺脏、肾脏等组织器官纤维化过程中,单核细胞及其分化而来的巨噬细胞或纤维细胞发挥关键作用[2-5];其在骨髓纤维化过程中的作用也屡有报道[6-8]。此外,在血液系统疾病如真性红细胞增多症中,除了红细胞和血小板明显增多外,单核细胞增多也时有发生[9]。因此,利用新方法或新技术对单核细胞进行深入研究,不仅可以进一步揭示其在基础免疫和微生物学中的作用,也可进一步阐明其在某些疾病发生和转归中的作用。
流式细胞术(flow cytometry, FCM)是当代最先进的细胞定量分析技术之一。通过荧光标记的特异性抗体与抗原结合,可快速测定单个细胞的生物学特性,并从群体中分类和收集特定细胞,因此,FCM在细胞生物学、血液学、免疫学等研究中应用广泛[10]。小鼠是研究人类疾病的重要模式动物,但是小鼠与人单核细胞特异性标志并不完全相同。人单核细胞主要根据CD14和CD16的表达情况进行分类;而小鼠单核细胞则主要是CD11b和CD115双阳性细胞[11]。CD115是集落刺激因子1[colony-stimulating factor-1,CSF-1;又称巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)]受体,主要表达在单核/巨噬细胞和部分树突状细胞及其前体细胞表面。M-CSF作用于CD115,在巨噬细胞的产生、分化和发挥功能等方面具有重要作用[12]。然而,在标本处理过程中,CD115常因各种原因丢失或内化[11,13],进而影响检测的准确性[14]。
为了提高小鼠单核细胞特异性抗原CD115的稳定性,确保流式检测小鼠单核细胞及其亚群比例的准确,首先对温度、时间和固定因素对CD115的稳定性影响进行了详细研究。由于小鼠外周血比较容易获取,且无需处死小鼠,所以以此进行优化实验。在此优化方法基础上,通过结合流式抗体CD11c、CD49b、Ly6G、Ter119、CD3e和 B220等去除小鼠骨髓及外周血中树突状细胞、NK细胞、粒细胞、不成熟的红细胞、T和B等细胞[15-18],并使用Ly6C对单核细胞不同亚群进行区分,以期更加精准地分析小鼠单核细胞及其亚群,了解其比例随疾病发生、发展的动态变化。
1 材料与方法
1.1 实验动物
SPF级别C57BL6小鼠,2月龄,性别不限,均来自中国医学科学院血液病医院(中国医学科学院血液学研究所)实验动物中心。动物实验经本单位伦理委员会审查批准。
1.2 主要试剂
胎牛血清(fetal bovine serum,FBS;以色列Biological Industries公司);磷酸盐缓冲液(phosphate buffered saline,PBS;北京索莱宝科技有限公司);ACK红细胞裂解液(北京索莱宝科技有限公司);PBE[含2 μmol·L-1乙二胺四乙酸(ethylenediaminetetraethylene acid,EDTA;赛默飞世尔科技(中国)有限公司)的PBS];FPBE[含2% FBS(以色列Biological Industries公司)的PBE)];4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI,美国Sigma公司);流式抗体(均为大鼠来源的抗小鼠抗体,美国eBioscience公司)包括:CD11b-FITC、CD115-APC、Ly6C-PerCP以及APC e-Fluor780标记的Lineage(Lin)抗体:CD11c、CD49b、Ly6G、Ter119、CD3e和B220。
1.3 主要仪器及器材
流式细胞仪 BD FACS Canto Ⅱ(美国Becton Dickinson公司);小型低温离心机(美国Eppendorf公司);血细胞计数板(美国Drew Scientific公司)。
1.4 小鼠外周血单细胞悬液的制备
固定小鼠,用毛细吸管取尾静脉血30 μL,置于1 mL PBE中,混匀。1 500 r·min-1,4 ℃离心5 min,弃上清。向细胞沉淀中加入3 mL ACK红细胞裂解液并再次混匀,冰上裂解8 min。再次离心,细胞沉淀用3 mL PBS 洗涤,最后用100目的尼龙膜过滤除去细胞团块。
1.5 温度、放置时间和固定等因素对CD115稳定性的影响
1.5.1温度和放置时间对CD115与抗体结合前稳定性的影响 取小鼠外周血,分12份至EP管中(冰上放置)。取2份立即制备单细胞悬液(方法见1.4),其中1份作为阴性对照;另1份加入CD11b和CD115抗体,检测其双阳性细胞比例,作为本次实验的初始值。将剩余10份外周血,继续分为冰上和室温2组,分别放置0.25、0.5、1、2和6 h后,制备单细胞悬液;离心,弃上清,先加50 μL FPBE至各管中,混匀;再加入CD11b和CD115抗体各1 μL。混匀后,4 ℃孵育30 min。单阳管中只加1种抗体;阴性对照管则不加任何抗体。上机检测前用PBS洗涤,离心弃上清。最后加入400 μL PBE重悬细胞,并加入1 mg·mL-1的DAPI,用以标记死细胞。上述过程均应控制温度,全程冰上操作。
流式检测时,使用阴性管和单阳管调节各荧光通道的电压和补偿后,先通过前向角和侧向角圈出有核细胞群、去除黏连细胞;接着圈出DAPI阴性的活细胞群和Lin阴性细胞群;检测CD11b和CD115双阳性细胞比例变化。
1.5.2温度和放置时间对CD115与抗体结合后稳定性的影响 取小鼠尾静脉血5份,制备单细胞悬液(冰上放置,方法见1.4)。1份作为阴性对照;其余4份加入CD11b和CD115抗体进行标记。然后取1份,立即检测其双阳性细胞比例,作为本次实验的初始值;剩余3份样本分别在冰上、室温和37 ℃(模拟细胞培养环境),继续放置0.5、1、2、4和6 h后,检测其双阳性细胞比例变化(方法见1.5.1)。
1.5.3PFA固定对CD115稳定性的影响 在室温和冰上放置2组实验中,每组各取1份小鼠外周血单细胞悬液,加入1%的PFA进行固定放置不同时间后,检测其双阳性细胞比例的变化(方法见1.5.1)。
1.6 优化条件下,小鼠流式抗体标记方法及单核细胞分析
首先制备小鼠骨髓及外周血单细胞悬液。骨髓单细胞悬液制备方法如下:将小鼠脱颈、处死,放在75%酒精中,浸泡5 min。在无菌条件下分离股骨和胫骨,剪去骨两端。用5 mL FPBE冲出骨髓,然后用注射器反复吹吸,将骨髓小粒打散。最后用100目尼龙膜过滤除去细胞团块。外周血单细胞悬液制备方法详见1.4。
取3×106个骨髓细胞,置于1.5 mL EP管中;外周血单细胞则根据实验目的将细胞平均分配至相应数量的EP管中。加入Lin抗体各0.5 μL,CD11b、CD115和Ly6C抗体各1 μL。抗体标记及洗抗等操作方法见1.5.1。
流式检测方法与1.5.1所述方法基本相同,不过需从DAPI阴性的活细胞群中圈出Lin阴性细胞群后,再得到CD11b和CD115双阳性单核细胞群;最后根据Ly6C的表达情况继续将单核细胞分为不同亚群。
1.7 统计分析
流式数据使用FlowjoV10软件进行分析;流式分析结果使用GraphPad Prism 7.0进行统计。
2 结果与分析
2.1 温度和放置时间对CD115与抗体结合前稳定性的影响
获取小鼠外周血这一过程时常在室温条件下进行,标本存放温度和时间也各不相同。Breslin等[14]发现,小鼠外周血在4~8 ℃储存时,CD115稳定性可保持4 h,而在室温条件下,4 h后即明显下降。结果表明,当小鼠外周血样本在冰上放置6 h,其CD11b和CD115双阳性细胞的比例,仅从初始值的1.75%下降到1.63%,仍维持在93%以上;若放置时间延长至8 h,双阳性细胞比例仅维持在初始值的84%(图1)。而在室温条件下,其稳定性仅仅维持0.5 h;在1 h后即大幅下降,仅剩初始值的57%。这说明,在应用流式检测小鼠单核细胞时,必须将样本在低温或冰上储存,上机检测时间不超过6 h;而在室温中超过0.5 h的样本,其检测结果可能偏低。
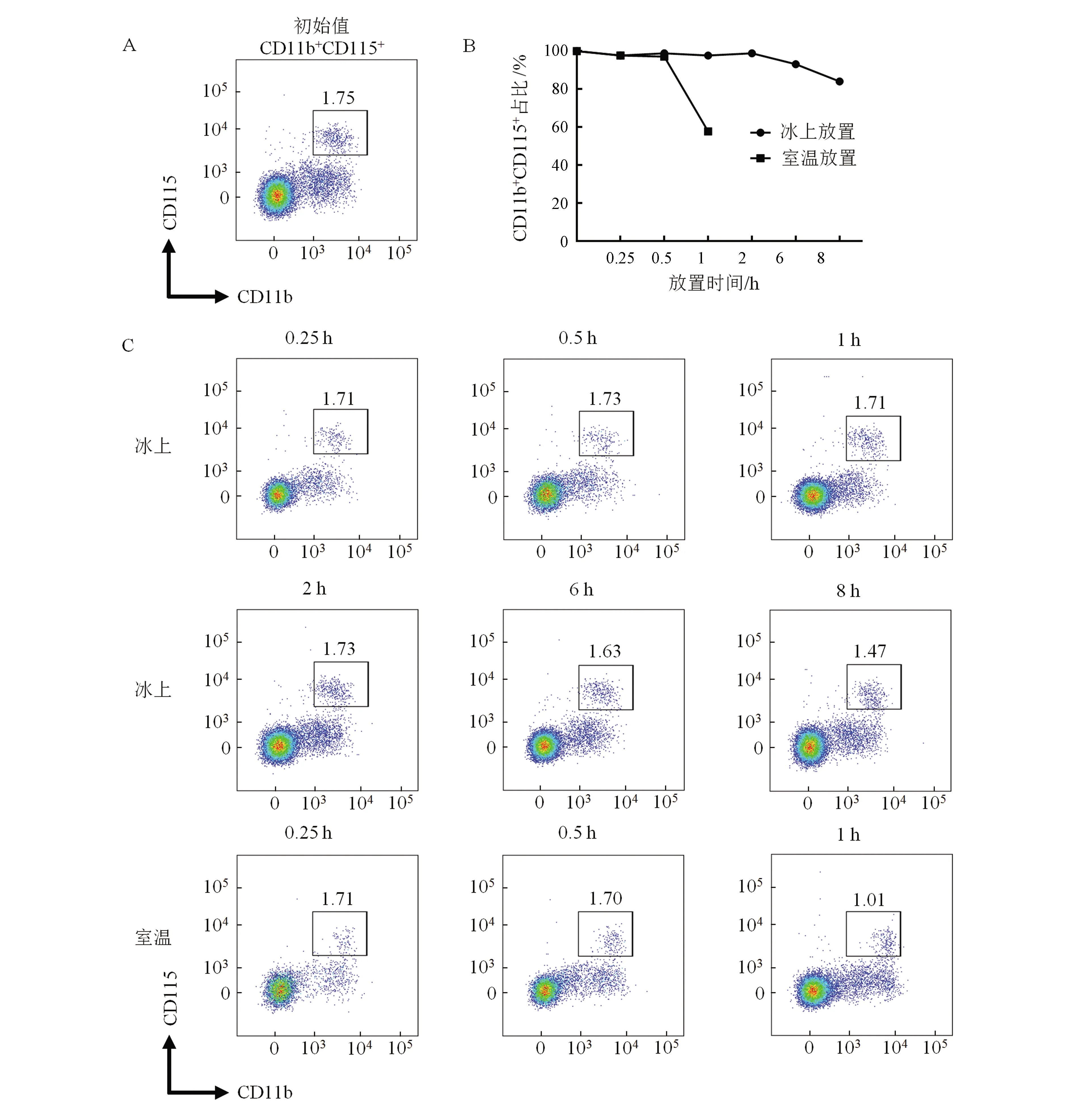
A:本次实验中,小鼠外周血中CD11b+CD115+所占比例的初始值;B:冰上和室温放置不同时间,CD11b+CD115+比例变化;C:冰上和室温放置时,流式图显示各检测时间点CD11b+CD115+比例
2.2 温度和放置时间对CD115与抗体结合后稳定性的影响
对CD115稳定性的影响因素,目前研究主要集中在前期,即CD115与抗体结合前放置时间和温度的影响。研究显示,CD115抗体能与CD115抗原结合,除了应用于流式检测外[19],还可作为中和抗体,阻止相关配体结合。CD115与抗体结合后,其稳定性是否受其他因素影响目前未知。在本研究中,将获得的小鼠外周血先与抗体结合(操作在冰上进行,大约2 h),然后在不同温度下,放置一段时间,观察CD11b和CD115双阳性细胞比例的变化,结果如图2所示。与抗体结合后,继续在冰上放置4 h(加上前期操作的2 h,共计6 h),CD11b和CD115双阳性细胞的比例并无明显变化,这与前述结果类趋势一致;相反,在室温放置0.5 h,其比例即降至50%以下;而在37 ℃放置0.5 h则下降到10%。这说明,温度升高可降低CD115的稳定性;CD115与抗体结合后,其稳定性并没有变化,在冰上操作时也可稳定6 h。
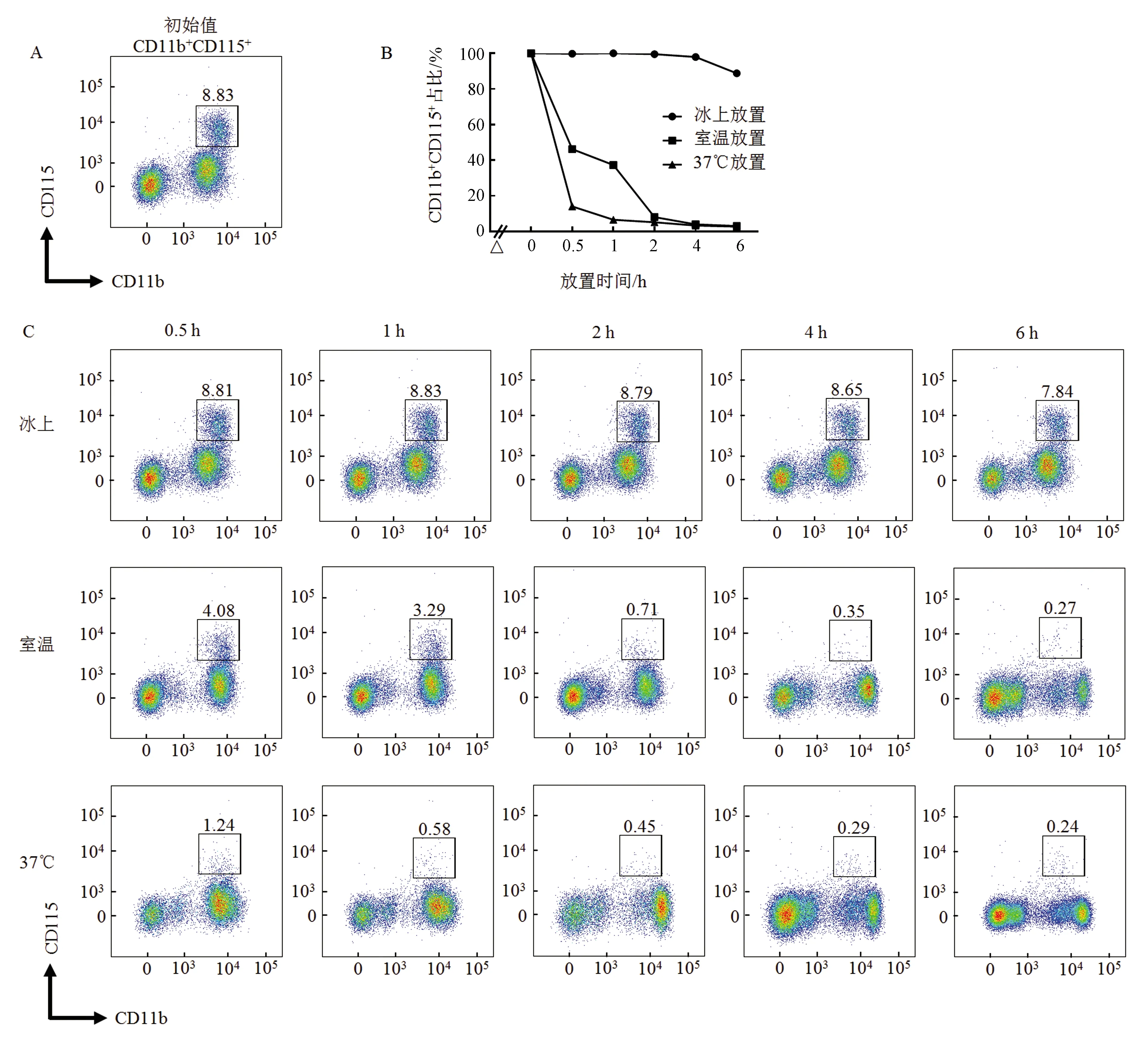
A:本次实验中,小鼠外周血中CD11b+CD115+所占比例的初始值;B:冰上、室温和37 ℃放置不同时间,CD11b+CD115+比例变化(△:从外周血获取到标抗结束约2 h);C:冰上、室温和37 ℃条件下,流式图显示各检测时间点CD11b+CD115+比例
2.3 PFA固定对CD115稳定性的影响
研究显示,PFA可保存白细胞抗原,是流式检测中常用的固定液[20-21]。为探究PFA固定对于CD115稳定性的影响,本研究对小鼠外周血样本用抗体标记,再用1% PFA进行固定后,对其CD11b和CD115双阳性细胞的比例进行分析。结果显示,样本在4 ℃放置时,其比例随时间变化不明显,可达3 d,远长于未固定标本的6 h(图3A);而在室温放置时,其比例在0.5 h即明显下降,仅为初始值的80%左右,其后仍有缓慢下降(图3B)。
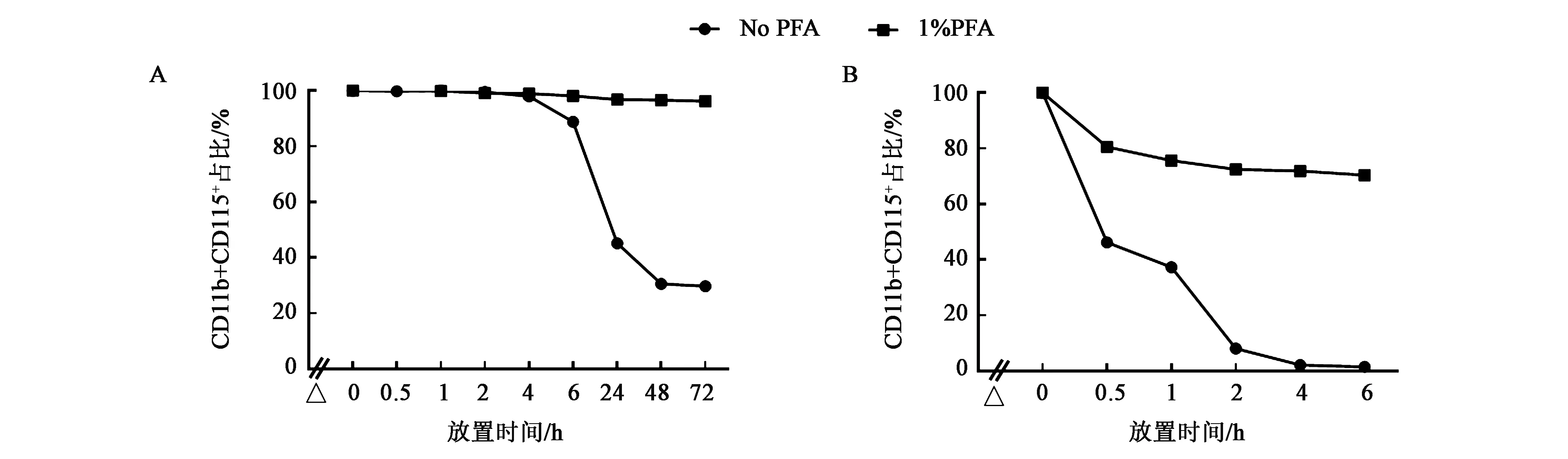
A:在冰上放置不同时间,CD11b+CD115+比例变化;B:在室温放置不同时间,CD11b+CD115+比例变化(△:从外周血获取到标抗结束约2 h)
2.4 应用组合抗体检测小鼠骨髓和外周血中的单核细胞及其亚群
为进一步精确分析小鼠单核细胞及其亚群,取骨髓和外周血样本,另外加入Lin抗体和Ly6C抗体,全程冰上操作,6 h内进行流式上机检测;或使用1% PFA固定,72 h内进行检测。结果显示,每个抗体的单阳管都有明显的阳性和阴性细胞,说明其他抗体稳定性良好,这与文献报道一致[11]。继续分析结果(图4),在骨髓和外周血中,可以看到明显的Lin-CD11b+CD115+的单核细胞群;根据Ly6C信号强弱,可继续将其分为3个亚群。这也进一步说明,优化后的方法可以较为准确地检测小鼠单核细胞及其亚群。
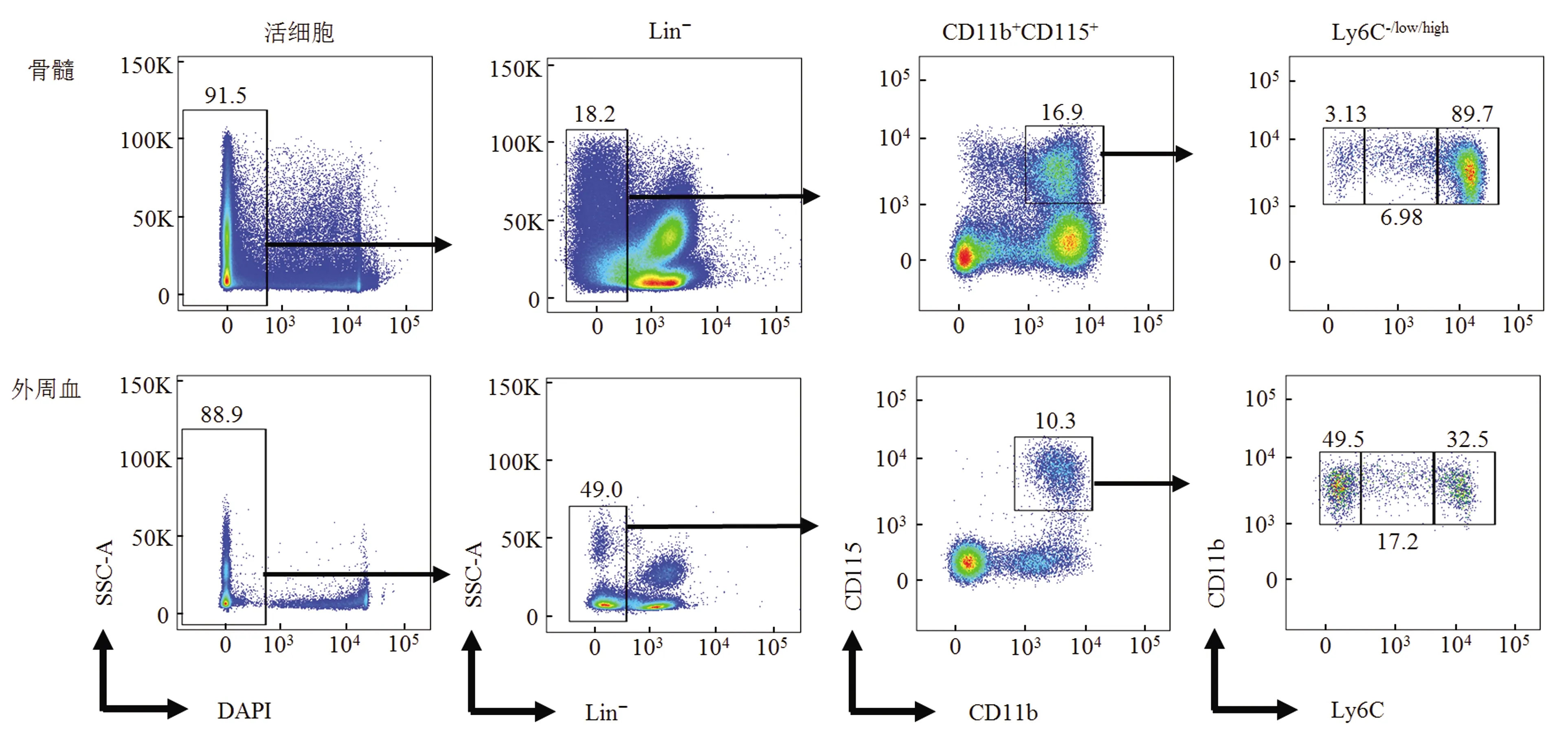
图4 流式分析小鼠骨髓和外周血中单核细胞及其亚群
3 讨论
单核细胞作为机体防御系统的重要组成部分,在抵御病原微生物入侵和免疫调节等方面发挥重要作用。单核细胞数量发生改变与机体炎症或其他疾病状态密切相关。应用流式细胞术检测单核细胞占比变化,有助于揭示单核细胞在疾病发生和转归中的作用。小鼠单核细胞特异性抗原CD115的稳定性较差,在标本处理过程中,常因各种原因丢失或内化,影响检测的准确性。本研究进一步确定了温度、放置时间和固定因素对CD115稳定性的影响,并应用此优化条件,利用抗体组合,更精确地分析小鼠单核细胞及其亚群,为进一步研究单核细胞生物学特性及其在疾病中的作用打下基础。
在应用流式检测小鼠单核细胞时,主要依靠CD11b和CD115 2种细胞表面标志[22]。由于CD115的稳定性较差,温度和放置时间对其影响较大,因此实验操作要求在冰上尽快进行[11, 13]。Breslin等[14]发现,样本在4~8 ℃和EDTA中存放,其CD115可稳定4 h;而在室温4 h后,其下降幅度则达33%。本研究发现,样本在冰上放置时,CD115的稳定时间可达6 h;而在室温放置1 h后,CD115下降幅度即达40%。本研究结果显示,CD115在冰上可放置更长时间,原因可能是冰水温度在0~4 ℃,略低于Breslin等[14]的样本储存温度;本研究中CD115在室温中放置时间则更短,可能与环境温度偏高有关。室温环境的一致性难以严格控制,这是本研究的一个局限因素。该推测也在后续实验中得到验证:当温度达到37 ℃时,大部分CD115在0.5 h左右即消失。另外,体外单核细胞培养时,常在37 ℃孵箱内进行,面对CD115的下降或消失,M-CSF是如何发挥作用将有待于进一步研究。
CD115抗体还可作为中和抗体,阻止相关配体与CD115的结合[19],本研究发现,在抗体结合前后,CD115的稳定性并没有发生明显变化。至于CD115与抗体结合后是否引起单核细胞信号通路的变化,需要进一步研究。流式检测样本可用PFA进行固定,从而保存白细胞抗原[20-21]。与此一致,本研究也发现,PFA固定可保持CD115抗原抗体的稳定性,尤其在4 ℃条件下,其放置时间可长达3 d。固定后在室温放置时,CD11b和CD115双阳性细胞明显下降,则可能与室温条件下,荧光抗体不稳定有关。
随着流式技术的进展,通过多种抗体组合,对某群特定细胞进行检测或分析成为可能。本研究利用多种抗体组合,进一步对单核细胞及其亚群进行分析,结果比较理想。利用该组合,还可分选到更加均一的单核细胞,进行更为深入地研究。
单核细胞在机体防护、免疫及创伤愈合过程中起协同作用,检查单核细胞计数是辅助诊断的重要方法之一。单核细胞计数的准确性对于疾病诊断的作用可见一斑。应用本研究所得到的优化条件处理样本,全程冰上操作且6 h内上机检测,或使用PFA固定等方法均能有效保证流式检测单核细胞比例的准确性。本研究从小鼠单核细胞特异性抗原CD115的稳定性入手,探究不同因素对于流式检测单核细胞比例准确性的影响,为精准检测小鼠单核细胞提供了技术支持,也为临床研究病人单核细胞生物学特性提供了新思路。
