宫颈癌根治术前介入化疗对手术疗效、肿瘤细胞凋亡、术后生活质量的影响
2021-06-02王斌张圳妙全毅胥琳璟张月桃洪苑
王斌,张圳妙,全毅,胥琳璟,张月桃,洪苑
(广东省肇庆市第一人民医院妇产科,广东 肇庆526020)
宫颈癌是严重威胁女性健康的疾病。据统计,本病在发展中国家的发病率和死亡率均显著高于发达国家,而我国宫颈癌的新发病例占全球的11.7%,且其发病率和死亡率仍在逐年上升,因此,我国宫颈癌的防治形势仍较为严峻[1-2]。根治性切除术可显著降低早期宫颈癌的复发率,提高5年存活率,是临床首选的治疗措施[3]。然而,部分患者的肿瘤体积大,影响手术切除效果,增加术后复发、转移的风险。相关研究显示,术前新辅助化疗可显著提高宫颈癌手术疗效,且动脉内介入化疗效果优于全身静脉化疗[4]。本研究探讨宫颈癌根治术前介入化疗对手术疗效、肿瘤细胞凋亡、术后生活质量的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2013年1月至2016年6月我院收治的宫颈癌患者。纳入标准:依据《宫颈癌及癌前病变规范化诊疗指南(试行)》[5],经病理学诊断,均明确宫颈癌的诊断且国际妇产科联盟(FIGO)2018年分期为Ⅰb期或者Ⅱa期,且肿瘤最大直径≥4 cm;签署知情同意书。排除标准:已经接受化疗或者手术等相关治疗者;卡氏评分低于70分以及存在手术或者化疗禁忌证者;合并其他恶性肿瘤或者肝肾功能衰竭等严重基础疾病者;发现肿瘤远处转移者;合并精神疾病、意识障碍者。本研究经医院伦理委员会批准。共纳入50例宫颈癌患者,随机分为观察组和对照组,各25例。观察组患者年龄31~58岁,平均(45.0±7.0)岁,肿瘤最大径 (5.3±1.6)cm;Ⅰb期14例,Ⅱa期11例;腺癌21例,腺鳞癌2例,鳞癌2例;低分化癌7例,中分化癌9例,高分化癌9例。对照组患者年龄30~55岁,平均(43.3±6.8)岁,肿瘤最大径 (5.4±1.8)cm;Ⅰb期16例,Ⅱa期9例;腺癌20例,腺鳞癌3例,鳞癌2例;低分化癌6例,中分化癌10例,高分化癌9例。2组患者一般资料比较差异无统计学意义,具有可比性(P>0.05)。
1.2 研究方案 2组患者均接受广泛全子宫切除术+盆腔及腹主动脉旁淋巴结清扫术治疗。术后根据病理结果,对于切缘阳性、淋巴结或者宫旁转移的患者,需要进行术后化疗。对于存在宫颈深部间质浸润、脉管瘤栓者,需要进行术后放疗。观察组术前接受子宫动脉介入化疗栓塞术,对照组未进行。经股动脉穿刺插管进入对侧髂内动脉,造影下确定子宫动脉,将总药量一半的化疗药注入靶血管。退出导管至腹主动脉成袢后,经髂内动脉插入,并将剩余的化疗药注入靶血管。药物方案为:紫杉醇(60 mg/m2)、顺铂(60 mg/m2)。2周后再按照上述方案给予介入化疗1次。3~4周后再行手术治疗。2组其余治疗措施相同。
1.3 观察指标 对比观察组介入化疗前后肿瘤最大径的变化;对比2组患者的手术情况、手术前后血清血管内皮生长因子(VEGF)、术后宫颈组织的肿瘤细胞凋亡相关指标的水平。血清VEGF检测采用ELISA法。肿瘤细胞凋亡相关指标的检测采用免疫组化法,包括天门冬氨酸蛋白水解酶-3(Caspase-3)、天门冬氨酸蛋白水解酶-9(Caspase-9)、肿瘤坏死因子α诱导蛋白-8(TNFAIP8)、过氧化物还原酶-4(Prdx4)。随访3年,术后6个月、12个月采用癌症患者生命质量量表(FACT-G)[6]评价2组患者的生活质量。量表包括生理状况、社会/家庭状况、情感状况、功能状况4个维度,共27个条目,评分范围为0~108分,评分越高,生活质量越好。量表经国内考核,证实具有良好的信度和效度。术后3年,分析2组患者的复发率和存活率。
1.4 统计学方法 采用SPSS 20.0软件进行统计学分析,计量资料以均数±标准差表示,采用t检验,手术前后的对比采用配对t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 观察组介入化疗前后肿瘤最大径的比较 介入化疗后,观察组肿瘤最大径(2.7±1.7)cm,显著小于介入化疗前[最大径(5.3±1.6)cm](t=5.599,P=0.000)。介入化疗前后肿瘤体积变化情况见图1、图2。
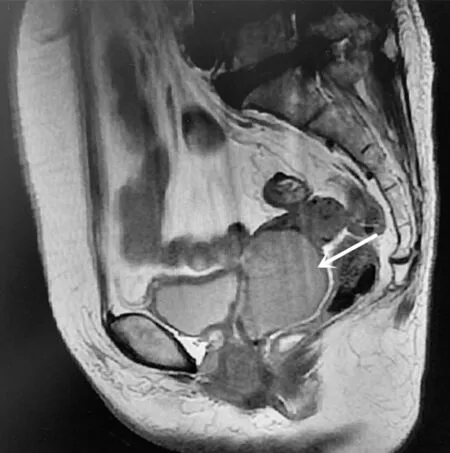
图1 宫颈癌介入化疗前的MRI图像
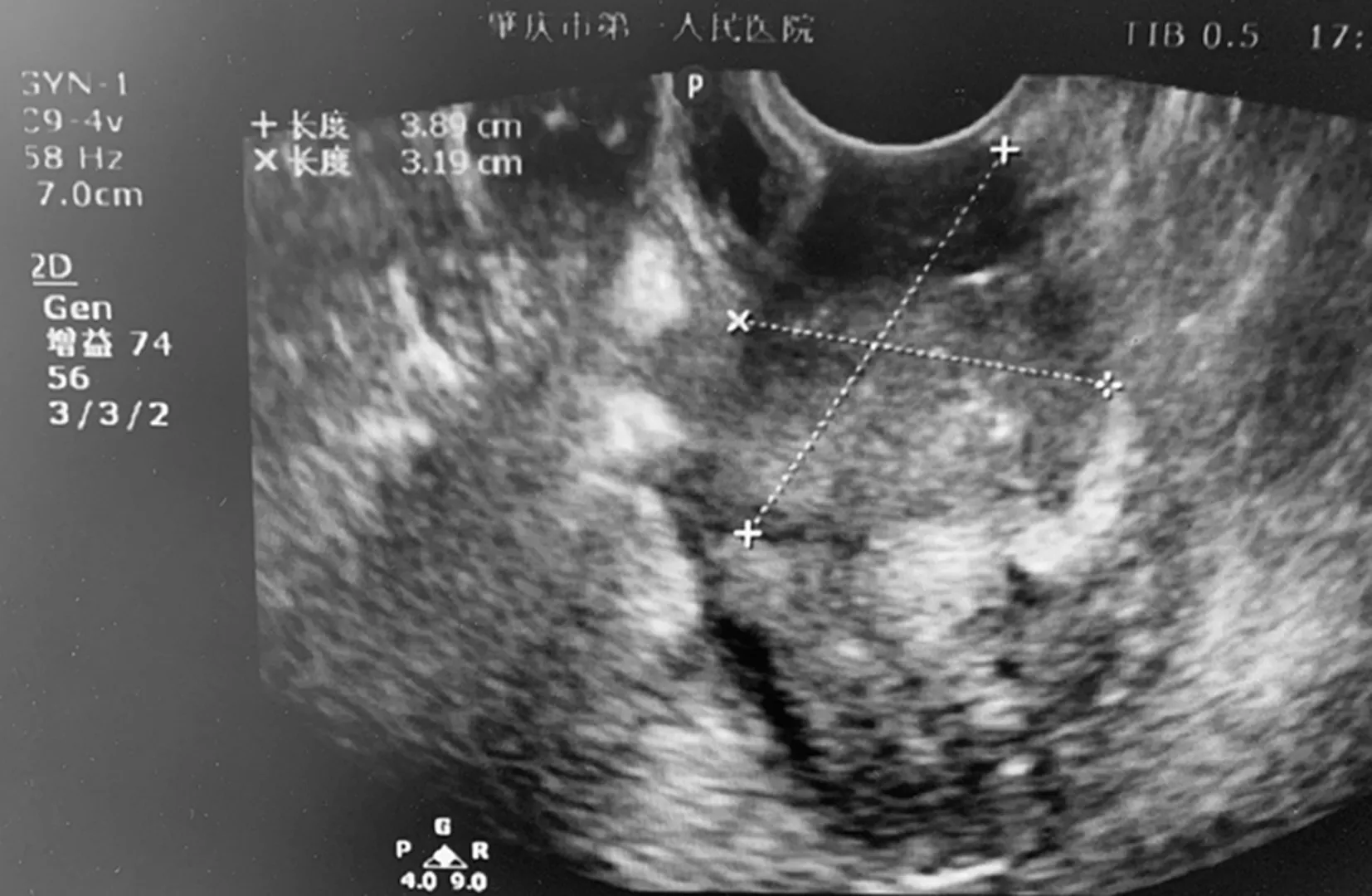
图2 宫颈癌介入化疗后的超声检查图像
2.2 2组患者手术情况的比较 观察组的手术时间、术中出血量、淋巴结转移率均显著低于对照组(P<0.05),见表1。

表1 2组患者手术情况的比较
2.3 2组患者血清VEGF的比较 2组患者术前VEGF-A、VEGF-C、VEGF-D水平比较差异无统计学意义,术后上述指标均低于同组术前(P<0.01);观察组术后VEGF-A、VEGF-C、VEGF-D水平均显著低于对照组(P<0.01),见表2。

表2 2组患者血清VEGF的比较(x ±s,ng/ml)
2.4 2组患者术后宫颈组织的肿瘤细胞凋亡指标水平的比较 观察组的Caspase-3、Caspase-9水平显著高于对照组,而TNFAIP8、Prdx4水平显著低于对照组(P<0.01),见表3。
2.5 2组患者术后FACT-G评分的比较 2组患者术后6个月、术后12个月的FACT-G评分比较,差异无统计学意义(P>0.05),见表4。

表3 2组患者术后宫颈组织的肿瘤细胞凋亡指标水平的比较(x ±s,ng/ml)
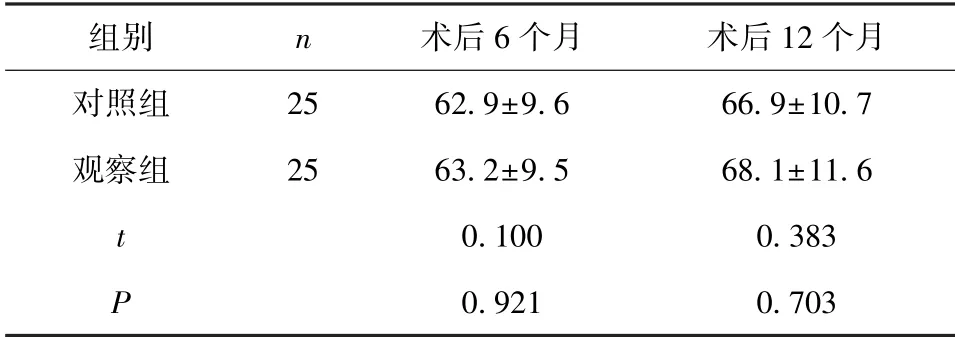
表4 2组患者术后FACT-G评分的比较(x±s,分)
2.6 2组患者术后3年肿瘤的复发和存活情况比较 观察组术后3年的肿瘤复发率显著低于对照组(P<0.05);术后3年存活率高于对照组,但差异无统计学意义(P>0.05),见表5。

表5 2组患者术后3年肿瘤的复发和存活情况对比[n(%)]
3 讨论
一项全国性的调查显示,宫颈癌是我国发病率排名第6,死亡率排名第8的女性恶性肿瘤[7],因此,如何优化宫颈癌的治疗方案一直是临床研究的重点。手术联合术后化疗、放疗是以往最常用的治疗方案。但是对于肿瘤体积较大、分期较高等手术难以完全切除的病例,上述方案的术后复发率较高,临床疗效并不理想[8]。新辅助化疗是通过术前化疗,以缩小肿瘤体积、清除微转移灶、降低肿瘤分期等,为根治术创造良好的条件,提高手术疗效和降低术后肿瘤转移和复发率,改善患者的预后。
在本研究中,观察组经过介入化疗后,肿瘤最大径显著缩小,这与以往的研究结论[9]一致。新辅助化疗可使肿瘤细胞的活力降低,减少手术种植转移的风险,另外,术前化疗对微转移灶的清除还可进一步降低术后的复发、转移率。同时,相对于静脉化疗,动脉介入化疗可减少全身化疗的不良反应,使药物在肿瘤局部形成较高的浓度,提高杀伤肿瘤的效率[10]。孙雪松等[11]通过动脉介入新辅助化疗治疗晚期宫颈癌,取得14.5%的完全缓解率和85.5%的部分缓解率的治疗效果。在本研究中,观察组患者的手术时间和术中出血量均显著少于对照组,这主要是术前介入化疗与肿瘤萎缩、供血减少有关。临床研究显示,肿瘤直径是影响宫颈癌根治术患者预后的危险因素[12]。通过术前介入化疗使肿瘤萎缩可促进患者术后预后的改善。在本研究中,观察组淋巴结转移率更低,这主要与术前介入化疗对肿瘤细胞的杀伤效果有关。江翠兰等[13]的研究也证实,术前新辅助化疗可降低淋巴结转移率,提高手术切除效果。
恶性肿瘤具有局部浸润和远处转移的特点,单纯的手术切除难以完全清除病灶,容易遗留浸润生长于周围组织或者经淋巴结、血管转移的细胞。新生血管的生成是肿瘤生长和转移的重要机制,术前介入化疗不仅可使肿瘤体积缩小,还可抑制新生血管、淋巴管的生成,进而减少肿瘤细胞经血液、淋巴途径的转移[14-15]。VEGF是促进新生血管、淋巴管生长的重要因子,其中VEGFA与新生血管的生成相关,VEGF-C、VEGF-D与新生淋巴管的生成相关。在本研究中,观察组术后的VEGF-A、VEGF-C、VEGF-D表达均显著低于对照组,这说明术前介入化疗对VEGF-A、VEGF-C、VEGF-D表达有显著的抑制作用,这也是介入化疗抑制肿瘤生长、侵袭和转移的重要机制之一。调控肿瘤细胞凋亡是化疗药物抗肿瘤作用的重要机制[16-17]。Caspase-9分子的激活可活化Caspase-3分子,介导肿瘤细胞的凋亡。TNFAIP8、Prdx4均为抗凋亡分子,拮抗促凋亡因子的作用,对肿瘤细胞的凋亡起到抑制作用。朱怡[18]的研究证实,miR-124相对表达量越低的宫颈癌组织,Prdx4、TNFAIP8蛋白含量越高,肿瘤细胞呈现凋亡不足、过度增殖。在本研究中,观察组术后Caspase-3、Caspase-9的表达均显著高于对照组,而TNFAIP8、Prdx4的表达显著低于对照组,这说明术前介入化疗可调节上述因子的表达,促进肿瘤细胞的凋亡。术后随访结果显示,2组患者的FACT-G评分差异无统计学意义,但是观察组术后3年的复发率显著低于对照组。这说明术前介入化疗并不会降低患者的生活质量,但可有效降低患者术后3年的复发率,提高手术疗效。观察组术后3年的存活率高于对照组,但差异无统计学意义,这可能与本研究纳入的病例数量较少有关。
综上所述,宫颈癌术前介入化疗可促进肿瘤细胞凋亡,降低术后复发率,且对患者术后生活质量无明显不良影响。
