采用气相色谱-离子迁移谱分析黄大茶加工过程挥发性成分
2021-06-02郭向阳霍羽佳王本友宛晓春
郭向阳,霍羽佳,王本友,宛晓春
采用气相色谱-离子迁移谱分析黄大茶加工过程挥发性成分
郭向阳1,2,霍羽佳3,王本友3,宛晓春1※
(1. 安徽农业大学茶树生物学与资源利用国家重点实验室,合肥 230036;2. 深圳大学化学与环境工程学院,深圳 518060;3. 山东海能科学仪器有限公司,济南 251500)
茶叶加工对茶叶香气的形成至关重要。为了研究黄大茶加工过程中香气成分的组成及变化规律,采用气相色谱-离子迁移谱(Gas Chromatography-Ion Mobility Spectrometry,GC-IMS)技术对黄大茶加工过程的挥发性成分进行分析。定性分析、鉴定茶叶挥发性成分,构建黄大茶加工过程挥发性成分的差异谱图,并以鉴定的挥发性成分对黄大茶加工过程进行主成分分析。共鉴定出挥发性成分40种,主要有醇类、酮类、醛类、酯类和杂环类化合物。杂环类和醛类化合物是黄大茶挥发性成分的主体部分,且杀青之后,杂环类化合物的含量随着加工过程的进行逐渐增加,醛类化合物的相对含量在初烘之后呈现显著性增加,而醇类及酮类挥发性成分的相对含量在初烘之后显著性降低(<0.05)。具花香的氧化芳樟醇只在初闷之前的样品中得到鉴定,在鲜叶中的含量最高,达21.98%,而1-辛烯-3-酮及苯乙酮只在初烘之后的样品中得到鉴定。通过GC-IMS的指纹图谱可知,苯甲醛、2,5-二甲基呋喃、糠醛及二甲基二硫等挥发性成分构成了经“拉老火”工序的黄大茶的特征峰区域。在一定程度上,主成分分析能够将黄大茶加工过程样品进行区分,表明气相色谱-离子迁移谱分析可为黄大茶加工过程的判别区分提供可能。相较于传统的茶叶挥发性成分检测分析技术,气相色谱-离子迁移谱具有快速、高效、绿色环保的特点。研究结果提供一种新的茶叶挥发性成分的检测分析方法,同时为茶叶加工过程监测及品质控制等提供了一定参考依据和理论基础。
香气;品质控制;黄大茶;顶空气相色谱-离子迁移谱;挥发性成分;茶叶加工;判别区分
0 引 言
黄大茶隶属于黄茶,主产于皖西的霍山、金寨等县,因具有卓越的健康功效及特征的“锅巴香”韵,越来越受到消费者青睐[1]。“锅巴香”是黄大茶重要的风味特征,主要来源于其挥发性成分中杂环类化合物的贡献[2-3]。茶叶加工,特别是黄大茶特有的“拉老火”工艺是造就其风味特征的关键[2]。一直以来,主要以茶叶审评评价茶叶的香气品质,而茶叶加工过程节点的控制多依赖于加工师傅的经验判段。茶叶审评对审评人员的专业能力及准确性要求较高,通过人工嗅闻对茶叶干茶、茶汤及叶底的香气进行评价,而加工经验获得则需要长时间生产实践积累,操作难度较大,相对耗时,并具有一定的主观性[4]。
香气是茶叶的灵魂,茶叶加工对茶叶香气的形成至关重要。茶叶香气多来源于加工过程中通过糖苷水解、脂类氧化降解、类胡萝卜素类降解和美拉德反应等一系列生化反应产香[5]。挥发性成分是茶叶香气的物质基础,对加工过程样品挥发性成分的分析有助于了解茶叶加工过程中挥发性成分的组成及变化规律,解析茶叶香气生成机理,同时能对茶叶加工工艺进行优化,避免茶叶异味的产生。前期研究中,对黄大茶风味成分分析的研究报道较少,且多聚焦于黄大茶成品茶的香气组成分析[2-3],而缺少对其完整加工过程的挥发性成分解析。
茶叶香气成分萃取多采用同时蒸馏萃取及固相微萃取法[6]。同时蒸馏萃取法能有效地富集茶叶挥发性成分,但长时间高温蒸煮过程中人工效应物的产生会影响茶叶香气成分的真实性[7];固相微萃取法排除了溶剂的干扰及高温的影响,但吸附材质对挥发性成分的选择性吸附及后期解吸附的不完全会影响茶叶挥发性成分组成分析的准确性[8]。气相色谱-质谱联用分析(Gas Chromatography-Mass Spectrometry,GC-MS)、气相色谱-质谱联用-嗅辩仪(Gas Chromatography-Mass Spectrometry-Olfactometry,GC-MS-O)及电子鼻检测多应用于茶叶挥发性成分组成分析及致香成分解析,但相关检测分析技术所需样品前处理复杂,并可能有溶剂的干扰和影响,且后期数据分析耗时较长[9-11]。
气相色谱-离子迁移谱(Gas Chromatography-Ion Mobility Spectrometry,GC-IMS)是近年来发展起来的一种新的无损检测技术,能够对食品及其加工过程样品的香气品质进行判断[12-13]。GC-IMS分别结合了气相色谱(Gas Chromatography,GC)与离子迁移谱(Ion Mobility Spectrometry,IMS)的快速分离能力和响应能力,与常规的GC-MS相比,GC-IMS无需抽真空,可以在常压条件下进行检测分析,并可用于挥发性成分中香气异构体的分离,而且相较于嗅辩仪和电子鼻检测具有数据处理简单的优势[14],在一定程度上可借鉴应用到解决茶叶审评主观性强的问题,并实现对茶叶加工过程的实时监测。常压条件下,GC-IMS利用气相色谱与离子迁移谱联用对挥发性物质进行两次分离,而后进行定性及定量分析,同时获得样品挥发性成分组成及品质判别信息[15]。GC-IMS检测速度快,样品无需前处理,特别适合于挥发性化合物的痕量探测,广泛应用于大气污染物、化学试剂、爆炸物及毒品等的快速检测分析[9,14],在橄榄油掺伪分析[16-17],白酒风味成分分析[18],以及咖啡产地判别[19]上有较好的应用。
本试验利用GC-IMS技术对黄大茶加工过程挥发性成分进行采集和分析,包括7个加工工序的样品,并结合主成分分析考察分析结果在判别区分茶叶加工过程中的应用性。茶叶加工过程挥发性成分分析将有利于黄大茶机械化、标准化生产进程的推进,而黄大茶资源的开发和利用也亟待需要全面的挥发性成分的数据支撑。研究结果可为茶叶挥发性性成分快速检测、加工过程监测、风味品质控制及评价方法提供参考依据和理论基础。
1 材料与方法
1.1 材料与仪器
黄大茶鲜叶(群体种)2018年6月采摘于安徽会宾义茶叶有限公司茶园(安徽,霍山),由专业制茶师傅以传统黄大茶工艺加工至成品茶,具体加工过程参数[3]及样品信息见表1。各加工过程样品经冷冻干燥后,粉碎,过筛(60目),备用。酮类(C4-C9),用于测定保留指数,中国国药集团化学试剂有限公司。挥发性物质标准品,吡咯,己醛,糠醛,叶醇,苯乙烯,苯甲醛,苯乙醛,反,反-2,4-己二烯醛,柠檬烯,苯甲醇,-萜品烯,芳樟醇氧化物,芳樟醇,苯乙醇,水杨酸甲酯,-萜品烯,-蒎烯,法呢烯均为色谱纯,美国Sigma公司。
FlavourSpec®顶空(Headspace,HS)-GC-IMS食品风味分析与质量控制系统(配备CTC PAL RSI自动顶空进样装置),德国G.A.S mbH公司;ME104E分析天平,瑞士梅特勒仪器有限公司;ALPHA 1-4 LD plus冷冻干燥机,德国Christ公司;20 mL顶空进样瓶,美国Agilent公司。
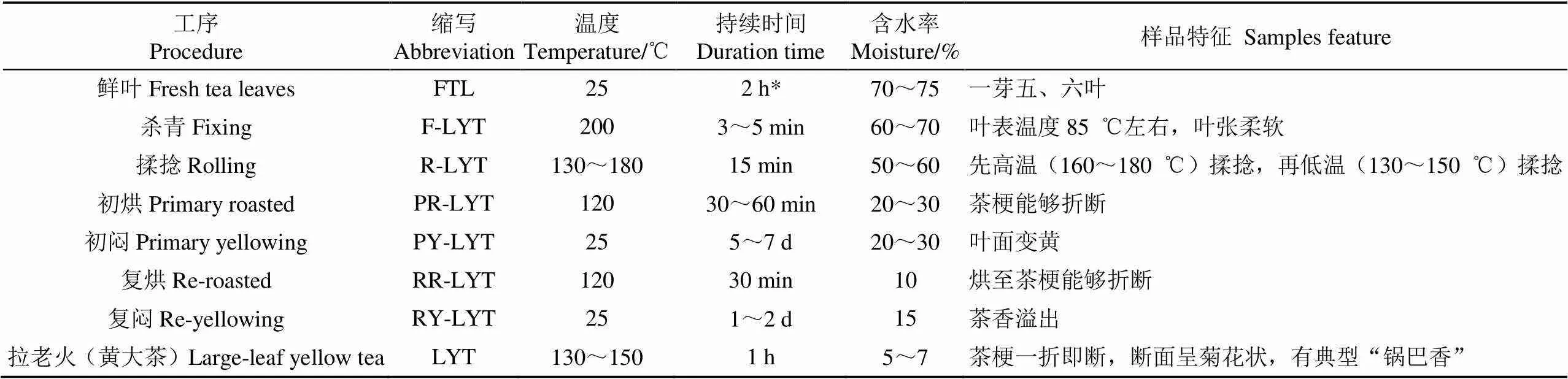
表1 黄大茶加工过程样品特征
注:‘*’,鲜叶采摘时间。Note: ‘*’, duration time of plucking fresh tea leaves.
1.2 试验条件
1.2.1 GC-IMS测定条件
顶空进样条件:1 g样品于20 mL顶空进样瓶中,85 ℃孵化20 min,孵化转速500 r/min,经顶空进样500L用GC-IMS仪FlavourSpec®进行测试。载气N2(纯度≥99.999%);进样针温度90 ℃;FS-SE-54-CB-1色谱柱(15 m × 0.53 mm,1m);载气流量:0~20 min,2 mL/min;20~21 min,100 mL/min。
IMS条件:漂移管长度98 mm;漂移管温度45 ℃;漂移气为N2(纯度≥99.999%);漂移气流速150 mL/min;射线,3H为放射源;正离子化模式[15,19]。
1.2.2 数据处理
通过仪器自带分析软件Laboratory Analytical Viewer(LAV)中插件Reporter和Gallery Plot分析茶叶样品中挥发性成分的差异谱图,并进行GC-IMS指纹图谱的对比;利用GC×IMS Library Search Software软件(内置NIST2014、IMS数据库)并结合保留时间(Retention time, Rt)、保留指数(Retention Index,RI)对检出的挥发性成分进行数据匹配并分析,部分化合物以标准物质对其进行鉴定分析,同时参考相关文献数据对挥发性成分进行定性分析[15-19]。通过插件Dynamic PCA和Origin 2020b对样品进行主成分分析。平行分析两份茶叶样品。挥发性成分含量为归一化后的相对峰面积(%),最终结果以两次数据的平均值呈现。
2 结果与分析
2.1 GC-IMS谱图
图1为黄大茶加工过程样品的GC-IMS二维谱图,图谱中横坐标表示离子迁移时间(Drift time,Dt),纵坐标表示保留时间(Retention time,Rt)。经归一化处理,图谱左侧竖线为反应离子峰(实际迁移时间约为8.00 ms)。图谱中每一个点代表一种挥发性有机化合物,点的面积大小及颜色深浅表示含量大小,面积越大、颜色越深,则挥发性成分的含量越高[20]。
从图1对比可知,黄大茶加工过程样品挥发性成分组成差异较大,鲜叶(FTL)及初烘之前(PR-LYT)样品中鉴定出的挥发性数量较多(均为36个),经初闷加工后鉴定出的挥发性成分数量减少,初闷(PY-LYT)及之后样品中均有33个挥发性成分得到鉴定。纵观黄大茶加工过程,挥发性成分多集中在Rt(0~300 s)内出峰,初闷之前的样品中,Rt(600~800 s)内挥发性成分相对较多,初闷及之后样品中,Rt(300~600 s)内检出较多挥发性成分。图1中标注的具有相同保留时间及迁移时间的挥发性成分为相同化合物,其中Rt(200~400 s)处的化合物为2-甲基丁酸,Rt(600~800 s)处的挥发性成分是氧化芳樟醇(反式呋喃型),两者在不同加工过程中的含量存在较大差异,均在鲜叶中含量最高,在后续样品中含量逐渐降低,且只在初闷之前的样品中得到检测,可能其在黄大茶长时间闷黄过程中发生了成分间转化或挥发而无法检测得到。
2.2 挥发性成分鉴定
根据挥发性成分保留时间和迁移时间,及标准物质对黄大茶及其加工过程样品挥发性成分进行定性分析,其挥发性成分主要从属于醇类、酮类、醛类、酯类、杂环类及其他类(表2)。黄大茶成品茶中以杂环类、醛类挥发性成分为主,与文献[2,3,6]的研究结果相一致,但整体鉴定的挥发性成分的数量较少,只有40种,可能与挥发性成分的萃取及检测分析方法不同有关。由于单体和二聚体属于同一种结构的化合物,统计同时检出单体和二聚体的化合物数量时仅计算一次,其含量为二者加合。杂环类、酯类及醇类化合物的相对含量较高,在每个加工样品中的相对含量均大于10.00%,而酮类化合物的相对含量在初闷及以后的样品中相对含量均小于5.00%。
醇类、酯类、醛类、酮类及杂环类化合物均是茶叶中重要的挥发性成分,对茶叶风味的形成不可或缺。初闷之前的样品中均有9种醇类成分得到鉴定,而初闷及之后的样品中鉴定得到的醇类成分只有5种。鲜叶及揉捻样品中醇类成分的含量最高,相对含量分别占挥发性成分总量的47.88%和46.21%,经拉老火工序的黄大茶中醇类成分的含量最低,为17.5%。醇类成分的产生主要源于茶叶加工过程中糖苷水解及脂类氧化降解,大多具有青味或愉悦的花香[5]。氧化芳樟醇、芳樟醇、乙醇、反-2-己烯醇、2-乙基己醇、2-苯乙醇及1-辛烯-3-醇(≥1.0%)是主要的醇类成分,芳樟醇呈花香[21],在杀青至初闷工序的样品中含量较高,为15.30%~23.83%,是唯一一个在黄大茶加工过程中含量均超过7.0%的挥发性成分;1-辛烯-3-醇具有类似蘑菇的气味[22],在黄大茶中含量较低(0.17%);2-苯乙醇及氧化芳樟醇具有花香[23],分别在初烘和鲜叶中含量最高,为1.96%和21.98%,但在初闷工序后的样品中无法检测得到。
酮类成分检出6种,初烘及揉捻样品中酮类成分含量相对较高,为13.73%和9.42%,初闷及之后加工过程样品中酮类成分含量均小于5.0%,其中初闷样品中酮类成分最低,为2.81%。茶叶中酮类成分的产生主要来源于类胡萝卜类及脂类物质的降解反应,大多具有果甜香或奶香味[5]。其中,乙酮、2-丁酮及苯乙酮含量较高(≥1.0%),分别呈现微甜香、果香味及山楂样果香[15],前两者在初闷之前的样品中含量较高,而苯乙酮只在初闷及以后的样品中能够检出。
醛类共有11种成分得到鉴定,是检出数量最多的一类挥发性成分,在黄大茶(LYT)中含量最高,为22.63%,杀青及初烘样品中含量较低,分别为9.69%和9.70%。脂质降解是茶叶中醛类成分产生的重要反应[5],主要生成呈青味、果香或肉香的短链醛类,而芳香醛类成分,如苯甲醛和苯乙醛的产生与加热条件下的美拉德反应有关[24-25]。醛类主要包括苯乙醛、苯甲醛、(,)-2,4-庚二烯醛和(,)-2,4-庚二烯醛(≥1.0%),苯乙醛呈蜜香[25],在杀青和揉捻样品中含量较高,分别为5.79%和6.32%;苯甲醛呈苦杏仁香和焦糖香[24],初烘样品中含量较高(4.45%,其中二聚体为1.27%,单聚体为3.18%),初闷样品中含量最低(0.54%),同苯乙醛一样,拉老火工序后,其含量增加;(,)-2,4-庚二烯醛和(,)-2,4-庚二烯醛均具有青味、果香或鸡肉香味[26],只在初闷及以后的样品中得到鉴定,且在黄大茶(LYT)中含量最高,分别为8.02%和9.51%。
检出酯类化合物6种,酯类成分在各加工样品中含量均较高,为15.28%~26.47%。脂质降解后产生的脂肪酸和醇的酯化反应,生成具清甜香和水果香气的酯类成分[27]。黄大茶加工过程中酯类成分主要包括乙酸乙酯和水杨酸甲酯(≥1.0%),前者呈微带果香的酒香[28],在初烘以后的样品中含量较高,复烘中含量最高,为22.20%;水杨酸甲酯具冬青油香气或青味[21],是茶叶的关键香气化合物,常被作为植物逆境响应的一种信号分子[29],在鲜叶中含量最高,为16.94%。
注:'*',标准物质鉴定;'#',二聚体;'—',未检测到。
Note: '*', identified with authentic standards; '#', dimer of chemical compound; '—', not detected.
杂环类化合物有7种得到鉴定,在鲜叶中含量最低(10.40%),黄大茶中含量最高(28.76%)。随着加工过程的进行,除了揉捻样品中含量减少外,其余加工过程样品中杂环类含量逐渐增加。一般认为,茶叶中杂环类化合物主要来源于加工过程中的非酶反应[30],黄大茶烘焙或拉老火工序为焦糖化反应和美拉德反应的发生提供了条件。杂环类主要包括2-乙基呋喃、糠醛、2-甲基噻吩、3-呋喃甲醇和三甲基吡嗪(≥1.0%),糠醛具有杏仁油味[31],2-甲基噻吩呈类似苯的芳香气味[32],两者均在黄大茶(LYT)中含量最高,其含量分别为4.00%和9.58%;2-乙基呋喃呈豆香、焦糖香、甜香或咖啡样香气[33],在初闷之后的样品中含量较高,为8.52%~12.53%;三甲基吡嗪具有咖啡或可可的烘烤香[34],3-呋喃甲醇呈现辛辣的刺激感[7],前者在初烘的样品中含量最高,为11.10%,而后者在初闷样品中有较高含量(1.59%)。
其他类化合物检出5种,主要为酸类和二硫类化合物,含量相对较少。主要包括丙酸和二甲基二硫(≥1.0%),前者具有刺激性气味,闷黄过程中开始产生,在复烘样品中含量最高,为4.77%;二甲基二硫呈蒜香,茶叶加工过程中通过美拉德反应产生,在乌龙茶和绿茶香气中普遍存在[21,25]。
2.3 GC-IMS指纹图谱分析
为方便快速对比黄大茶加工过程挥发性成分的差异,利用系统自带LAV软件内置插件(Gallery Plot),重构黄大茶加工过程样品离子峰的指纹图谱[35],如图2。图中每一行为一个茶叶加工样品的指纹图谱,横轴为检测的挥发性成分。同GC-IMS谱图,指纹图谱中颜色的深浅表示挥发性成分含量的高低。
从图2可知,黄大茶加工过程挥发性成分组成及分布不同,不同加工过程有其特征峰区域[20]。a、b、c为FTL~RY-LYT的特征峰区域,包括的挥发性成分主要为3-呋喃甲醇、环己酮及3-甲基丁酸等。d区为FTL~PR-LYT的特征峰区域,包括的挥发性成分为乙酮和乳酸乙酯。e区为F-LYT~LYT的特征峰区域,主要在黄大茶加工过程中产生的挥发性成分,包括2-乙酰呋喃和2-甲基噻吩。f、h和i区域为LYT的特征峰区域,在经历拉老火工序后其含量显著性增加,主要包括苯甲醛、2,5-二甲基呋喃、糠醛及二甲基二硫等挥发性成分。g区为闷黄样品的特征峰区域,区间的挥发性成分在两次闷黄过程中含量均较高,主要包括乙醇和反-2-己烯醇等。由图2可知,黄大茶加工过程挥发性成分的组成大致相同,只是在不同加工过程中的含量和比例不同,而拉老火工序前后挥发性成分的含量变化较为明显
2.4 GC-IMS主成分分析
为了更加直观的判别区分并可视化黄大茶加工过程挥发性成分的差异,对其挥发性成分进行主成分分析。如图3所示,主成分1和2的方差贡献率分别为65.0% (PC1)和15.5%(PC2),PC1和PC2的累计贡献率为80.5%[19]。从图3可以看出,除了杀青与揉捻有部分区域重叠外,其余加工过程均能够较好的分离。其中,鲜叶和黄大茶之间的距离较远,表明两者之间风味存在较大差异。鲜叶历经黄大茶加工过程,风味特征发生较大改变,更加印证了茶叶加工对茶叶风味品质形成的重要性。杀青、揉捻及初烘之间距离较近,而与鲜叶距离较远,杀青过后,茶叶中酶被钝化,挥发性成分的生成与酶的催化反应无关[36],因此与鲜叶的挥发性成分有较大差异。闷黄是黄茶加工中特有的工序,在此过程中产生了一些特异的挥发性成分[37],挥发性成分中1-辛烯-3-酮,苯乙酮,丁酸乙酯,2,4-庚二烯醛和丙酸在初闷过程中开始检测得到,且后两类成分在闷黄过程(初闷和复闷)样品中的相对含量较高,而复烘的烘焙强度弱于拉老火的烘焙强度,导致两者挥发性成分差异显著,因此主成分分析图上呈现出闷黄(初闷和复闷)及复烘与其他加工过程之间距离较远。综上表明,GC-IMS技术通过对茶叶挥发性成分的测定,能够对黄大茶加工过程进行较好地判别和区分。
由以上可知,GC-IMS检测过程中样品前处理简单,单个样品的检测时长较短,只有21 min,少于常规的GC-MS检测用时(60 min左右)[6],且无溶剂及高温影响。同时,GC-IMS可以实现茶叶挥发性成分的二次分离,有效地提高了挥发性成分的分离及检出效率,通过对GC-IMS二维谱图及相关指纹图谱的绘制,可以直观呈现并明析黄大茶不同加工过程的特征峰区域,利用PCA分析可以对黄大茶及其加工过程进行较好的区分。而且,只在GC-IMS方法中鉴定出低沸点挥发性成分2-二甲二硫和2-乙基二硫。相较于传统的茶叶挥发性成分检测分析方法,GC-IMS可以大大缩短样品前处理及实际检测时间,具有快速、高效、简单且环保的特点,为黄大茶加工过程的区分和判别、品质控制和评价方法提供了一定参考依据和理论基础。同时,可为茶叶挥发性成分分析及加工过程监测提供借鉴。
3 结 论
本文利用GC-IMS技术对黄大茶及其加工过程样品的挥发性成分进行检测分析,并以鉴定出的挥发性成分对黄大茶加工过程进行主成分分析,得到如下结论:
1)黄大茶及其加工过程样品中总共鉴定出挥发性成分40种,主要从属于醇类、酮类、醛类、酯类及杂环类化合物。其中,杂环类、酯类及醇类化合物的相对含量较高,在每个加工样品中的相对含量均大于10.00%,而酮类化合物的相对含量在初闷及以后的样品中相对含量均小于5.00%。
2)杂环类和醛类化合物是黄大茶(LYT)挥发性成分的主体部分,具有最高的相对含量,分别为28.76%和22.63%。
3)杂环类及醛类化合物的相对含量在初烘之后增加,且(,)-2,4-庚二烯醛(单聚体和二聚体)、(,)-2,4-庚二烯醛(单聚体和二聚体)只在初烘之后的茶叶样品中得到鉴定,而氧化芳樟醇及2-苯乙醇在初烘之后的样品中未能检出。
4)苯甲醛、2,5-二甲基呋喃、糠醛及二甲基二硫等挥发性成分构成了黄大茶(LYT)的特征峰区域。
5)主成分分析表明鲜叶与黄大茶(LYT)的香气特征差异较大,与其挥发性成分及特征化合物组成不同有关,在一定程度上揭示了茶叶加工过程对黄大茶香气特征形成的重要性。
[1] Xu N, Chu J, Wang M, et al. Large yellow tea attenuates macrophage-related chronic inflammation and metabolic syndrome in high-fat diet treated mice[J]. Journal of Agricultural and Food Chemistry, 2018, 66(15): 3823-3832.
[2] Guo X, Ho C T, Schwab W, et al. Effect of the roasting degree on flavor quality of large-leaf yellow tea[J]. Food Chemistry, 2021, 347, 129016.
[3] Guo X, Ho C T, Schwab W, et al. Aroma compositions of large-leaf yellow tea and potential effect of theanine on volatile formation in tea[J]. Food Chemistry, 2019, 280: 73-82.
[4] 尹志,胡冬. 茶叶感官审评方法中存在的若干问题分析[J]. 茶叶,2015,41(1):15-18. Yin Zhi, Hu Dong. A discussion on the methodology of tea sensory assessment[J]. Journal of Tea, 2015, 41(1): 15-18. (in Chinese with English abstract)
[5] Ho C T, Zheng X, Li S M. Tea aroma formation[J]. Food Science and Human Wellness, 2015, 4(1): 9-27.
[6] 朱晓凤,刘政权,宛晓春,等. SDE和HS-SPME结合GC-MS分析霍山黄大茶香气成分的比较[J]. 食品科学,2020,41(4):214-221. Zhu Xiaofeng, Liu Zhengquan, Wan Xiaochun, et al. Comparison of simultaneous distillation and extraction and headspace-solid phase microextraction for analysis of aroma components of Huoshan Large-leaf yellow tea by Gas Chromatography-Mass Spectrometry[J]. Food Science, 2020, 41(4): 214-221. (in Chinese with English abstract)
[7] Guo X, Song C, Ho, C T, et al. Contribution of L-theanine to the formation of 2, 5-diemthylpyrazine, a key roasted peanutty flavor in oolong tea during manufacturing processes[J]. Food Chemistry, 2018, 263: 18-28.
[8] Wang L F, Lee J Y, Chung J O, et al. Discrimination of teas with different degrees of fermentation by SPME-GC analysis of the characteristic volatiles flavour compounds[J]. FoodChemistry, 2008, 109(1): 196-206.
[9] Hernández-Mesa M, Ropartz D, García-Campaña A M, et al. Ion mobility spectrometry in food analysis: Principles, current applications and future trends[J]. Molecules, 2019, 24(15), 2706.
[10] Song H, Liu J. GC-O-MS technique and its applications in food flavor analysis[J]. FoodResearch International, 2018, 114: 187-198.
[11] Peris M, Escuder-Gilabert L. A 21st century technique for food control: Electronic noses[J]. Analytica Chimica Acta, 2009, 638(1): 1-15.
[12] 程沙沙,陈创,王卫国,等. 一种基于离子迁移谱的气相色谱检测器及其应用[J]. 色谱,2011,29(9):901-907. Chen Shasha, Chen Chuang, Wang Weiguo, et al. A novel gas chromatography detector based on ion mobility spectrometry technology and its application[J]. Chinese Journal of Chromatography, 2011, 29(9): 901-907. (in Chinese with English abstract)
[13] Cumeras R, Figueras E, Davisc E, et al. Review on ion mobility spectrometry. Part 1: current instrumentation[J]. Analyst, 2015, 140(5): 1376-1390.
[14] Wang S, Chen H, Sun B. Recent progress in food flavor analysis using gas chromatography-ion mobility spectrometry (GC-IMS)[J]. Food Chemistry, 2020, 315, 126158.
[15] 李娟,任芳,甄大卫,等. 气相色谱-离子迁移谱分析几种乳制品挥发性风味化合物[J]. 食品科学(2020-08-04) https://kns.cnki.net/kcms/detail/11.2206.TS.20200803.1617.084.html
Li Juan, Ren Fang, Zhen Dawei, et al. Analysis of volatile flavor compounds in several dairy products by gas chromatography-ion mobility spectrometry[J]. Food Science(2020-08-04)https://kns.cnki.net/kcms/detail/11.2206.TS.20200803.1617.084.html (in Chinese with English abstract)
[16] Vera L, Companioni E, Meacham A, et al. Real time monitoring of VOC and odours based on GC-IMS at wastewater treatment plants[J]. Chemical Engineering Transactions, 2016, 54: 79-84.
[17] Gerharde N, Birkenmeier M, Sanders D, et al. Resolution-optimized headspace gas chromatography-ion mobility spectrometry (HS-GC-IMS) for non-targeted olive oil profiling[J]. Analytical & Bioanalytical Chemistry, 2017, 409(16): 3933-3942.
[18] 葛含光,温华蔚,宋旭,等. 离子迁移谱法检测蒸馏酒中4种风味成分[J]. 食品安全质量检测学报,2016,7(2):834-838. Ge Hanguang, Wen Huawei, Song Xu, et al. Determination of 4 flavor components in distilled liquor by ion mobility spectrometry[J]. Journal of Food Safety and Quality, 2016, 7(2): 834-838. (in Chinese with English abstract)
[19] 杜萍,陈振佳,杨芳,等. 基于顶空气相色谱-离子迁移谱技术的生咖啡豆快速鉴别方法[J]. 食品科学,2019,40(24):228-233. Du Ping, Chen Zhenjia, Yang Fang, et al. A rapid method for the discrimination of different varieties of green coffee beans by headspace-gas chromatography-ion mobility spectrometry[J]. Food Science, 2019, 40(24): 228-233. (in Chinese with English abstract)
[20] 陈通,陆道礼,陈斌. GC-IMS 技术结合化学计量学方法在食用植物油分类中的应用[J]. 分析测试学报,2017,36(10):1235-1239. Chen Tong, Lu Daoli, Chen Bin. Application of headspace/gas chromatography-tandem ion mobility spectrometry with chemometrics in classification of edible vegetable oils[J]. Journal of Instrumental Analysis, 2017, 36(10): 1235-1239. (in Chinese with English abstract)
[21] Wang K B, Ruan J Y. Analysis of chemical components in green tea in relation with perceived quality, a case study with Longjing teas[J]. International Journal of Food Science & Technology, 2009, 44(12): 2476–2484.
[22] 刘畅,罗玉龙,窦露,等. 亚麻籽饲喂对苏尼特羊肉风味品质的影响[J]. 农业工程学报,2019,35(21):304-311. Liu Chang, Luo Yulong, Dou Lu, et al. Effect of feeding flaxseed on meat flavor quality of Sunit lambs[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(21): 304-311. (in Chinese with English abstract)
[23] Wang D M, Yoshimura T, Kubota K, et al. Analysis of glycosidically bound aroma precursors in tea leaves. 1. Qualitative and quantitative analyses of glycosides with aglycons as aroma compounds[J]. Journal of Agriculture and Food Chemistry, 2000, 48(11): 5411-5418.
[24] Guo W F, Sasaki N, Fukuda M, et al. Isolation of an aroma precursor of benzaldehyde from tea leaves (var.cv. Yabukita)[J]. Bioscience, Biotechnology, Biochemistry, 1998, 62(10): 2052–2054.
[25] Wang X, Guo M, Song H, et al. Characterization of key aroma compounds in traditional Chinese soy sauce through the molecular sensory science technique[J]. LWT – Food Science and Technology, 2020, 128: 109413.
[26] Bonneau A, Boulanger R, Lebrun R, et al. Aroma compounds in fresh and dried mango fruit (feraL. cv. Kent): impact of drying on volatile composition[J]. International Journal of Food Science & Technology, 2016, 51(3): 789-800.
[27] Holland R, Liu S Q, Crow V L, et al. Esterases of lactic acid bacteria and cheese flavor: Milk fat hydrolysis, alcoholysis and esterification[J]. International Dairy Journal, 2005, 15(6): 711-718.
[28] Tian T, Sun J, Wu D, et al. Objective measures of greengage wine quality: From taste-active compound and aroma-active compound to sensory profiles[J]. Food Chemistry, 2021, 341, 128179.
[29] 代宇佳,罗晓峰,周文冠,等. 生物和非生物逆境胁迫下的植物系统信号[J]. 植物学报,2019,54(2):255-264. Dai Yujia, Luo Xiaofeng, Zhou Wenguan, et al. Plant systemic signaling under biotic and abiotic stresses conditions[J]. Chinese Bulletin of Botany, 2019, 54(2): 255-264. (in Chinese with English abstract)
[30] Zamora R, Hidalgo F J. Formation of heterocyclic aromatic amines with the structure of aminoinidazoazarenes in food products[J]. Food Chemistry, 2020, 313, 126128.
[31] 何余勤,胡荣锁,张海德,等. 基于电子鼻技术检测不同焙烤程度咖啡的特征性香气[J]. 农业工程学报,2015,31(18):247-255. He Yuqin, Hu Rongsuo, Zhang Haide, et al. Characteristic aroma detection of coffee at different roasting degree based on electronic nose[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(18): 247-255. (in Chinese with English abstract)
[32] Oliveira M L D, Pergher S B C, Pontes D D A, et al. 2-Methylthiophene reactions on modified KSF clays[J]. Molecular Catalysis, 2020, 493, 111085.
[33] Zhang L, Ku K M. Biomarkers-based classification between green teas and decaffeinated green teas using gas chromatography mass spectrometer coupled with in-tube extraction (ITEX)[J]. Food Chemistry, 2019, 271: 450-456.
[34] Pickard S, Becker I, Mera K H, et al. Determination of the alkylpyrazine composition of coffee using stable isotope dilution-gas chromatography-mass spectrometry (SIDA-GC-MS)[J]. Journal of Agricultural and Food Chemistry, 2013, 61: 6274-6281.
[35] Arroyo-manzanares N, Martin-gomez A, Jurado-campos N, et al. Target vs spectral fingerprint data analysis ofIberian ham samples for avoiding labelling fraud using headspace-gas chromatography-ion mobility spectrometry[J]. FoodChemistry, 2018, 246: 65-73.
[36] Kuo P C, Lai Y J, Yang W H, et al. Changes in volatile compounds upon aging and drying in oolong tea production[J]. Journal of the Science of Food and Agriculture, 2011, 91(2): 293-301.
[37] 范方媛,杨晓蕾,龚淑英,等. 闷黄工艺因子对黄茶品质及滋味化学组分的影响研究[J]. 茶叶科学,2019,39(1):63-73. Fan Fangyuan, Yang Xiaolei, Gong Shuying, et al. The effect of technological factors on yellow tea quality and taste-chemical constituents in the yellowing process[J]. Journal of Tea Science, 2019, 39(1): 63-73. (in Chinese with English abstract)
Analysis of volatile compounds in large-leaf yellow tea during manufacturing processes using gas chromatography-ion mobility spectrometry
Guo Xiangyang1,2, Huo Yujia3, Wang Benyou3, Wan Xiaochun1※
(1.,,230036,;2.,,518060,3.,251500,)
Large-leaf yellow tea (LYT) is a classical beverage with a unique carameltaste similar to the fried rice flavor in Asian areas. LYT processing substantially determines the quality grade of tea, volatile composition, and aroma profile. However, the aroma property and volatile compounds of LYT still remain unclear during processing. This study aims to clarify the volatile compositions and variations in the processing of LYT using the gas chromatography-ion migration spectrometry (GC-IMS), coupled with principal component analysis (PCA). The reason was that the GC-IMS technology was characterized by fast, simple, efficient, and environmentally friendly. A total of 40 volatile compounds were identified, including alcohols, ketones, aldehydes, esters, and heterocyclic compounds. Among the identified volatile compounds, the main volatile compounds in LYT were heterocyclic compounds and aldehydes. Moreover, the relative numbers of heterocyclic compounds increased significantly with the process of tea after fixing treatment. Meanwhile, the relative content of aldehydes enhanced dramatically, whereas those of alcohols and ketones compounds decreased remarkably after primary roasting. In addition, the linalool oxide (-furanoid) with floral odor was only identified in the previous samples with primary roasted treatment, where the highest relative amount accounted for 21.98 % of the total found in fresh tea leaves (FTL). The 1-octen-3-one and acetophenone were only identified in tea samples after primary roasted processing. Furthermore, the differential profiles and chromatographic fingerprint of LYT during processing were established using the volatile compounds detected by GC-IMS technology. The characteristic chromatographic regions consisted of benzaldehyde, 2,5-dimethylfuran, furfurol and dimethyl disulfide in the full-fire processing of LYT. A PCA analysis was performed on the identified volatile compounds to further distinguish LYT processes, where the accumulated contribution rate of the first two principal components (PC 1 for 65.0 %, PC 2 for 15.5 %) was 80.5 %, indicating that the GC-IMS was useful to discriminate the LYT samples of different processes. The tea samples were separated according to the processes, where there was a far distance between FTL and LYT, indicating that the tea processing was vitally important to the formation of aroma characteristics of LYT. The findings can provide new insight into the determination of volatile compounds for better monitoring process and quality control of tea.
flavor; quality control; large-leaf yellow tea (LYT); gas chromatography-ion mobility spectrometry (GC-IMS); volatile compounds; tea manufacturing; discrimination
郭向阳,霍羽佳,王本友,等. 采用气相色谱-离子迁移谱分析黄大茶加工过程挥发性成分[J]. 农业工程学报,2021,37(6):274-281.doi:10.11975/j.issn.1002-6819.2021.06.033 http://www.tcsae.org
Guo Xiangyang, Huo Yujia, Wang Benyou, et al. Analysis of volatile compounds in large-leaf yellow tea during manufacturing processes using gas chromatography-ion mobility spectrometry[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(6): 274-281. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.06.033 http://www.tcsae.org
2020-10-23
2020-12-25
国家自然科学基金面上项目(32072634)
郭向阳,博士,工程师,研究方向为风味化学、茶叶加工与品质化学。Email:xiangyang.guo@ahau.edu.cn
宛晓春,教授,博士生导师,研究方向为茶叶加工与品质化学。Email:xcwan@ahau.edu.cn
10.11975/j.issn.1002-6819.2021.06.033
S571.1
A
1002-6819(2021)-06-0274-08
