胎牛肺间充质干细胞对脂多糖介导小鼠急性肺损伤治疗的研究
2021-06-02殷佳辉孙宇辰朱晓峰邹志田
殷佳辉,王 琪,孙宇辰,朱晓峰,乔 峰,邹志田
(1.佳木斯大学附属第一医院心胸外科,黑龙江 佳木斯 154002;2.佳木斯大学基础医学院,黑龙江 佳木斯 154002;3.佳木斯传染病医院检验科,黑龙江 佳木斯 154002;4.佳木斯大学生命科学学院,黑龙江 佳木斯 154002)
间充质干细胞(mesenchymal stem cells,MSCs)是一种具有自我更新能力和多向分化能力的多能干细胞[1-4]。病理状态下,间充质干细胞可以在炎症介质的刺激下,通过迁移和归巢作用参与损伤部分的修复[5],也可以通过静脉或局部注射路径迁移到损伤部位,进而发挥一系列生物效应[6]。因MSCs表面表达低水平Ⅰ型白细胞抗原(HLA),不表达Ⅱ型主要组织相容性抗原(MHC-Ⅱ)和T细胞共刺激分子,具有低免疫原性,可为异体MSCs治疗提供理论依据[7]。急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是急性肺损伤(ALI)最严重的形式,病死率较高,目前尚无特异有效的治疗措施[8],因此研究的重点仍是寻找有效的治疗方法。本研究对胎牛肺间充质干细胞(lung-derived mesenchymal stem cells,LMSCs)进行分离培养及鉴定,并通过腹腔注射LPS造小鼠急性肺损伤模型,然后将LMSCs移植到急性肺损伤的小鼠体内,观察LMSCs对急性肺损伤治疗作用,为异源干细胞进行临床治疗提供实验理论依据。
1 材料与方法
1.1 材料来源 本实验对象3个月龄胎牛购自中国农科院家畜实验基地,6周龄雄性小鼠购自北京华阜康生物有限公司。LPS购自北京索莱宝科技有限公司,α-MEM培养基、胎牛血清(FBS)、山羊血清、谷氨酰胺购自美国GIBCO公司;胰蛋白酶(Trypsin 1∶250)、Triton X-100IV型胶原酶、PI购自美国Sigma公司;多聚甲醛和青链霉素购自北京化工厂;小鼠抗牛抗体购自Abcam公司产品;FITC标记兔抗小鼠二抗购自中杉金桥;RNA提取试剂盒TRI reagent、反转录试剂盒和extap酶购自TaKaRa公司。
1.2 方法
1.2.1 胎牛LMSCs的分离培养 取3月龄流产胎牛肺脏,在准备间初步消毒后移至细胞间无菌操作台内,连同取样工具一同紫外照射15 min,剖开胎牛胸腔,完整取出胎牛肺脏至培养皿内,然后用无菌眼科镊子、眼科剪缓慢剥离胸膜,将肺组织及支气管用PBS反复冲洗10遍,去除血细胞等杂质,将清洗干净的肺组织及支气管剪成约1~3 mm2织碎块,转移至新养皿中,加入10 ml 0.2%Ⅳ型胶原酶,移至37 ℃的5% CO2培养箱中酶消30 min~1 h,直至组织出现匀浆时取出,终止消化,过筛,离心,重悬,制单细胞悬液,接种到新皿,CO2培养箱培养,标记P0代,定期换液当细胞达90%融合时可细胞传代,传代比例为1传2。
1.2.2 胎牛肺LMSCs的生长曲线 选取P5、P10及P15代LMSCs,以1.0×104个/ml密度接种到24孔板培养,取对数生长期LMSCs用血球计数板进行细胞计数。
1.2.3 RT-PCR鉴定 登录NCBI网站,检索获取LMSCs基因序列并设计引物(表1),对LMSCs进行基因学鉴定。

表1 LMSCs基因引物序列
1.2.4 免疫荧光鉴定 取P5代纯化后的LMSCs,LMSCs生长达皿底70%左右时弃旧培养基,PBS反复冲洗,4%多聚甲醛固定20 min,0.25%Triton X-100通透10 min,PBS漂洗,10%山羊血清阻断非特异性抗体,加一抗(鼠抗牛CD29、CD44、CD73、CD166)避光孵育1 h,PBS漂洗,滴加FITC标记兔抗鼠IgG二抗30 min,PBS漂洗后DAPI染色1 h,加少量PBS移至共聚焦显微镜下观察。
1.2.5 动物模型准备 准备72只雄性小鼠,随机分为3组,标记为对照组、损伤组(LPS组)及治疗组(LPS+LMSCs组),小鼠需进行2周适应性饲养。对照组行腹腔注射生理盐水,剂量为10 mg/kg,损伤组组行腹腔注射LPS(10 mg/kg),治疗组先行腹腔注射LPS后立即给予移植LMSCs,移植密度1×106/皿。在每组中设置3个时间节点:6、24、48 h处理小鼠,每个时间节点设置3组平行组。
1.2.6 小鼠模型ELISA检测 采血管收集小鼠血清,在2 ℃~8 ℃环境下静置1~2 h,3000 r/min离心15 min,取上清液备ELISA检测。
1.3 统计学方法 利用GraphPad Prism 8.0软件进行数据分析并绘制图表。计量资料以()表示,组间比较采用Student’st检验,多组间比较采用Oneway ANOVA with Tukey’s post hoc检验。当P<0.05时表示差异有统计学意义。
2 结果
2.1 胎牛LMSCs的形态观察 利用倒置显微镜观察,采用酶消法及贴壁法分离培养出的贴壁生长的LMSCs形态,可见原代初期细胞生长缓慢成团生长,P3以后细胞形态整体稳定,立体感减弱,细胞多呈长梭形或纺锤形,核质比大,边缘不规则。胎牛肺间充质干细胞至少可传至15代以上,P15以后生长速度减缓,细胞形态出现扁平不规则样生长。研究证明体外分离、培养的胎牛肺间充质干细胞在适宜的培养条件下可以增殖并维持干细胞生长特性,见图1。
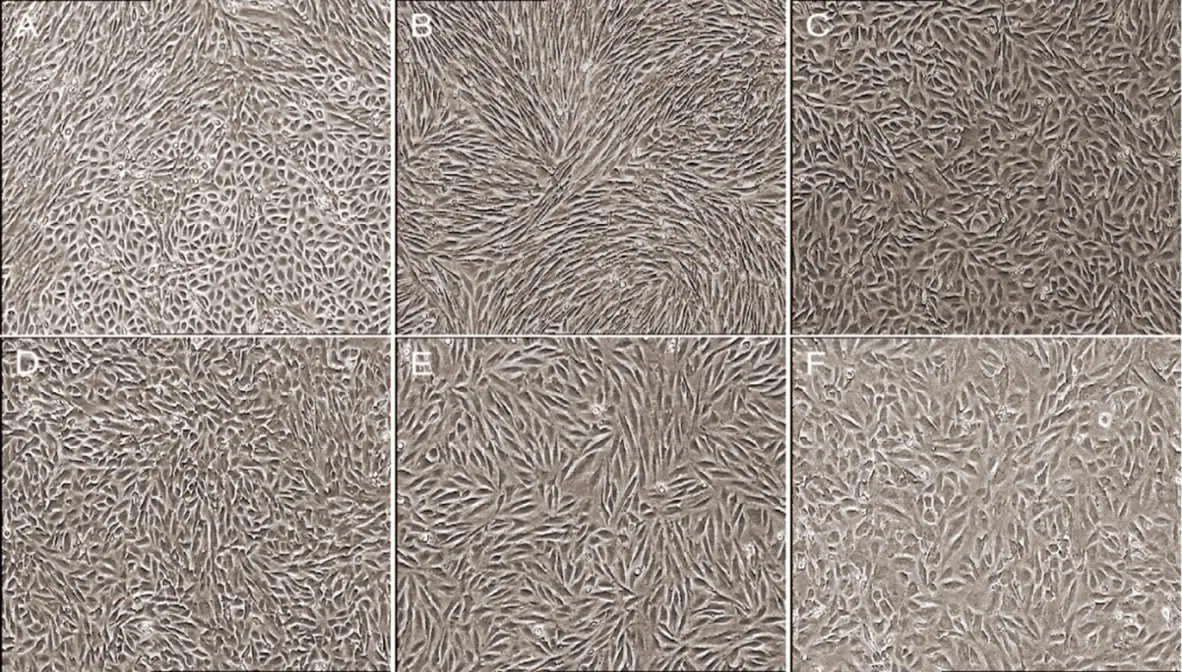
图1 LMSCs的形态学观察(×40)
2.2 生长曲线测定 利用血球计数板对P5、P10、P15的LMSCs进行细胞计数,由生长曲线可见LMSCs增殖均依次经历潜伏期、对数生长期及平台期。潜伏1~2 d后细胞增殖迅速,约7 d增殖减慢进入平台期。群体倍增时间随代次增高而延长。考虑细胞增殖速度与细胞活力相关,本实验后期选用纯化后的P5代细胞进行LMSCs的移植治疗,以期最佳治疗修复作用,见图2。
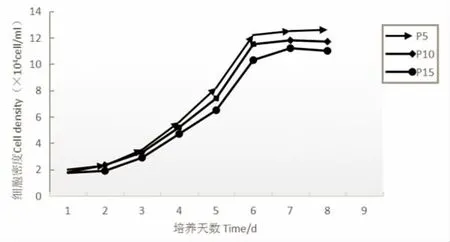
图2 LMSCs生长曲线
2.3 RT-PCR检测表面标记物 经RT-PCR鉴定,细胞表达CD29、CD44、CD73、CD166,不表达CD31,证明分离培养的细胞确定是LMSCs,见图3。
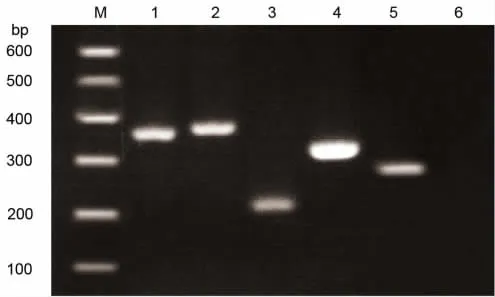
图3 LMSCsd的RT-PCR检测
2.4 免疫荧光检测表面标记物 LMSCs阳性表达CD29、CD44、CD73和CD166,证明所分离培养的细胞为LMSCs,见图4。
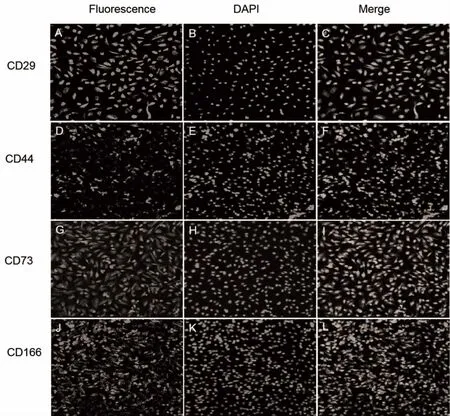
图4 LMSCs表面标记荧光表达(×40)
2.5 病理学切片观察 镜下观察对照组小鼠肺泡壁结构完整,肺泡间质无渗出大小相近,存在正常的肺泡结构,无炎症细胞出现在管壁及周围,无胶原蛋白沉淀。损伤组小鼠肺组织出现大面积肺泡结构受损,大多数正常肺泡结构消失,肺泡腔改变可见变形闭塞,大量炎症细胞浸润,结构变性和异常的胶原蛋白沉淀,损伤作用时间越长,损伤程度加重。治疗组小鼠在LMSCs移植治疗后观察肺损伤病变面积和损伤程度较LPS组下降,可见炎症细胞浸润减少、间质有所增厚及胶原少量沉积,肺切片更接近于正常肺组织肺泡形态,见图5。
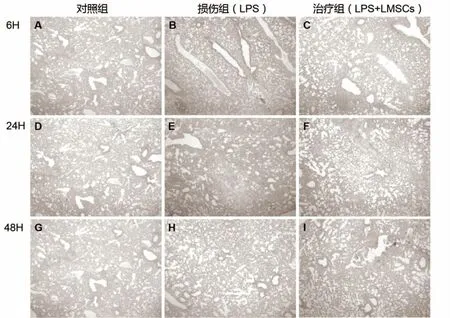
图5 小鼠急性肺损伤模型HE染色病理学改变(×40)
2.6 ELISA血清检查结果分析 损伤组6、24、48 h血清TNF-α、IL-4、IL-6水平高于治疗组和对照组,且治疗组高于对照组,差异有统计学意义(P<0.05),见图6。
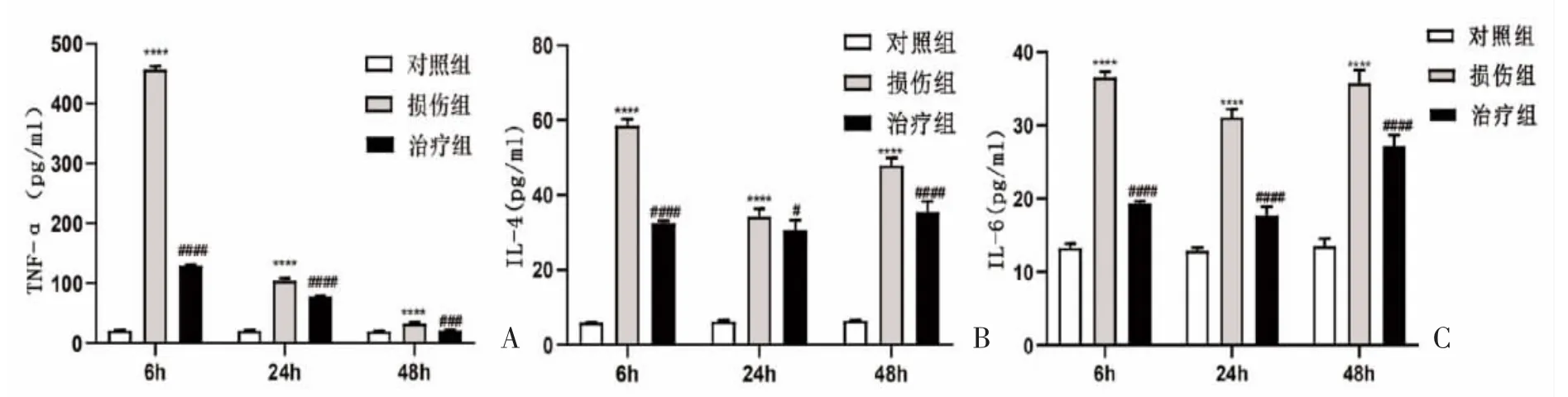
图6 小鼠模型ELISA血清学检查结果
3 讨论
目前MSCs已从骨髓、脂肪组、脐带血织等组织中成功分离并用于相关动物实验及临床试验当中,但鲜有LMSCs用于ALI治疗的研究报道,本实验成功从3个月胎龄牛肺中分离出LMSCs,在体外环境培养过程中,当细胞传至第P5代,已经基本获得纯化的LMSCs。低代次的间充质干细胞生殖速度较快,随着代次的增加,增殖速度逐渐降低。低代次的LMSCs细胞形态稳定,多呈纺锤形或长梭形,随着培养代次的逐渐升高,LMSCs的形态可见分叉样等改变。在细胞传至P15代以上时,生长速度逐渐放缓,高代次LMSCs生长活力下降。通过RT-PCR和免疫荧光化学鉴定手段对LMSCs进行鉴定,LMSCs表达基因CD29、CD44、CD73、CD166,不表达CD31,证明本实验通过体外分离培养技术得到的目的细胞是LMSCs,且其保持间充质干细胞的生物学特性。
急性呼吸窘迫综合征(ARDS)是急性肺损伤(ALI)最严重的形式,肺部的感染性疾病尤其是细菌性肺炎是ARDS最常见的病因。肺炎进展过程中,TNF-α、IL-4及IL-6等因子释放,促进大量中性粒细胞渗出聚集在肺泡周围,激活并释放活性氧、蛋白酶、白三烯等介质,进一步加重损伤。本研究结果显示,损伤组6、24、48 h血清TNF-α、IL-4、IL-6水平高于治疗组和对照组,且治疗组高于对照组,差异有统计学意义(P<0.05)。有研究发现[9],角质细胞生长因子7(KGF-7)在内皮细胞再生和损伤修复中具有重要作用,可减轻ALI动物模型的肺泡水肿。过表达KGF-7的MSCs改善了微血管通透性,抑制了TNF-α 等促炎因子的释放,保护正常肺组织。IL-6可加剧肺部损伤,研究表明[10,11],其作用机制是参与中性粒细胞在肺部的聚集,而TNF-α 具有促进IL-6分泌的作用,LMSCs通过抑制TNF-α 促炎因子的释放,间接抑制IL-6的分泌,从而达到降低肺部炎症反应的效果。IL-4可刺激肺内成纤维细胞增生,引起肺纤维化[12]。本研究中治疗组小鼠IL-4水平较损伤组降低,降低了肺纤维化程度,起到了保护肺组织的作用。目前已有3项已完成的MSCs治疗ARDS的临床试验,一项干细胞来源是异体脂肪来源的MSCs[13],其余两项是骨髓来源的MSCs[14,15],但MSCs的最佳来源、合理剂量、给药时间及给予方式仍无统一标准,如何进一步优化MSCs的疗效仍是未来研究的重点。
总之,胎牛LMSCs在体外培养体系中可以稳定的保持其生物学特性,低代次LMSCs具有良好的增殖活性及分泌细胞因子的能力,可以有效降低LPS诱导的小鼠急性肺损伤血清中TNF-α 水平,参与调控IL-4、IL-6的分泌及免疫应答作用,提示胎牛LMSCs对急性炎性反应有一定治疗作用。
