60Co γ射线对大鼠性激素水平以及PI3K/Akt信号通路蛋白表达的影响
2021-06-01赵粉琴苟雅姣胡芝霞刘小莉李春瑶谢知慧李淑萍
赵粉琴,苟雅姣,胡芝霞,刘小莉,李春瑶,谢知慧,李淑萍
(1.甘肃中医药大学中西医结合学院,甘肃 兰州 730000;2.甘肃省人民医院放疗科,甘肃 兰州 730000)
卵巢是女性重要的内分泌器官,具有内分泌和生殖功能.随着肿瘤的年轻化,化疗和放疗是治疗恶性肿瘤及自身免疫性疾病的重要手段,其对卵巢产生的不可避免的损伤已经成为诱发卵巢早衰(Premature ovarian failure,POF)的主要原因之一[1-2],严重影响女性生殖内分泌功能.明确放疗引起POF的分子机制对预防POF尤为重要.卵泡是维持卵巢功能的物质基础,卵巢的储备功能由卵巢内原始卵泡数决定,原始卵泡池的大小反应了卵巢寿命的长短,过度耗竭将导致POF,PI3K/Akt信号通路的平衡对于原始卵泡池的维持、生长和存活至关重要[3].目前,关于放疗引起POF的分子机制尚不明确,有研究表明,放疗辐射会激活PI3K/Akt通路[4-5],放疗导致卵巢早衰的机制是如何进行调控的,目前研究较少.本研究用60Co γ射线对大鼠进行照射,通过大鼠卵巢组织病理学,分析血清激素水平以及卵巢内PI3K/Akt信号通路蛋白表达情况,探讨辐射对卵巢组织损伤的分子机制,为证明辐射损伤导致POF提供理论依据.
1 试验方法
1.1 试验动物及试剂
1.1.1 试验动物以及模型制备 雌性SPF级SD大鼠6月龄40只(200±20)g,由甘肃中医药大学实验动物中心提供,实验动物许可证号:SYXK(甘)2004~0006.在自然光照条件下饲养,自由摄食、饮水,保持室温20~25 ℃,3 d后用于试验研究.每组大鼠各20只.随机分为照射组:照射条件:60Co γ射线全身一次性照射6.0 Gy,剂量率1.143~1.21 Gy/min;(照射地点在兰州大学第一医院放疗科,高能直线加速器,型号:ONCOR Impression Plut),照射源皮距为100 cm,在10 cm×10 cm特制铅模中,照射野大小为2.0cm×2.0cm照射范围.;正常组:不进行照射,普通喂养.照射后大鼠进行无菌饲养(房间用1∶5 000浓度的高锰酸钾喷洒消毒,空气用紫外线灯照射30 min,2次/日,饲料、水及垫料均经高压灭菌).
1.1.2 主要试剂 Akt(厂家:SantaCruz,货号:sc-81434,规格:50 μg)、磷酸化Akt(厂家:SantaCruz,货号:sc-514032,规格:200 μg)、Foxo3a(厂家:Abcam,货号:ab70314,规格:100 μL,)、磷酸化Foxo3a(厂家:Abcam,货号:ab47285,规格:100 μg)蛋白单克隆抗体.蛋白电泳仪(厂家:Bio-rad,型号:164-5050).
1.2 观察指标及检测方法
1.2.1 大鼠动情周期观察以及阴道脱落细胞检测 每天早上9:00进行阴道脱落细胞涂片观察.以生理盐水润湿棉签,取阴道脱落细胞涂于载玻片,自然干燥,甲醇固定1 min,室温自然干燥,快速瑞姬氏染液染色,PBS冲洗3次,于光学显微镜下观察.根据阴道涂片表现,正常大鼠动情周期4~5 d,包括动情前期、动情期、动情后期以及动情间期;雌性大鼠动情周期的判断[6]:镜下见大量有核上皮细胞和少量白细胞为动情前期;镜下见大量角质化、大而无规则的无核上皮细胞为动情期;有核上皮细胞、角化上皮细胞和白细胞均存在为动情后期;大量白细胞和少量角质化细胞为动情间期.若动情周期延长至7 d以上,或者无明显的周期表现,持续处于动情间期,则动情周期紊乱.
1.2.2 大鼠血清性激素水平的检测 分别于照射前,照射后第1、3、7、14、21天断尾采血,将所采血液接入1.5 mL离心管中,在4 ℃以3 000 r/min离心10 min,取出离心管,使用移液枪吸取上层血清移入新的离心管中,标记存放在-20 ℃冰箱内备用.采用ELISA法检测血清卵泡刺激素(FSH)、雌激素(E2)和黄体生成素(LH),按试剂盒操作步骤进行,96孔检测,设置空白孔(不加样),标准孔(加样50 μL),待测孔(先加样品稀释液40 μL,再加待测样10 μL),封闭,37 ℃,温育30 min,后洗涤,甩干,后各孔加酶标试剂50 μL(空白孔除外),37 ℃,温育30 min,洗涤,每孔加显色剂A 50 μL,每孔加显色剂B 50 μL轻震荡,显色10 min,每孔再加终止液50 μL,在15 min内使用酶标仪在450 nm波长进行吸光度(D)检测,按照标准品及D值绘制标准曲线,获得直线回归方程式,计算出样品中激素的实际浓度.
1.2.3 TUNEL法观察卵巢组织颗粒细胞凋亡 分别于照射前,照射后第3、7、14、21天,取大鼠4只脱颈椎处死,解剖取出大鼠卵巢组织,各约0.5 cm2大小,用10%福尔马林固定,石蜡包埋,将组织切片备用.参照凋亡检测试剂盒说明书要求进行TUNEL检测:白片脱腊、水化,20 μg/mL蛋白酶K37 ℃孵育15 min,过氧化氢浸泡5 min,每个标本滴加约10 mL的TUNEL反应液,暗室中37 ℃孵育60 min后,PBS冲洗,滴加约50 μL TdT+450 μL荧光素标记的dUTP液混匀,加盖玻片或封口膜在暗湿盒中37 ℃反应60 min.PBS漂洗3次,玻片干燥后在荧光显微镜下计数凋亡细胞(激发光波长为450~500 nm,检测波长为515~565 nm),2组分别取6个卵巢,每个卵巢随机选取一张切片,每张切片随机选取5个视野(600×),试验重复3次.计数两组卵巢切片上卵母细胞凋亡.
1.2.4 卵巢组织切片观察 分别选取照射前,照射后第3、7、14、21天卵巢组织,一部分卵巢组织在4%多聚甲醛PBS中固定过夜(pH 7.6) (PBS,Sigma),转至70%乙醇中处理.固定组织经常规石蜡包埋脱水步骤.卵巢组织切片4 μm,依次在90%、70%、30%的酒精和蒸馏水中进行脱蜡和再水化,另一部分PBS洗涤5 min,苏木精和伊红染色(BDH,普尔,英国)显微镜下观察卵巢组织卵泡变化情况(卵泡数目和发育阶段).
1.2.5 免疫组织化对大鼠卵巢组织蛋白表达的分析 取大鼠卵巢组织各约0.5 cm2大小,用10%福尔马林固定,石蜡包埋,组织切片.石蜡切片经二甲苯脱蜡,梯度酒精脱水,下行至蒸馏水.PBS洗3次,每次5 min.3 %过氧化氢室温避光作用20 min.蒸馏水洗.正常山羊血清封闭液室温作用30 min.倒掉封闭液后,滴加一抗工作液(1∶200),4 ℃孵育过夜.PBS洗3次,每次5 min.滴加辣根过氧化物酶标记的山羊抗兔或小鼠二抗工作液,室温作用30 min.PBS洗3次,每次5 min.滴加DAB显色液,室温避光作用10 min,显微镜下控制显色时间.蒸馏水洗,苏木素染液作用5 min.蒸馏水洗,1%盐酸酒精分色10 s,经0.1 mol/L pH 7.4 PBS作用15 min.经梯度酒精脱水,二甲苯透明后,中性树胶封片,镜下观察.同时设染色对照,PBS替代一抗于4 ℃孵育过夜.观察蛋白表达部位.购买一抗,利用辣根过氧化物酶标记二抗和DAB进行染色.阳性结果以棕黄色或黄色显示.染色后,以显微照相系统观察、拍照.每个卵巢随机选取一张切片,每张切片随机选取5个视野(600×),试验重复3次.将结果输入Image-Pro-Plus图像分析软件,测量卵巢内Akt、磷酸化Akt、Foxo3a、磷酸化Foxo3a蛋白表达阳性部位的平均光密度(optical density,D)值.
1.3 统计方法
2 结果与分析
2.1 大鼠动情周期观察以及阴道脱落细胞检测
2.1.1 大鼠动情周期观察 辐射组大鼠动情周期延长,与正常组比较差异显著(P<0.01).同时大鼠出现毛发脱落,躁动不安,体质量降低等现象(表1).
2.1.2 大鼠阴道脱落细胞检测 正常大鼠阴道细胞涂片观察结果:可见大量角化细胞,形状大而不规则,细胞着色较深;辐射照射后大鼠动情期紊乱,细胞无周期性改变;照射第7天阴道脱落细胞观察结果:角化细胞略减少,细胞染色稍淡;照射第14天阴道上皮细胞体积明显缩小,较幼稚,角化细胞明显减少,渐消失,并逐渐被白细胞所代替;照射后21天,阴道角化细胞明显减少,可见小而圆形,核大的底层细胞,细胞着色较浅(图1~图4).
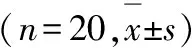
表1 大鼠动情周期观察
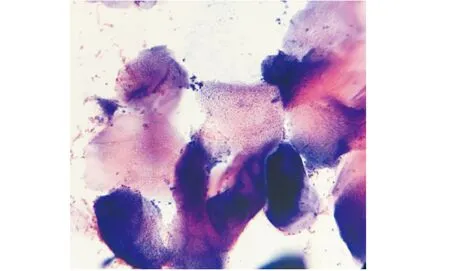
可见大量角化上皮细胞,形状大而不规则,尚有少量上皮细胞.There are numerous keratinized epithelial cells,which are large and irregular in shape and have no nucleus.图1 空白组 HE×100(动情期)Figure 1 Control(estrous phase) HE×100
2.2 大鼠血清性激素水平测定
进行单因素方差分析,认为辐射照射后,大鼠血清FSH、LH水平随着辐射对卵巢功能的损伤而逐渐降低,辐射第21天降到最低,与其他各组(除辐射第14天外)比较,有显著差异(P<0.01);E2水平逐渐降低第7天达到最低(P<0.01),之后有所回升(表2).
2.3 TUNEL法检测卵巢内颗粒细胞凋亡情况
各组之间凋亡细胞数比较,在20倍视野下,10个卵巢组织切片上颗粒细胞凋亡数比较,辐射损伤造成卵巢颗粒细胞明显凋亡(P<0.01);而且随着辐射时间的延长颗粒细胞凋亡数量逐渐增加,在辐射损伤第21天达到高峰(P<0.01),结果见表3.

可见角化细胞亦减少,细胞着色较浅.Note the presence of nucleated cells,a few keratinocytes and leukocytes.图2 照射第7 d HE×100(动情期)Figure 2 Irradiated 7 d(pre-estrus) HE ×100
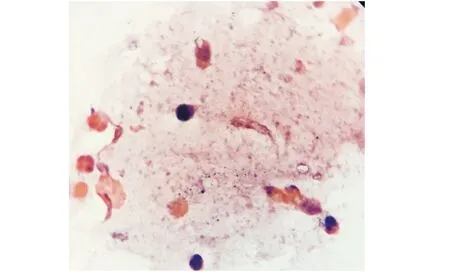
上皮细胞体积小,幼稚,角化细胞少,渐消失,可见白细胞.Large number of leukocytes and a few nucleated cells.图3 照射第14 d HE×100(动情期)Figure 3 Irradiated 14 d(estrous interphase) HE×100
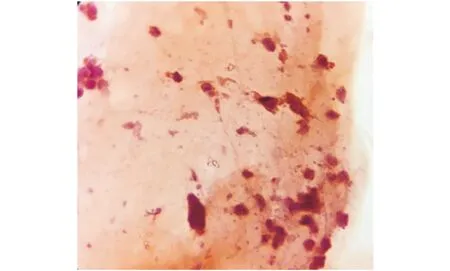
可见角化细胞明显减少,细胞染色稍淡.Lots of white blood cells,slightly more nucleated cells.图4 照射21 d HE×100(动情期)Figure 4 Irradiated 21 d(estrous interphase) HE×100
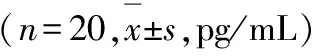
表2 大鼠血清FSH,LH 和E2结果分析

表3 计数辐射损伤不同时间段组卵巢切片上凋亡颗粒细胞数
2.4 大鼠卵巢组织病理学分析
对照组大鼠卵巢正常,形态学观察可见正常发育的卵泡,颗粒细胞层排列整齐(图5).辐射组可见卵泡闭锁.闭锁卵泡的颗粒层松散,大部分的卵泡为无卵细胞(图6).
2.5 免疫组化法测量和标记大鼠卵巢内Akt、磷酸化Akt、Foxo3a、磷酸化Foxo3a蛋白表达
2.5.1 免疫组化法测量大鼠卵巢内Akt、磷酸化Akt、Foxo3a、磷酸化Foxo3a蛋白表达阳性部位的平均光密度值 利用Image-Pro Plus6.0图像分析软件,测定棕黄色信号的累积光密度值(IOD),结果以累积光密度值的数字表示.辐射照射后,大鼠卵巢组织明显受损,检测不同时间段卵巢组织内Akt、磷酸化Akt、Foxo3a、磷酸化Foxo3a蛋白表达,结果显示随着照射时间延长总Akt、p-Akt、Foxo3a 蛋白的表达呈现逐渐增加的趋势(P<0.01),尤以总Akt和Foxo3a蛋白的表达最显著(P<0.01);而p-Foxo3a蛋白表达逐渐下降(P<0.01),尤以辐射第21天最显著(P<0.01).结果见表4,图7.
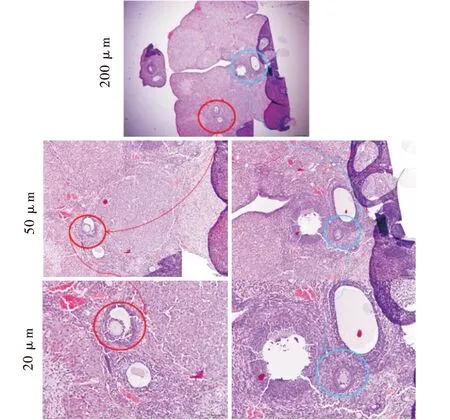
图5 正常大鼠卵巢组织Figure 5 Ovarian tissue of control
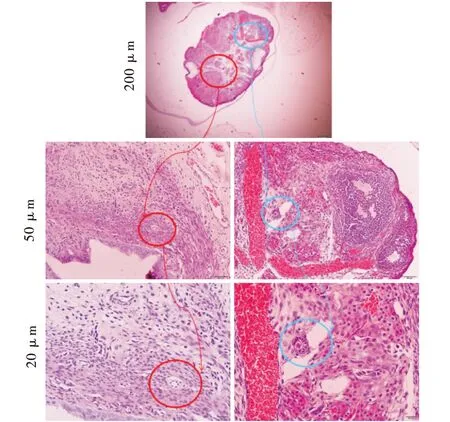
图6 辐射组大鼠卵巢组织Figure 6 Ovarian tissue of radiation

表4 辐射损伤大鼠卵巢组织Akt/Foxo3a通道蛋白表达阳性部位的平均光密度(D)值分析
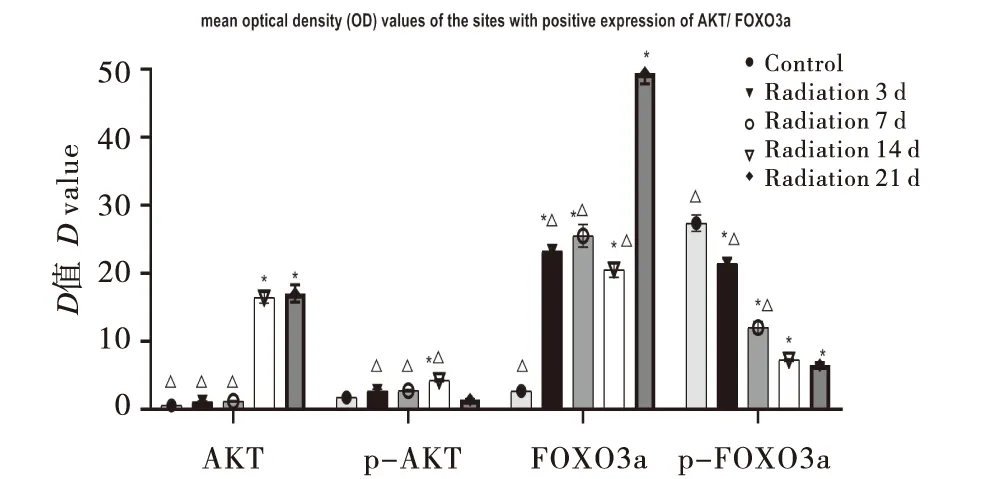
图7 辐射损伤大鼠卵巢组织PI3K/AKT通道蛋白表达Figure 7 Expression of Akt/ Foxo3a channel protein in the ovarian tissue of rats with radiation injury
2.5.2 免疫组化法标记大鼠卵巢内Akt、磷酸化Akt、Foxo3a、磷酸化Foxo3a蛋白表达阳性部位 阳性信号标记为棕黄色,主要见于卵母细胞、黄体细胞(图8~12).
3 讨论
卵巢是对辐射极为敏感的器官,而性腺中卵巢内的卵细胞又是辐射最敏感的细胞.既往有研究表明[7],极低剂量的放射线就能够促进发育过程中的生长卵泡及成熟卵泡走向凋亡,并导致不育.Meirow等[8]研究报道雌性青年大鼠暴露于0.1 Gy的电离辐射两周,原始卵泡几乎完全被破坏.但是辐射损伤的分子机制目前还不明确[9].试验显示对照组大鼠卵巢正常,形态学表现可见正常发育的卵泡,颗粒细胞层排列整齐.辐射组可见卵泡闭锁,闭锁卵泡的颗粒层松散,大部分的卵泡为无卵细胞.阴道脱落细胞检测发现大鼠动情周期消失,出现内分泌紊乱.同时血清学检测卵泡刺激素(FSH)和黄体生成素(LH)水平下降明显(P<0.01),FSH和LH水平明显下降可能与高剂量辐射影响垂体分泌功能,导致两种促性腺激素(FSH和LH)表达量下调有关.此研究与Mahran Y F等[7]研究类似.同时雌二醇(E2)开始下降,到辐射第7天最低,之后逐渐上升,卵巢颗粒细胞凋亡显示细胞凋亡明显(P<0.01).雌二醇由卵巢颗粒细胞合成分泌,在卵泡内储存,随着卵母细胞成熟,其量逐渐增加,早期辐射损伤颗粒细胞,雌二醇下降,之后雌二醇水平上升,说明卵母细胞最后受损,细胞崩解,卵泡膜破碎,卵泡内雌二醇释放入血.对此现象我们认为其符合颗粒细胞保护学说,因为雌激素是由卵泡膜表面卵泡膜细胞和颗粒细胞在FSH和LH共同作用下合成的[10],李桂芝等[11]研究表明FSH对于原始卵泡的恢复发育有关键作用,极低的FSH不能促进卵泡发育.颗粒细胞对卵母细胞主要起支持、营养和保护作用,当颗粒细胞损伤和破坏后卵母细胞能量和营养供应中断,影响到卵母细胞的活力,最终闭锁退化.PI3K/Akt 通路是广泛存在于细胞内重要的生存信号转导通路之一,其激活与细胞增殖、分化、凋亡、自噬密切相关[12-15].研究表明[16-17]PI3K/Akt与原始卵泡发育有关,PI3K介导的Akt 激活,Foxo3a过度磷酸化,运出细胞核,刺激原始卵泡启动[18],过早过多启动原始卵泡,大量耗竭,导致卵巢早衰的发生.杨静等[19]通过观察研究,验证了 PI3K/Akt 信号通路参与卵巢功能衰退(POF)的发生.Jang等[20]、Roness等[21]和Yi等[22]研究顺铂等化疗药物也是通过上调PI3K/Akt通路引起卵泡池耗竭加速导致POF.放射引发POF是否与PI3K/Akt信号通路有关,目前未见相关报道.本试验显示:Akt、磷酸化p-Akt和Foxo3a蛋白表达明显增加(P<0.01),刺激原始卵泡过度活化消耗,导致POF发生.聂明月等[23]研究表明Foxo3a主要在原始卵泡及早期初级卵泡卵母细胞核表达,在以后阶段的卵泡中表达减少,所以随着卵巢原始卵泡数量减少,而磷酸化Foxo3a表达明显减少,本试验研究也证实了这一点(P<0.01).推测辐射对卵母细胞损伤可能源于PI3K/Akt 信号通路激活诱发颗粒细胞凋亡,导致卵母细胞营养供应中断有关合成.卵母细胞损伤卵泡的耗竭[24],内分泌功能受到严重影响[25-26],造成POF[27-28],Agorastos等[29]研究表明照射剂量、时间长短与卵巢功能能否保留密切相关.
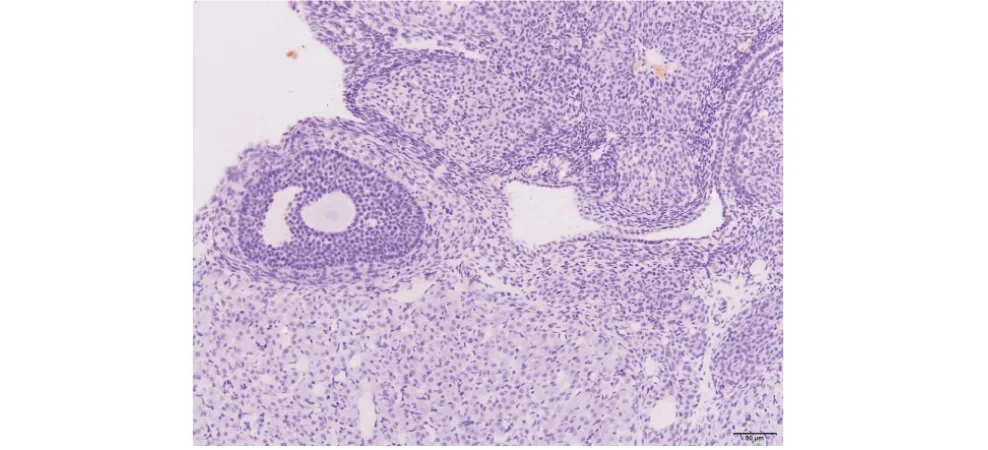
★表示蛋白阳性部位,比例尺50 μm.★ indicates the positive part of protein,the scale bar is 50 μm.图8 正常卵巢卵母细胞Figure 8 Normal ovary oocytes
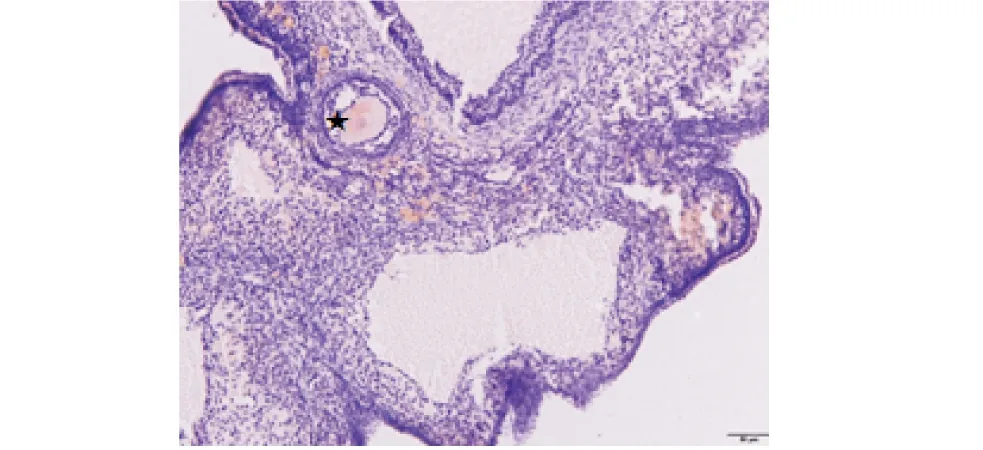
★表示蛋白阳性部位,比例尺50 μm.★ indicates the positive part of protein,the scale bar is 50 μm.图9 辐射卵巢卵母细胞Akt蛋白表达处Figure 9 Expression of Akt protein in irradiated ovary oocytes
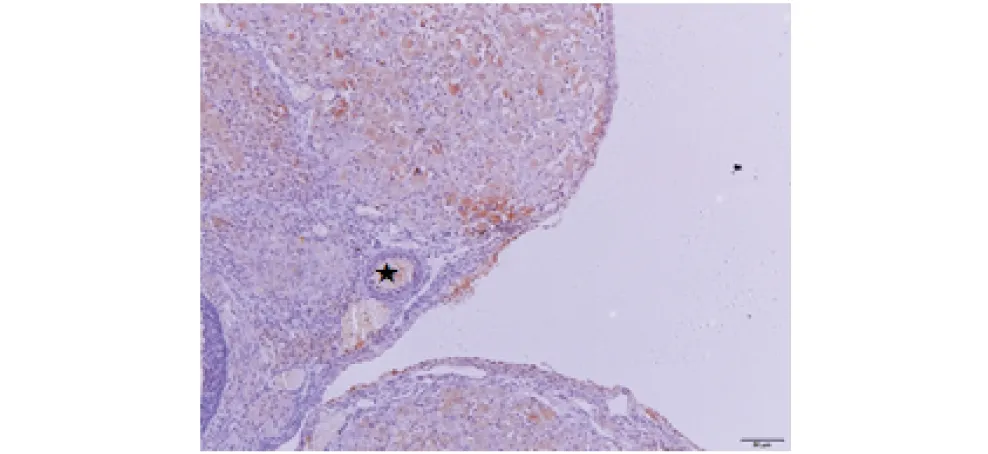
★表示蛋白阳性部位,比例尺50 μm.★ indicates the positive part of protein,the scale bar is 50 μm.图10 辐射卵巢卵母细胞p-Akt蛋白表达处Figure 10 Expression of p-Akt protein in irradiated ovary oocytes

★表示蛋白阳性部位,比例尺50 μm.★ indicates the positive part of protein,the scale bar is 50 μm.图11 辐射卵巢卵母细胞p-Foxo3a蛋白表达处Figure 11 Expression of p-Foxo3a protein in irradiated ovary oocytes
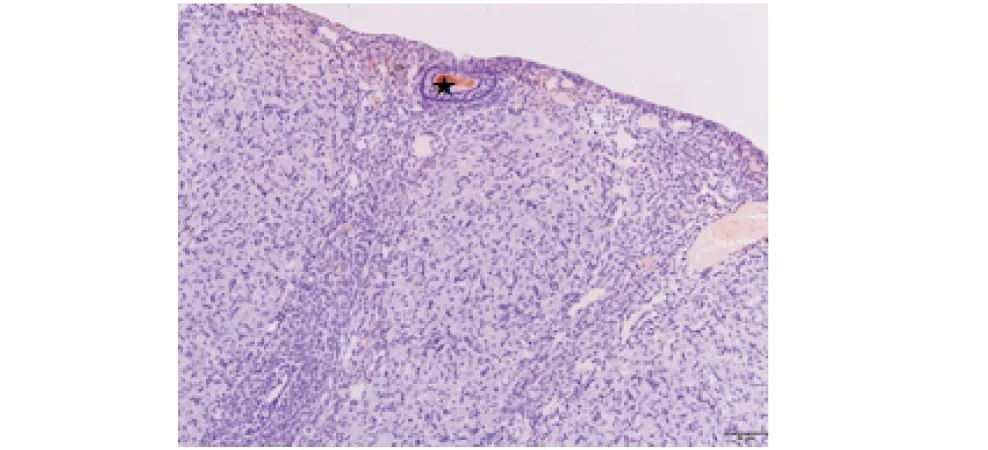
★表示蛋白阳性部位,比例尺50 μm.★ indicates the positive part of protein,the scale bar is 50 μm.图12 辐射卵巢卵母细胞Foxo3a蛋白表达处Figure 12 Expression of Foxo3a protein in irradiated ovary oocytes
因此,研究表明放疗导致POF分子机制可能包括,一方面上调卵巢内PI3K/Akt/Foxo3a信号通路诱导颗粒细胞凋亡使卵母细胞营养和能量供应中断,导致卵泡凋亡闭锁;另一方面放射治疗影响垂体内分泌功能,下调FSH和LH,减弱对卵泡发育的刺激,导致POF的发生.所以对于放疗损伤引起的POF是一种不可逆的损伤,尤其是对卵母细胞的发育.放疗治疗前的卵子冷冻以及卵巢组织移位保护是一种可取的维持生殖功能的方法.
