生物大分子介导仿生矿化制备磁性纳米粒子的研究进展
2021-05-31周雁红李夏兰张光亚
周雁红,李夏兰,张光亚
(华侨大学化工学院,福建厦门361021)
磁铁矿(Fe3O4)纳米粒子因其在固定化酶、生物材料的标记、磁性分离、核磁共振成像、定向给药和热疗等方面的突出应用,而活跃于大众视野中[1]。纳米材料的应用很大程度上依赖于颗粒的大小和形貌,近年来针对其形貌和大小的研究报道也越来越多[2-4]。Fe3O4纳米粒子在直径低于一定尺寸(一般为25~30nm)时,可以表现出一种称为超顺磁性的独特形式[5],即在外界磁场作用下极易被磁化,外界磁场撤销后在极短时间内退磁,没有磁滞现象,矫顽力为零[6]。不同种类磁性纳米颗粒显现超顺磁性的临界尺寸是不同的。
然而,传统共沉淀方法制备Fe3O4纳米粒子需要使用有机溶剂和高温条件,对反应条件要求较高,且因排放有毒气体对环境造成污染或因反应剧烈造成事故。传统共沉淀法制备出的Fe3O4纳米粒子虽具有很高的分散性,但形貌难以精确控制[7]。为解决Fe3O4纳米粒子因环境、反应条件及其颗粒尺寸、形貌带来的重重困难,有研究者开始转向应用仿生矿化的方法制备出大小、形貌均一的Fe3O4纳米粒子[8-10]。本文介绍了在自然界中微生物体内存在的生物大分子(蛋白质)介导的生物矿化、人工模拟菌体内相关作用蛋白质的结构和组成介导体外仿生矿化制备Fe3O4纳米粒子及人工合成多肽在介导产生Fe3O4纳米粒子中的作用,总结了在生物矿化、仿生矿化、利用人工模拟生物矿化相关蛋白对Fe3O4的成核过程的影响及利用人工合成多肽对Fe3O4尺寸的影响,探索Fe3O4的成核机制,讨论了核心氨基酸的作用原理,这有助于进一步阐明生物大分子在磁铁矿成核过程中的机制,有望推动磁性纳米材料在生物化工及医学等领域的应用。
1 传统磁性纳米材料的制备方法
磁性纳米粒子/磁性纳米颗粒(magnetic nanoparticles,MNPs)是近年来发展迅速且极具应用价值的新型材料,在现代科学的众多领域如生物医药、磁流体、催化作用、核磁共振成像、数据储存和环境保护中得到越来越广泛的应用。在众多研究人员的共同努力下,纳米技术在生命科学和生物医药领域取得重大研究进展,推动了分子生物学和细胞生物学的发展。磁性纳米粒子是纳米级的颗粒,一般由铁、钴、镍等金属氧化物组成的磁性内核及包裹在磁性内核外的高分子聚合物/硅/羟基磷灰石壳层组成。最常见的内核是由具有超顺磁或铁磁性质的Fe3O4制成,基于这一磁性性能,磁性纳米粒子可以实现定向移动和介质分离,常用于生物医药方面诸如蛋白质、酶、抗原、抗体、核酸提取的磁性分离、磁性转染、肿瘤热疗和传感器等[11]。传统常用制备磁性纳米粒子的方法包括热分解法[12]、微 乳液 法[13]、水 热 法[14]、化 学 沉 淀 法[15],见表1。
合成Fe3O4磁性纳米粒子的方法在过去几十年里得到了广泛研究,常见方法合成纳米粒子的透射电镜图见图1。其中热分解法是在含有表面活性剂作为稳定剂的高沸腾有机溶剂中控制氧化得到Fe3O4纳米粒子,试剂比例、反应时间和反应温度对控制其粒径和形态均具有决定作用。如Li等[16]以高沸点、强极性的2-吡咯烷酮作为反应传热介质,以乙酰丙酮铁作为原料,采用热分解法制备出粒径分布较窄(平均尺寸为9.8nm±1.4nm)、磁响应强且具有良好生物相容性的Fe3O4纳米粒子,可用于核磁共振造影剂。微乳液法常用于制备粒径分布较好的磁流液,反应物在微乳液滴作为微型反应器的内部进行化学反应,有效避免粒子之间的团聚现象,从而有效控制颗粒大小,使制备出的粒子具有较窄的粒度分布,获得各种粒径的单分散纳米粒子。如Asab等[17]采用油包水微乳液法(W/O)制备了3种不同温度下(30℃、50℃和80℃)的具有热稳定性的高结晶度花朵状Fe3O4纳米粒子(粒径 分 别 为7.85nm±0.01nm、8.41nm±0.13nm和10.83nm±0.02nm),通过改变反应温度和前体浓度获得不同尺寸的纳米粒子,微乳液法是获得可控尺寸纳米粒子的一种有效方法。但在实际应用中,微乳液技术合成纳米材料条件苛刻、产量低、难以规模化生产。水热法采用水作为反应介质,在高温高压的反应条件下生成反应物,经分离和热处理得到纳米粉体,制备的Fe3O4纳米粒子具有晶体尺寸可控、高单分散性和粒径一致的特点,但采用水热法制备纳米材料的反应过程对其设备要求苛刻,需要高温高压的反应环境,因此这种方法仍需进一步改良。从近年发展趋势看,化学共沉淀法仍然是制备Fe3O4最常用的方法。以二价铁离子与三价铁离子的混合盐溶液(Fe2+∶Fe3+=1∶2)为前体,在室温条件下,增强溶液的碱性可直接产生磁性纳米粒子,机制较为复杂[18]。经过早期的开拓工作,许多研究小组报道了铁氧化物之间的各种相变,碱性介质中钙钛矿(akaganeite)向针铁矿(goethite)和/或赤铁矿(hematite)的相变[19]、针铁矿(goethite)转变为赤铁矿(hematite)的 过 程[20]、赤 铁 矿(hematite)转 变 为 磁 铁 矿(magnetite)[21]和 磷 云 母(lepidocrocite)转 变 为磁铁矿(magnetite)[22-23]以及相变中间体的针铁矿(α-FeOOH)、钙钛矿(β-FeOOH)、磷云母(γ-FeOOH)[24],其中Fe2+和Fe3+在制备磁性纳米粒子的途径中各自独立但又相互关联。该工艺因其可规模化生产、可重复性好、反应条件友好而被认为具有重要的工业价值。然而,通过这种方法制备出的纳米粒子尺寸分布范围较广[11]。因此,改变方法制备Fe3O4磁性纳米粒子、改善磁性纳米粒子的尺寸分布和形貌具有重要意义。

表1 常见合成Fe3O4纳米粒子方法的比较
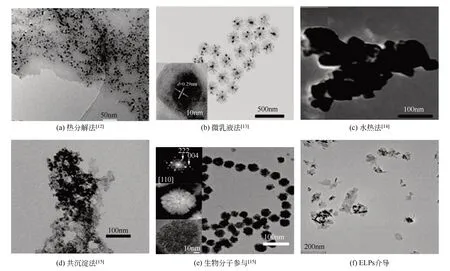
图1 常见方法合成纳米粒子的透射电镜(TEM)图
2 生物矿化
生物系统是一个非常优秀的自我组装实例。生物自组装的例子广泛活跃于一个大尺度范围内,从形成纳米病毒的蛋白质和核酸的组装到多细胞动物[23]。生物矿化是指生物有机体指导无机矿物结构的组装过程[24],例如在单细胞放射虫的细胞内微骨骼中可以观察到生物矿化的产物,包覆硅藻、软体动物壳和脊椎动物的骨骼和牙齿的形态各异的果子[27-29]。在实验室中,这种定向的生物系统组装常常会产生复杂的空间组织层次及精细的结构(如星形图案和生长到中尺度或者大尺度的形貌),这与无机材料的生长过程形成了鲜明的对比[28,30]。虽然自然界中生物来源差异很大,产生的纳米粒子形貌差异也很大,但仍然可以认为生物矿化的产物是通过有机模板中大分子支架和结合元件来协调纳米粒子的成核过程,从而进一步控制纳米粒子的大小分布及其形貌[31]。生物矿化过程除了具有明显的生物学意义外,对无机结构在尺度和形貌上的精细控制也产生了重大的推动作用[32]。
相比之下,研究者们设计的具有多尺度自组装结构元件的能力仍十分有限。但这并不意味着人们对于在纳米尺度上精确定制具有特殊结构和功能材料的兴趣会戛然而止。相反,这种产生新功能的可能性激发了持续增长的研究兴趣,成为仿生矿化领域的研究热点和前沿。
生物有机体借助生物矿化相关蛋白调节晶体成核过程[33]、形貌[34]以及晶体组装[35],产生精细结构的生物矿物。近年来,鉴定与磁小体紧密结合的相关蛋白质成为发现磁铁矿生物矿化因子的主要途径之一,目前已经鉴定与之相关的蛋白质结构和功能总结于表2,几种生物矿化相关蛋白3D结构见图2,因本文中提到的几种蛋白质在蛋白质结构数据库(protein data bank,PDB)中未能查找到完整的3D结构图,故采用蛋白质结构预测(SWISS-MODEL)服务器进行了同源建模,图2(f)为PDB中现有的生物矿化相关蛋白MamA完整3D结构,ID:3AS5。通过对生物矿化相关蛋白Mms5、Mms6、MamC和MamD进行序列相似性对比分析,发现它们序列上存在一定的相似性,而且二级结构和三级结构也颇为类似,以α-螺旋和无规则卷曲为主,这可能与它们具有类似的功能相关。研究表明,这几种蛋白质中共同特征的酸性氨基酸残基(或含有这些残基的区域)负责与生物体的相互作用[36-37]。因此,为了进一步阐明生物矿物形态调控的特殊机制,对生物矿物相关蛋白中酸性氨基酸进行了详细的研究。有科学家从Magnetospirillum magneticumAMB-1中合成的磁铁矿纳米粒子的表面分离出对晶体形态调控起着关键作用的Mms6蛋白,对其作用部位与产物进行重点研究[38]。实验表明,Magnetospirillum magneticumAMB-1中表达缺失部分N端或C端区域基因的Mms6蛋白的突变体和转化子,破坏了原本的蛋白质在晶体成核之前或期间定位到磁小体膜上,缺少与晶格相匹配的负电荷残基,Mms6蛋白不能与晶体表面直接结合,晶体中{110}和高指数面异常生长,从而导致合成磁性纳米粒子形貌的变化。另外,Mms6 C端区域的Asp123、Glu124和Glu125单个氨基酸的取代结果表明,Asp123、Glu124和Glu125的取代损害了Mms6蛋白调节磁铁矿晶体在磁细菌中形态的功能,且影响自组装蛋白的铁结合能力和稳定性,晶体内{110}晶面异常生长,Fe3O4磁性纳米粒子形貌发生改变,表明这3种氨基酸是调节Fe3O4形貌的核心残基。此外,有研究者在被用作铁离子生物矿化模型系统的趋磁细菌MTB(magnetotactic bacteria)中发现,与生物矿化作用有重要联系的MamC蛋白在控制磁小体在地磁场的定向移动中起关键作用[39]。MTB细菌中,MamC蛋白通过生物矿化过程产生具有非等距形态、高化学纯度、单个磁畴尺寸范围内分布且几乎完美晶体结构特征的单磁畴磁铁矿(Fe3O4)或greigite(Fe3S4)纳米晶体。纳米晶体被形成磁小体细胞器的脂质双层包围,因此具有这些特征的磁小体在地球磁场线上被动地排列和主动地运动。

表2 生物矿化相关蛋白结构及功能特征
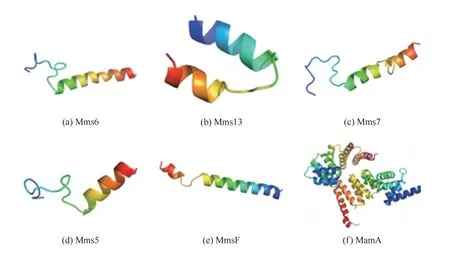
图2 几种生物矿化相关蛋白的3D结构
相较于Mms6和MamC,研究者对其他生物矿化蛋白如Mms16、MamD、MamG和MmsF了解较少,但其作用不可忽视。其中,MamD、MamG在生成磁性纳米粒子中发挥的作用类似于Mms6,但其在菌体中的含量远低于Mms6,获取较困难。Mms16蛋白作为一种磁小体膜外周蛋白,具有细菌磁性颗粒(bacterial magnetic particles,BMP)膜特异性酶的特征,在形成磁小体时,启动细胞质膜的内陷,形成细胞内囊泡[35]。此外,有研究表明,在没有其他主要生物矿化蛋白调节的情况下,正常表达MmsF可以恢复磁铁矿的合成,而缺失表达MmsF基因的突变体,则存在明显的生物矿化缺陷。目前,MmsF在生物矿化中的具体功能尚不明确。但其缺失的影响表明,MmsF对晶体的成核生长和形态都有贡献,而且这两个特征可能是相互关联的[40,47]。
3 体外仿生矿化制备磁性纳米粒子
虽然自然界中的生物矿化是通过生理、化学和生物过程的复杂相互作用来进行的,但从生物矿化的机理上看,生物矿化是通过有机支架才能够对矿物成核和生长的空间定位进行精确控制[30,41]。因此,通过仿生模板设计合成的磁性纳米结构可以与自然界中生物矿化的产物的结构相比拟,二者有类似的结构及其功能,为此需要逐步摸索分析反应条件控制产物的表观特征及性能。其中,基于对生物、物理和化学的深刻认识,了解晶体成核和生长的基本原理对控制仿生矿化的过程起着关键的作用。目前,基于生物大分子的体外仿生矿化制备磁性纳米粒子的研究尚处于起步阶段。
3.1 人工模拟Mms6羧基端基序仿生矿化制备Fe3O4磁性纳米粒子
在生物体内,Fe3O4磁性纳米粒子是在专用的脂质体中产生的(磁小体),这一过程由脂质体膜内的一系列蛋白质控制,Mms6是被认为在生物矿化作用中发挥重要作用的一类蛋白质,且研究较为广泛[38]。Mms6具有一种特异性的羧基端基序(carboxylic acid motifs),这种基序在生物矿化成核蛋白中很常见[36,42]。亚铁离子和铁离子通过铁转运体被吸收到磁小体的核心,在磁小体内腔的酸性氨基酸上积累铁离子,铁转运体也作为反转运体泵出内部质子,质子的流出导致酸碱度增加,促进磁铁矿晶体沉淀,其形成的机理如图3[43]所示。类似的酸性区域是磁小体中的Mms蛋白包括Mms7和MmsF,这种现象表明,在囊泡内腔的羧酸功能化可以辅助磁铁矿的矿化过程。有研究者利用PEG113-PHPMA400和PMPC28-PHPMA400模拟这种羧基端基序制备了具有两亲性的人工磁小体,电穿孔法使铁离子穿过膜进入囊泡中心沉淀的氧化铁具有潜在的磁热疗的优势特性,可以在10min内增加6℃。有可能未来会作为核磁共振成像(MRI)诊断应用的造影剂[39]。
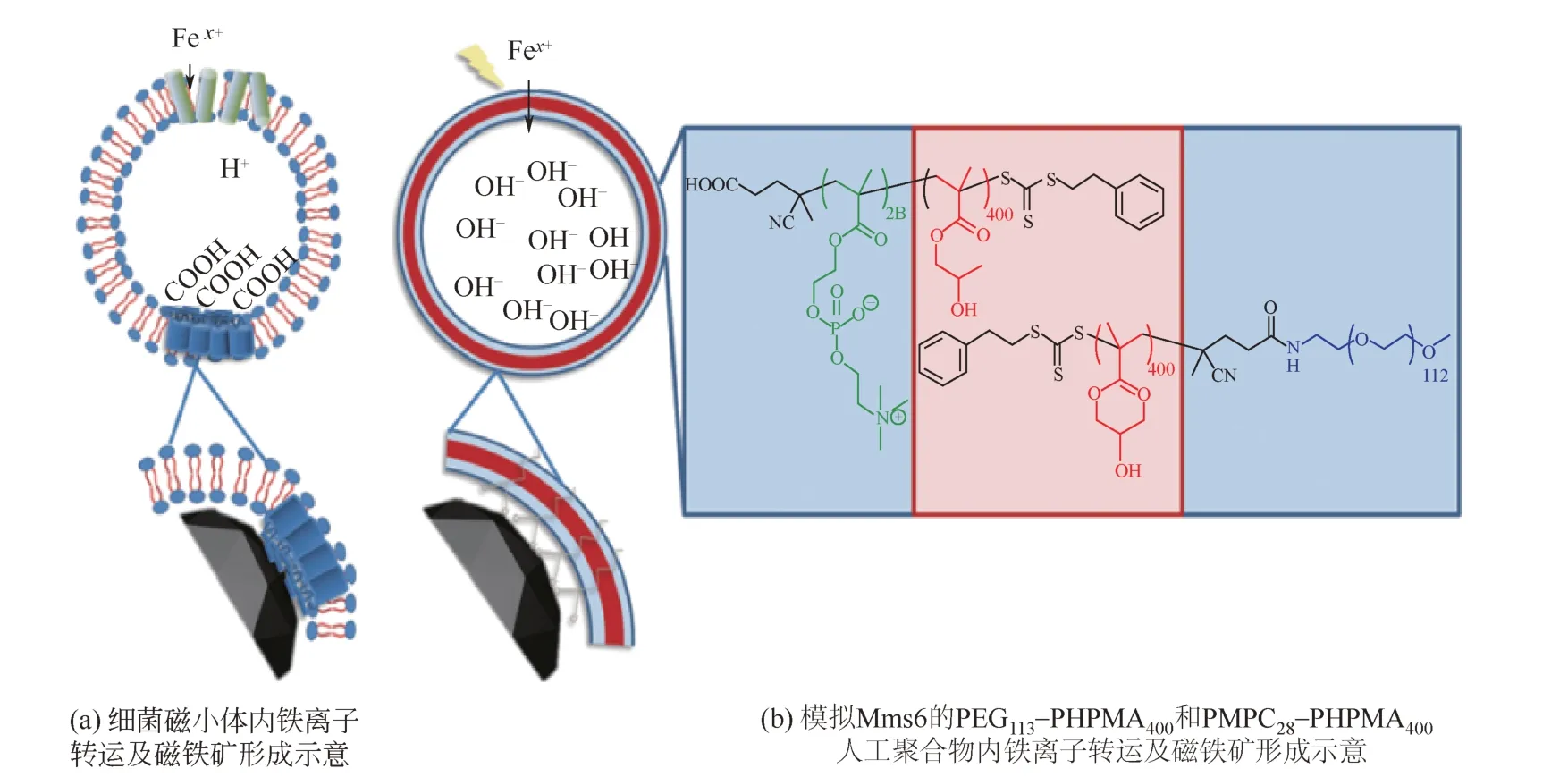
图3 天然和合成模拟Mms6羧基端基序仿生矿化制备Fe3O4磁性纳米粒子[43]
磁小体中的蛋白家族经序列相似性对比表明,其N端具有一段共同的GL重复序列,该序列经生物信息学分析为跨膜片段,AMB-1菌体中Mms6部分基因缺失突变体及转化子的分析表明,Mms6 N端区域的缺失破坏了蛋白质在磁小体表面的正确定位。此外,若Mms6 C端的酸性区域缺失,则导致产生的晶体不再为规则的球形[37-38,44-46]。对Mms6 C端区Asp123、Glu124或Glu125处的单氨基酸进行取代,结果显示,这些氨基酸残基对磁铁矿晶体形态有直接的影响。因此,这些连续的酸性氨基酸残基被认为是体外调节磁铁矿晶体形态的核心残基。这对人工模拟Mms6蛋白氨基酸序列设计具有极其重要的指导意义。
3.2 人工合成多肽Eka仿生矿化制备Fe3O4磁性纳米粒子
基于以上研究,人们广泛寻求模拟磁性纳米粒子生物矿化的合成策略,既要创建能够揭示关键矿化机制的简化模型系统,又要实现可持续的低矿化[47-50]。有研究者将一种生物聚合物人工合成的多肽Eka用以协同调节合成纳米粒子的尺寸大小和形貌[9,51]。通过调节多肽物Eka中3种氨基酸的所占比例,并与无生物聚合物的反应条件对比,来观察生成晶体的情况。研究证实了生成晶体的尺寸和形貌明显依赖于EKa,首先用一系列共聚肽进行了实验,其中谷氨酸(E)物质的量分数为10%~100%,同时保持赖氨酸(K)和丙氨酸(A)含量相等,E含量增多会产生尺寸更小的晶体(从E10的42nm±10nm减小到E100的11nm±4nm),对于E含量较高的多肽,这种效果更明显。事实上,对于K或A含量变化的多肽,磁铁矿晶体尺寸也随E含量的增加而减小。这说明谷氨酸残基对磁铁矿的成核有抑制作用,带负电荷的谷氨酸残基显然与矿物相互作用,从而改变磁铁矿晶体的尺寸。其次,产物的分散性主要取决于实验中所使用多肽的pH和赖氨酸的含量。在高赖氨酸(物质的量分数>25%)多肽存在时,生长的纳米粒子由于磁性聚集而在pH=10时沉淀,在pH=7时分散良好。这表明,K残基质子化后静电稳定性的增加可以保护颗粒避免不受控制的团聚及随后由于铁磁性引力的沉淀。相反,低K含量的多肽存在时,生长的晶体在pH=7时缺乏足够的稳定性,但在高pH下,由于磁铁矿的zeta电位增加而实现稳定分散。因此,带负电荷的氨基酸(谷氨酸)通过电荷相互作用稳定铁水合物/铁(Ⅱ)前体,起到磁铁矿成核抑制剂的作用,多肽分子中谷氨酸的含量可以系统地调节晶体的大小和形状,从而调节晶体的磁性。通过添加此类组合的共聚肽优化Fe3O4磁性纳米粒子的合成似乎成为一种流行趋势。值得注意的是,此类优化过程需要足够的时间进行多代优化,且使用的组合策略对于Fe2+浓度和pH水平至关重要反应,这些反应条件是影响共聚肽控制结晶的重要因素。
此外,虽然可从表观上发现共聚肽对Fe3O4磁性纳米粒子合成的影响,但其内在机制尚不明了。因此,有研究者从存在这些多肽的条件入手,同时消除结构效应及电荷密度对产物合成的影响,设计出最佳共聚肽的组成含量,在铁氧化物形成的条件下,多肽驱动Fe3O4的形成。研究结果表明,EKa多肽通过结合Fe2+改变了成核的条件,与矿物相互作用影响晶体的成核和生长,控制磁性纳米离子的形状和大小[52]。多肽与磁铁矿表面的相互作用产生可分散的、胶体稳定的单畴磁性纳米颗粒,可用于分离技术和合成固体材料,对于将仿生矿化扩展到技术生产上具有重要的战略意义[53-55]。
3.3 其他人工合成分子仿生矿化制备Fe3O4磁性纳米粒子
近年来,除了人工模拟生物矿化蛋白Mms6及人工合成多肽EKa仿生矿化外,还有一些其他人工合成的分子也用于制备磁性纳米粒子Fe3O4。如Rawlings等[40]人工合成了具有可溶性的、结构稳定的Mms13cc和MmsFcc螺旋蛋白,利用茎环结构显示生物矿化蛋白的活性,将其用于合成磁铁矿的添加剂时成功地控制了MNP的形成,且调控合成的效果与天然的Mms13和MmsF生物矿化蛋白相当;Lenders等[56]人工合成了具有Mms6活性序列(DIESAQSDEEVE)的生物衍生肽M6A,水相中室温沉淀,优化后的方法可以有效控制晶体的成核和组装,控制铁氧化物前体相的形成及与Fe2+在pH≈8时的反应转化,制备出颗粒尺寸可达60nm的磁性纳米颗粒Fe3O4。Kuhrts等[57]通过使用聚-L-精氨酸模拟细菌的蛋白质,仅控制pH即可选择性地产生超顺磁性和稳定的单畴磁性纳米粒子,见图1(e),这显示在聚-L-精氨酸存在的条件下,产物对pH具有极高依赖性,只要增加pH,Fe3O4的尺寸就会增加,诱导晶体从单晶到中晶的转变,见图4。这些充分显示利用人工合成多肽进行仿生矿化具有广阔的应用前景。需要注意的是,在实验室研究的同时,研究者们必须注重生物合成分子的活性及结构特征在仿生矿化中的实际影响。

图4 酸碱度和添加剂对制备Fe3O4磁性纳米粒子的影响[57]
除多肽类生物分子能介导磁性纳米粒子的产生外,也有使用现有的聚合物仿生合成磁性纳米粒子。如由不同的阴离子、阳离子和疏水单体构成的丙烯酸酯聚合物等[58]。在实际生产中,综合考虑其优缺点和应用目的进行选择,如使用现有的聚合物减少了在原材料购买上的选择性难题,但对构成聚合物的原材料具体来源并不足够了解;使用聚合物化学方法制备磁性纳米粒子周期较短,但容易对周围环境及操作人员造成污染性伤害;使用聚合物合成磁性纳米粒子操作过程简便且产品纯度高,但反应过程中影响因素很多且苛刻,很难实现工业化大批量生产[59]。而使用多肽类生物分子介导生成磁性纳米粒子可以对多肽进行多元化的设计,以实现设计的预期目的,但此过程需要大量实验研究作为依据;多肽类分子能够更好地模拟磁性细菌本身蛋白的结构,以保证生物分子的活性,在效能方面发挥更大的优势。但生物分子的储存时间较短;以多肽类分子介导生成磁性纳米粒子操作过程虽然相对安全,对环境污染较小,但纯化制备大量蛋白质(多肽)等费用昂贵[51]。
3.4 人工设计类弹性蛋白多肽序列制备Fe3O4磁性纳米粒子
基于传统色谱柱纯化蛋白质或多肽遇到的一系列难题,如昂贵和耗时的过程,且不容易规模化。研究者开始另辟蹊径寻找借助非色谱的方法纯化蛋白质或多肽,类弹性蛋白多肽(ELPs)作为一类温度响应型多肽在这一背景下脱颖而出[60]。本文作者课题组也曾设计了一种新型ELPs,并以ELPs作为纯化标签,对目标蛋白酶进行分离纯化,纯化后酶回收率约为66.3%,纯化倍数约为12.5,效果良好[61]。在此同时,本文作者课题组还发现该ELPs具有介导四甲氧基硅烷(TMOS)仿生硅化的能力,与众不同的是,该ELPs能在很宽pH范围内(2.2≤pH≤9.6)介导仿生硅化;在更低浓度下,所需时间更短(约100s,仅为上述多肽的1/6);其仿生硅化能力不依赖于磷酸根离子。元素分析结果证实ELPs被固定于所形成的二氧化硅粒子中。因此,ELPs还可以作为一种非常有效的自固定化载体,以提高固定化酶的pH稳定性、热稳定性及储藏稳定性[62-65]。此外,本文作者课题组最新的研究结果显示,利用ELPs-Spycather的仿生硅化能力,可以实现在Fe3O4磁芯表面包覆二氧化硅,制备表面修饰的包硅磁性纳米颗粒,可以更有效地保留磁性,利于酶的分离和提高蛋白质的负载量。该方法制备条件温和,所需时间短(11min),远低于其他文献中的用时(4.5~120h)。此外,ELPs-Spycather可长时间被固定于载体上,56h的蛋白泄漏率小于2%。有望成为一种全新的酶自固定化与分离纯化集成的技术手段。
除此之外,本文作者课题组也对制备粒径分布较窄、晶体尺寸大小形貌均一、形貌具有可控性的Fe3O4纳米粒子产生了浓厚的兴趣。ELPs的设计源于自然界中弹性蛋白,除了是一种环境响应型多肽外,它的设计序列也具有重大的意义[66]。其中包含一段重复序列(VPGXG)n,X是除脯氨酸外的其他任意氨基酸,这种序列的可设计性及可编辑性有望赋予ELPs全新的仿生矿化制备磁性纳米粒子的能力,在了解多肽仿生制备磁性纳米粒子机制的基础上,可以设计出具有此功能的ELPs分子,使其在制备Fe3O4中发挥重要作用,本文作者课题组前期利用ELPs仿生制备的磁性纳米粒子经X射线衍射(XRD)确认为Fe3O4磁性粒子,其电镜照片如图1(f)所示,经计算其平均粒径约为32nm。有望开辟人工设计生物大分子介导制备磁性纳米粒子的新领域,相关的研究工作正在不断有序推进中。
由于磁性纳米粒子常常具有独特的物理(结构、电子、磁性和光学)和化学(催化)性质。在全球纳米材料市场,其价值数十亿美元,对从药品到电池生产[67]的应用来说是巨大而深远的。但由于磁性纳米粒子的尺寸往往不受控制,而且合成的条件对环境和人工操作技术要求较为严格,因此其应用受到很大的阻碍。经过研究者的不懈努力,发现利用生物方法在化学共沉淀的基础上,有效地利用生物大分子或者多肽介导制备出的磁性纳米粒子大小分布范围较为集中,相对传统方法分散性更低,形貌具有可确定性,而且通过调节反应的酸碱性可控制其粒径大小[38]。人工合成模拟生物矿化的相关结合蛋白也可以高效产生预期的磁性纳米颗粒,与其他介导仿生矿化的有机分子相比,多肽类生物分子存在诸多优势[68-69]。例如,生物相容性更好,制备磁性纳米材料的条件更加温和;多肽类生物分子易通过基因工程技术或化学法制备;多肽丰富的结构和组装驱动力可精确调控纳米材料的形貌和尺寸。因此,人工合成的模拟生物矿化的蛋白质或多肽类生物大分子在药品研发、癌症治疗和核磁共振成像等方面具有更为广阔的应用前景[39,42]。目前,生物合成的磁性纳米粒子在生物医学领域中被应用于对各种疾病的检测、治疗和预防。如Strehl等[70]利用抗体、酶和药物等生物相容性材料封装磁性纳米颗粒,通过外部磁场对其进行导向,从而到达特定的靶向组织或器官。Wang等[71]利用非功能化的磁性纳米颗粒标记淋巴细胞或白细胞等。除此之外,简便有效的生态友好型磁性纳米颗粒当前的主要进展还在于对有毒农药、染料、金属和废水的检测、降解和处理,以维护稳定的生态系统。如,Das等[72]将尺寸为10~15nm左右的漆酶固定化于磁性纳米颗粒并成功用于降解农药毒死蜱。Guo等[73]将磁性纳米颗粒用于去除2,4-二氯苯酚。
人工合成多肽促进合成磁性纳米粒子仍然是当前及今后研究的重点和热点。人工合成多肽或蛋白质在设计上相对简单,也可以通过生物发酵法制备,但有不少科学问题亟需解决:①人工合成的蛋白质在其结构上无法与生物体内的天然蛋白质相比拟,无法在其应用方面发挥与生物矿化蛋白在细菌体内相当的作用,甚至可能由于人工合成的蛋白质在其结构或辅因子上的无法重复性造成功能的突变,这些是当前仿生矿化所遇到的最严重挑战;②生物分子(多肽)容易受到环境中强酸、强碱以及保存周期的影响,导致其结构和性能发生变化,如果不加修饰直接将其投放于实际生产中,则不能充分体现其价值。因此,需要设计出高度模拟生物矿化蛋白中发挥核心作用的结构片段,并充分考虑生物体微环境中辅因子的参与,这成为目前该领域急需解决的关键问题;③多肽类分子调控磁性粒子合成过程及其对磁性粒子形貌、大小的影响规律不明,仿生矿化过程中多肽分子和磁性粒子间相互作用的微观过程亟待阐明;④现有合成磁性纳米颗粒的方法中,反应物被部分混合,未反应的组分影响最终产物,使得获得所需产物的再现性极低,因此开发反应后纯化最终产物的方法势在必行[74-75]。
4 结语
生物合成绿色新型多功能化的磁性纳米颗粒可通过发掘细菌、真菌、藻类、酵母和病毒等微生物以及生物分子有机酸、醛类物质的潜力来实现。纵观磁性纳米颗粒在化学、生物、医学和环境资源等领域中应用,不难发现纳米颗粒的尺寸、形貌、磁学性质等物理特征在其中至关重要。目前,已有研究表明,蛋白质等生物大分子可以控制仿生矿化制备磁性纳米颗粒的尺寸及形貌,但由于生物分子通常表现出复杂的结构,因此研究生物大分子在仿生矿化中的具体影响机制变得非常困难。因此,今后的研究重点应包括(但不限于)以下几点:①进一步阐明相关矿化蛋白在磁性粒子仿生矿化过程中所起的作用,在此基础上,将人工合成的生物大分子与生物体内矿化蛋白进行同源性比对,以评估生物分子在仿生矿化过程中的决定性因素;②依据细胞内生物矿化相关蛋白结构和功能,设计人工合成蛋白应更多考虑蛋白质有活性的结构,如何使人工合成蛋白保持活性是精细合成绿色无机纳米颗粒的一项重大挑战;③生物合成磁性纳米颗粒更多地用于生物医学领域,如药物靶向运输及释放。因此需充分保证其良好的生物相容性,以及在合成过程中采用温和条件制备纳米颗粒,以利于药物、酶和蛋白质等充分保留其活性。随着生物材料在医疗健康行业和生活中所占比重逐渐增加,生物方法制备磁性纳米材料在药物研发和医学成像方面将承担越来越重要的角色。并且,其应用的范围也将进一步拓展。
