澳洲坚果蛋白磷酸酶基因MiSTPP1和MiSTPP4克隆与生物信息学分析
2021-05-31李季东杨祥燕蔡元保曾黎明黄思婕巫辅民林玉虹郑文武黄锦媛
李季东,杨祥燕,蔡元保,李 穆,曾黎明,黄思婕,巫辅民,林玉虹,郑文武,黄锦媛
(广西壮族自治区农业科学院/广西壮族自治区亚热带作物研究所,广西 南宁 530001)
0 引言
【研究意义】低温、干旱、洪涝、盐碱等逆境胁迫是严重影响植物生长发育的环境因子,可导致植物产量和品质下降甚至死亡。植物通过细胞功能调节来抵御外界环境的逆境胁迫,尤其是蛋白质可逆磷酸化在细胞的新陈代谢、生长发育、增殖与凋亡、信号转导、基因调控等过程中发挥着重要的调控作用[1−2],而蛋白质可逆磷酸化主要由蛋白磷酸酶和蛋白激酶来平衡调控。因此,蛋白磷酸酶的功能研究对于了解蛋白质可逆磷酸化过程及植物耐逆机制研究具有重要意义。【前人研究进展】蛋白质磷酸酶分为丝氨酸/苏氨酸磷酸酶、双特异性蛋白磷酸酶、酪氨酸磷酸酶3类,其中丝氨酸/苏氨酸磷酸酶(PP)又分为蛋白磷酸酶1(PP1)和蛋白磷酸酶2(PP2)[3]。目前,国内外对PP2家族蛋白的生物学功能比较清楚,如番茄(Solanum lycopersicum)LePP2Ac、水 稻(Oryza sativa)OsPp2a、拟 南 芥(Arabidopsis thaliana)AthPP2CA和玉米(Zea mays)ZmPP2C等[4−5];而对PP1家族蛋白的功能研究并不多,这个家族成员包括欧洲油菜(Brassica napus)BnPP1、野大豆(Glycine soja)GsPP1、豌豆(Pisum sativum)PsPP1和橙子(Citrus sinensis)CsPP1等[6]。PP1家族蛋白主要作用于磷酸酶激酶的β亚单位,其活性主要受内源热稳定蛋白I-1和I-2的抑制[7]。虽然从模式植物拟南芥、水稻、烟草、苜蓿、豌豆等多种植物的基因组DNA或cDNA文库中都分离到编码PP1蛋白催化亚基的基因[6−8],但是对于这些基因的功能及其编码蛋白的催化机制人们并不清楚。澳洲坚果又称夏威夷果,是山龙眼科(Proteaceae)澳洲坚果属(Macadamia)植物,原产于亚热带雨林,具有重要的营养价值和药用价值,享有“干果皇后”的美誉。虽然澳洲坚果在澳大利亚、美国夏威夷、肯尼亚和中国等地广泛种植,但是受其生长条件的限制,澳洲坚果无法进一步推广种植[9−10]。【本研究切入点】目前,国内外仍未见澳洲坚果蛋白质磷酸酶的相关研究报道。在澳洲坚果抗寒转录组测序的基础上,采用RT-PCR克隆澳洲坚果蛋白磷酸酶基因,并利用生物信息学分析这些蛋白磷酸酶的结构和功能。【拟解决的关键问题】基于前期的研究基础[11],本研究从澳洲坚果光壳种中克隆编码蛋白磷酸酶基因MiSTPP1和MiSTPP4,并对其进行生物信息学分析,以期为深入研究澳洲坚果PP1家族蛋白的结构和功能及阐明其耐逆的分子机制提供科学依据。
1 材料与方法
1.1 试验材料
试验材料为广西亚热带作物研究所澳洲坚果种质资源圃提供的澳洲坚果光壳种(Macadamia integrifolia)品 种Own Choice(O.C.)。对 接 穗 为4个月苗龄的嫁接苗进行4 ℃低温处理0.5、1、3、6、12、24 h,采集这些低温处理后的幼嫩叶片,液氮 速冻处理后−80 ℃保存备用。
1.2 总RNA提取及cDNA合成
参照蔡元保等[12]的CTAB改良法提取澳洲坚果叶片总RNA,利用核酸蛋白检测仪分析所提取的总RNA纯度和浓度,用1.5%琼脂糖凝胶电泳检测提取的总RNA完整性,按照美国Invitrogen公司反转录试剂盒(Reverse Transcription System)说明书合成澳洲 坚果cDNA。
1.3 澳洲坚果的MiSTPP1和MiSTPP4基因克隆
利用本课题组从澳洲坚果抗寒转录组中获得2个蛋白磷酸酶基因,利用Primer Premier 5.0软件在这2个基因开放阅读框(ORF)以外的区域设计引物MiSTPP1-F和MiSTPP1-R,以及MiSTPP4-F和MiSTPP4-R(表1)。所用引物全部由大连宝生物工程有限公司合成。
PCR反应体系15 μL,包括澳洲坚果cDNA模板1.0 μL,2×Ex Taq PCR MasterMix 8.0 μL,正向和反向引物各0.5 μL,无菌ddH2O补足至15 μL。PCR扩增程序:95 ℃预变性2 min;94 ℃ 30 s,52.0 ℃或55.2 ℃(具 体 参 考 表1)30 s,72 ℃ 90 s,32个 循环;72 ℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,采用天根琼脂糖凝胶回收试剂盒(DP209-02)进行回收与纯化,将其连接到T载体pMD18上,转化到大肠杆菌DH5α感受态细胞,并采用蓝白斑筛选方法挑取白色阳性克隆,送至上海 生工生物工程有限公司进行序列测序。

表 1 基因MiSTPP1和MiSTPP4克隆所用引物序列Table 1 Primer sequences used in cloning MiSTPP1 and MiSTPP4
1.4 生物信息学分析
利用NCBI网站的BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行蛋白质序列和功能结构域的同源检索,用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)进行开放阅读框ORF分析,用PROSITE(http://prosite.expasy.org/scanprosite/)和SMART(http://smart.embl-heidelberg.de/)软件预测功能结构域,用ProtParam软件(http://web.expasy.org/protparam/)分析目标蛋白质的理化性质,用在线程序NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)预测磷酸化位点,用PSORT软件(http://www.psort.org)分析蛋白质的亚细胞定位,用SignalP 4.1软件(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白信号肽,用TMpred软件(http://www.ch.embnet.org/software/TMPRED_form.html)预测蛋白质的跨膜域,用SOPMA软件(http://www.expasy.org)进行蛋白二级结构预测,用在线程序SWISS-MODEL(http://swissmodel.expasy.org/)预测蛋白质的三维结构。在NCBI网站GenBank中查找同源蛋白,并用DNAMAN 6.0软件进行同源蛋白的系统进化树构建。
2 结果与分析
2.1 澳洲坚果MiSTPP1和MiSTPP4基因的cDNA全长克隆
以澳洲坚果叶片cDNA为模板,采用特异性引物MiSTPP1-F和MiSTPP1-R,以及MiSTPP4-F和MiSTPP4-R分别扩增2个基因的开放阅读框(ORF)(图1)。测序结果表明,澳洲坚果MiSTPP1基因的cDNA全长为2 119 bp,ORF长度为1 053 bp,编码350个氨基酸;MiSTPP4基因的cDNA全长为2 030 bp,ORF长度为981 bp,编码326个氨基酸。利用NCBI网站的BLAST程序检索同源蛋白的结果表明,这2个基因的编码蛋白和其他物种的丝氨酸/苏氨酸磷酸酶PP1具有很高的序列相似性。因此,将这2个基因分别命名为澳洲坚果的MiSTPP1和MiSTPP4基因,GenBank登录号分别为MT374548和MT374551。

图 1 澳洲坚果MiSTPP1和MiSTPP4基因的克隆Fig. 1 Isolations of MiSTPP1 and MiSTPP4 from M. integrifolia
2.2 MiSTPP1和MiSTPP4氨基酸序列的同源性分析
氨基酸多序列比对和功能结构域预测结果显示,澳洲坚果MiSTPP1和MiSTPP4与其他植物来源的蛋白磷酸酶PP1家族成员的蛋白序列具有极高的相似度(图2)。其中,MiSTPP1蛋白与水芙蓉NnPP1(XP_010259515)、欧洲油菜BnPP1(XP_013643938)、芜菁BrPP1(XP_009151182)的氨基酸序列相似度分别为86.29%、83.72%和83.39%;MiSTPP4蛋白与鸡血藤SsPP1(TKY61334)、鹰嘴豆CaPP1(XP_00449 5569)、蒺藜苜蓿MtPP1-1(AES61198)的氨基酸序列相似度分别为92.02%、91.72%和91.41%。这些蛋白都含有N端的丝氨酸/苏氨酸特异性蛋白磷酸酶特征序列LRGNHE及蛋白磷酸酶PP1家族的典型结构域MPP_PP1_PPKL。
2.3 MiSTPP1和MiSTPP4的系统进化树构建
丝氨酸/苏氨酸磷酸酶(PP)家族的系统进化树(图3)显示,PP家族分为PP1家族和PP2家族,其中,PP1家族成员又分成2个组,澳洲坚果MiSTPP1和MiSTPP4被分在不同的组内,其中MiSTPP1与水芙蓉NnPP1(XP_010259515)和罂粟PsPP1(XP_026450203)的亲缘关系最近;MiSTPP4与橙子CsPP1(XP_006487724)和鸡血藤SsPP1(TKY61334)的亲缘关系最近,推测这些亲缘关系近的PP1蛋白具有相同的进化起源及类似的结构和功能。
2.4 MiSTPP1和MiSTPP4蛋白的基本理化性质分析
ProtParam软件分析MiSTPP1蛋白的结果表明,其相对分子质量为39.57 kDa,分子式C1 764H2 747N475O524S18,等电点(pI)为5.14,负电荷残基数(Asp+Glu)为49个,正电荷残基数(Arg+Lys)为36个,不稳定系数为50.03(为不稳定蛋白),脂肪族指数为90.54,亲水性总平均值(GRAVY)为−0.274。因此,推测MiSTPP1蛋白是一个不稳定的亲水性蛋白。

图 2 MiSTPP1和MiSTPP4与其他植物PP1蛋白的同源性比对结果Fig. 2 Homology between MiSTPP1, MiSTPP4, and other PP1 proteins

图 3 MiSTPP1和MiSTPP4与其他植物PP蛋白的系统进化关系Fig. 3 Relationship among phylogenetic trees of MiSTPP1, MiSTPP4, and other PP proteins
ProtParam软件分析MiSTPP4蛋白的结果表明,其相对分子质量为36.74 kDa,分子式为C1 646H2 579N439O478S18,等电点(pI)为5.75,负电荷残基数(Asp+Glu)为42个,正电荷残基数(Arg+Lys)为37个,不稳定系数为36.77(为稳定蛋白),脂肪族指数为92.09,亲水性总平均值(GRAVY)为−0.178。因此,推测M iSTPP4蛋白是一个稳定的亲水性蛋白。
2.5 MiSTPP1和MiSTPP4蛋白的功能预测
在线程序NetPhos 3.1预测结果表明,MiSTPP1蛋白有23个磷酸化位点,其中丝氨酸(Serine)13个,苏氨酸(Threonine)7个,酪氨酸(Tyrosine)3个;MiSTPP4蛋白有20个磷酸化位点,其中丝氨酸(Serine)8个,苏氨酸(Threonine)9个,酪氨酸(Tyrosine)3个。PSORT软件预测表明,MiSTPP1和MiSTPP4蛋白定位于细胞质可能性都为65%。SignalP和TMpred软件预测显示,MiSTPP1和MiSTPP4蛋白都不存在跨膜结构和信号肽,都为非分泌蛋白和非跨膜蛋白。
2.6 MiSTPP1和MiSTPP4蛋白的二级和三维结构预测
SOPMA软件分析结果表明,澳洲坚果MiSTPP1多肽链中主要含有无规则卷曲(38.57%)和α-螺旋(36.57%),其次是折叠延伸链(18.29%)和β-转角(6.57%)(图4-A);MiSTPP4多肽链中主要含有α-螺旋(42.02%)和无规则卷曲(36.50%),其次是折叠延伸链(14.42%)和β-转角(7.06%)(图4-B)。
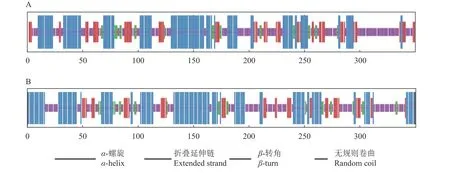
图 4 MiSTPP1蛋白(A)和MiSTPP4蛋白(B)的二级结构分析Fig. 4 Secondary structure of MiSTPP1 (A) and MiSTPP4 (B)
以丝氨酸/苏氨酸磷酸酶PP1的晶体结构(PDB ID:1s70.1.A)为同源模板,利用Swiss-model软件构建MiSTPP1蛋白的三维预测模型。结果表明,MiSTPP1蛋白的氨基酸序列与模板序列一致性为69.55%,GMQE值为0.78,其核心结构主要由无规卷曲和α-螺旋组成(图5-A)。同样,以丝氨酸/苏氨酸磷酸酶PP1的晶体结构(PDB ID:6dcx.2.A)为同源模板,利用Swiss-model软件构建MiSTPP4蛋白的三维预测模型。结果表明,MiSTPP4蛋白的氨基酸序列与模板序列一致性为76.42%,GMQE值为0.83,其核心结构主要由α-螺旋和无规卷曲组成(图5-B)。MiSTPP1和MiSTPP4蛋白的三维模型组分与其二级结构的预测结果相符合。

图 5 MiSTPP1蛋白(A)和MiSTPP4蛋白(B)的三维结构分析Fig. 5 3D configurations of MiSTPP1 (A) and MiSTPP4 (B)
丝氨酸/苏氨酸磷酸酶PP1家族成员在细胞信号转导、新陈代谢、生长与凋亡等多种细胞生理生化过程中广泛表达,且其蛋白序列与结构在长期进化中也高度保守[13]。本研究利用本课题组澳洲坚果抗寒转录组数据信息,通过RT-PCR技术成功获得了属于PP1基因家族的澳洲坚果MiSTPP1和MiSTPP4基因cDNA全长。蛋白序列和系统进化树分析表明,MiSTPP1和MiSTPP4蛋白与其他植物PP1蛋白具有极高的序列相似度,都属于PP1进化分支,都含有PP1家族的典型结构域MPP_PP1_PPKL,尤其是N端都含有丝氨酸/苏氨酸特异性蛋白磷酸酶特征序列LRGNHE。这些为MiSTPP1和MiSTPP4蛋白的结构与功能研究提供氨基酸序列基础。
蛋白基本理化性质分析表明,MiSTPP1蛋白是一个不稳定的亲水性蛋白,而MiSTPP4蛋白是一个稳定的亲水性蛋白。蛋白磷酸化位点分析表明,MiSTPP1蛋白以丝氨酸磷酸化为主,而MiSTPP4蛋白以丝氨酸和苏氨酸磷酸化为主,结合磷酸化修饰在蛋白功能中的作用[14−15],推测这两类氨基酸进行磷酸化修饰时在各自蛋白行驶功能中发挥重要的作用。蛋白亚细胞定位、跨膜结构和信号肽预测表明,MiSTPP1和MiSTPP4蛋白极可能定位于细胞质,推测这两个蛋白作为非分泌蛋白或非跨膜蛋白行驶其生物学功能。蛋白二级结构和三维结构分析表明,MiSTPP1和MiSTPP4蛋白的二级和三级结构主要由α-螺旋和无规卷曲组成,并夹杂着折叠延伸链,尤其是预测的三维结构模型与PP1家族已知的晶体结构具有极高的一致性(分别达到69.55%和76.42%)。说明PP1蛋白在长期的物种进化过程中,MiSTPP1和MiSTPP4蛋白同其他PP1家族成员一样,其蛋白的空间结构高度保守,推测其有类似的生物学功能。
鉴于MiSTPP1和MiSTPP4蛋白与其他功能已知的PP1家族成员具有极高的亲缘关系和空间结构相似性,可以初步推测MiSTPP1和MiSTPP4基因在响应逆境胁迫、信号转导、生长发育等生理生化过程中发挥重要的作用。但是,其具体的功能还需要通过亚细胞定位、酵母自激活及遗传转化等技术进行深入研究,从而为阐明澳洲坚果PP1蛋白的分子调控机制提供科学依据。
