黄芪多糖对犬血清中白介素水平及肠道Toll样受体信号通路的影响
2021-05-31舒迎霜王承志李思婷贺濛初夏晓冬冯士彬王希春吴金节
舒迎霜,王承志,李思婷,贺濛初,夏晓冬,冯士彬,李 玉,王希春,吴金节
(安徽农业大学 动物科技学院,安徽 合肥 230061)
Toll样受体(Toll-like receptors,TLRs)是一类可以将特异性免疫和非特异性免疫联系起来的重要蛋白质分子,其主要参与动物机体的天然免疫应答,在淋巴组织中表达较多,为动物机体免疫的第一道屏障[1-2]。TLRs最早在果蝇胚胎中被研究者们发现并命名,Toll样蛋白与天然免疫分子白细胞介素1受体极为相似,随后证实TLRs在果蝇真菌感染免疫过程中起重要作用,且果蝇细胞信号传导途径与哺乳动物类似[3-5]。目前在哺乳动物和人类中共发现了11个TLRs,Toll样受体4(TLR4)是在细胞膜表面鉴定出的第一个蛋白质受体,广泛表达于哺乳动物肠道、肾脏以及黏膜系统等,能够识别革兰氏阴性菌脂多糖(Lipopolysaccharides,LPS);Toll样受体7(TLR7)在多种免疫细胞以及淋巴组织中均有表达,在抗肿瘤、抗病毒和免疫调节等方面都有重要作用[6-8]。髓样分化因子88(MyD88)是Toll样受体信号通路中一个至关重要的衔接蛋白,在机体受到外界因素刺激时,TLR4和MyD88之间的TIR结构域会相互作用而激活MyD88依赖型信号通路,导致MyD88的死亡结构域与受体相关因子6(TRAF-6)相互作用并且活化激酶1(TAK1),活化的TAK1通过MAPK信号通路激活转录因子激活蛋白-1(AP-1),从而调节相关细胞因子的表达[9-10]。
黄芪多糖(astragalus polysaccharide,APS)具有益气固表之功效,可溶于水,并且在体内外均有显著的免疫调节作用[11-12]。研究证实,APS可介导小鼠巨噬细胞表面TLR4信号通路,调节细胞因子的释放,增强机体细胞免疫[13]。较多有关APS调节哺乳动物机体免疫功能的研究认为,TLR2、TLR4在APS调节机体免疫中扮演着重要角色,是APS的免疫识别受体,通过识别APS可激活机体细胞信号转导途径,从而增强对机体的免疫效果[14-15]。然而,APS介导Toll样受体在动物机体内发挥免疫调节作用的机制仍不清楚,因此本研究以犬为对象,系统研究APS对犬的免疫调节作用,旨在探索TLR4信号通路在APS发挥免疫调节效应中的作用及机制。
1 材料与方法
1.1 材 料
1.1.1 试验动物 18只比格犬,体质量约10 kg,由安徽农业大学动物医院提供,试验犬正常驱虫及免疫,试验前饲养2周,观察是否健康。
1.1.2 试验器材 电泳仪、凝胶成像仪,Biorad公司生产;TD-100小型提取浓缩机,浙江森力机械科技有限公司生产;MK3型半自动酶联免疫分析仪,美国Thermo公司生产;LGJ-12N冷冻干燥机,北京亚星仪科科技发展有限公司生产;CX31光学显微镜,日本OLYMPUS 公司生产;YD-1508 R轮转式切片机,浙江金华益迪医疗设备厂生产。
1.1.3 主要试剂 黄芪饮片,购于安徽合肥梅山路立方大药房;犬IL-2、IL-4和IL-6 ELISA试剂盒,购于上海源叶生物科技有限公司;三氯乙酸、PBS缓冲液、多聚甲醛、枸橼酸钠、NaOH、食用酒精等,购于无锡展望化工试剂有限公司;SuperScript Ⅲ RT反转录试剂盒、Sybrqpcr mix,均购于ABI-invitrogen公司;TLR4、TLR7、MYD88、TRAF6、AP-1抗体,购于赛维尔生物科技有限公司;β-actin抗体,购于北京锐抗生物科技有限公司;山羊抗兔IgG抗体,购于北京中杉金桥生物科技有限公司。
1.2 方 法
1.2.1 APS的制备 取黄芪饮片5 kg,充分清洗干净,按质量(g)体积(mL)比为1∶10的比例加入食用酒精(乙醇含量为体积分数80%),在约75 ℃下脱脂3次,每次1 h。将脱脂后的黄芪饮片在65 ℃左右烘干,按质量(g)体积(mL)比为1∶20的比例加入纯净水,超声波提取80 min(超声波功率为300 W,温度80 ℃),浓缩至4 L,添加12 L体积分数95%的酒精,静置让多糖充分沉淀,过滤去上清,向沉淀中加入足量纯净水溶解,加等量体积分数5%的三氯乙酸溶液,4 ℃放置1 d,以除去蛋白。次日,3 000 r/min离心5 min,取上清,用NaOH溶液调节至中性,浓缩至4 L,加酒精直至溶液中乙醇含量超过体积分数80%时停止,低温静置24 h左右,过滤,将得到的沉淀冷冻干燥,即得APS干燥粉。苯酚硫酸法测多糖质量分数为12.91%。
1.2.2 试验分组及饲养管理 将18只比格犬随机均分为对照组、APS低剂量组和APS高剂量组,分别饲喂基础日粮、基础日粮+质量分数1%的APS和基础日粮+质量分数2%的APS。试验期2周,期间每只犬单独用笼,分开饲养,固定饮食,每日饲喂2次,每次150 g,自由饮水。
1.2.3 样品采集 在试验第0,7和14 天时,早间空腹采血,离心分离血清,用移液器将血清分装保存于-20 ℃。第14 天,所有试验犬麻醉放血后解剖,取十二指肠洗净后分成2份,其中一份用40 g/L多聚甲醛溶液固定;另一份于冻存管中剪碎,放入液氮罐中速冻,保存备用。
1.2.4 血清细胞因子的测定 采用ELISA试剂盒检测犬血清中IL-2、IL-4和IL-6水平,根据试剂盒中标准品浓度以及测得的吸光值绘制标准曲线,计算得出待测样品浓度。
1.2.5 TLR4、TLR7、MyD88、TRAF-6和AP-1蛋白分布的检测 采用免疫组化法检测Toll样受体相关蛋白(TLR4、TLR7、MyD88、TRAF-6和AP-1)在犬十二指肠中的分布。从40 g/L多聚甲醛固定液中取出十二指肠包埋切片,将切片依次放入二甲苯、醇苯和酒精梯度溶液中进行脱蜡,用体积分数3%过氧化氢溶液孵育25 min,微波修复抗原,PBS冲洗4次;用PBS按体积比1∶200稀释一抗(TLR4、TLR7、MyD88、TRAF-6和AP-1抗体)后滴加到切片上,阴性对照用PBS代替一抗,4 ℃避光孵育过夜;次日将切片放入37 ℃烘箱复温45 min,PBS冲洗4次,滴加二抗(山羊抗兔IgG抗体),避光37 ℃孵育30 min,加DAB溶液终止染色,苏木精复染4 min,体积分数1%盐酸酒精分化液(1 mL浓盐酸溶于99 mL无水乙醇)分化2 s,酒精梯度溶液脱水,二甲苯透明,滴加中性树胶封片。待切片晾干后放置于Olympus显微镜下观察拍照,最后将图片导入软件Image-Pro Plus 6.0,计算得到样本蛋白表达平均光密度值,并用 GraphPad Prism绘制各个蛋白的光密度值柱状图。
1.2.6TLR4、TLR7、MyD88、TRAF-6和AP-1基因mRNA相对表达量的检测 以β-actin为内参基因,采用RT-qPCR法检测犬十二指肠中TLR4、TLR7、MyD88、TRAF-6和AP-1 mRNA的相对表达量。根据GenBank中发表的TLR4、TLR7、MyD88、TRAF-6、AP-1及β-actin基因序列(GenBank登录号分别为NC_006593.3、NC_006597.3、NC_000019.10、NC_000022.11、NC_006600.3和NM_001003195.1),采用Oligo 7软件设计上、下游引物,引物序列如表1所示。引物由南京擎科生物科技有限公司合成。

表1 用于TLR4、TLR7、MyD88、TRAF-6和AP-1 mRNA相对表达量检测的qPCR引物参数Table 1 Detection qPCR primer parameters of TLR4,TLR7,MyD88,TRAF-6 and AP-1 mRNA
取出-80 ℃冻存的犬十二指肠样本,液氮中磨碎,加1 mL Trizol继续研磨,按提取试剂盒说明书中的步骤操作得到样本的总RNA,用反转录试剂盒将RNA反转录为cDNA。RT-qPCR反应体系:Sybrqpcr mix 10 μL,上游引物1 μL,下游引物1 μL,dd H2O 6 μL,cDNA 2 μL。RT-qPCR反应程序:95 ℃预变性2 min;94 ℃ 20 s,60 ℃ 20 s,72 ℃ 30 s,40个循环。对扩增结束后得到的数据采用2-ΔΔCt法进行分析,计算基因相对表达量。
1.2.7 TLR4、TLR7、MyD88、TRAF-6和AP-1蛋白表达量的测定 取出-80 ℃保存的犬十二指肠组织,置于配制好的RAPI裂解液中,充分混匀裂解后4 ℃下12 000 g离心10 min,得到样品总蛋白。采用Western Blots方法检测TLR4、TLR7、MyD88、TRAF-6和AP-1蛋白表达量,Western Blots上样量为40 μg/孔,浓缩胶电压75 V,分离胶电压120 V,电泳时间约120 min。用准备好的PVDF膜以300 mA恒流转膜26 min,将转膜结束后的PVDF膜放入5% BSA溶液中,室温于摇床上封闭2 h;用TBST稀释一抗(TLR4、TLR7、MyD88、TRAF-6和AP-1),将膜放入一抗溶液中,放于冰箱4 ℃孵育过夜。次日,取出PVDF膜,用TBST溶液清洗3次,每次5 min;加入稀释后的辣根酶二抗溶液,室温孵育30 min,TBST溶液清洗3次,每次5 min;将膜放入化学发光检测仪中,加入显色液,调整曝光条件开始检测,通过软件Quantity One测得条带的灰度值,以β-actin为内参蛋白,待测蛋白与β-actin蛋白灰度值的比值即待测蛋白的相对表达量。
1.2.8 数据分析 所有测得的数据均通过SPSS 软件进行进一步分析,数据结果以“平均数±标准差”表示,采用单因素方差分析法(One-way ANOVA)以及最小显著差数(LSD)法对试验数据进行数理统计分析。
2 结果与分析
2.1 黄芪多糖(APS)对犬血清中IL-2、IL-4和IL-6含量的影响
由表2~4可知,第0 天时,3组犬血清IL-2、IL-4和IL-6质量浓度差异均不显著(P>0.05)。第7 天时,APS低剂量组犬血清IL-2、IL-4和IL-6质量浓度较对照组显著升高(P<0.05);APS高剂量组较对照组极显著升高(P<0.01),较APS低剂量组显著升高(P<0.05)。第14 天时,与对照组相比,APS低剂量组犬血清IL-2和IL-6质量浓度极显著升高(P<0.01),IL-4质量浓度显著升高(P<0.05);APS高剂量组IL-2、IL-4和IL-6质量浓度均极显著升高(P<0.01),但与APS低剂量组相比,APS高剂量组IL-4和IL-6质量浓度升高不显著(P>0.05),而IL-2显著升高(P<0.05)。

表2 黄芪多糖(APS)对犬血清中IL-2水平的影响(n=6)Table 2 Effect of astragalus polysaccharide (APS) on IL-2 level in canine serum(n=6) pg/mL

表3 黄芪多糖(APS)对犬血清中IL-4水平的影响(n=6)Table 3 Effect of astragalus polysaccharide (APS) on IL-4 level in canine serum(n=6) pg/mL

表4 黄芪多糖(APS)对犬血清中IL-6水平的影响(n=6)Table 4 Effect of astragalus polysaccharide (APS) on IL-6 level in canine serum(n=6) pg/mL
2.2 黄芪多糖(APS)对犬十二指肠中5种Toll样受体蛋白肠道分布的影响
免疫组化试验中,目的蛋白阳性区域呈棕黄色,细胞核呈蓝色,细胞膜不着色。检测结果(图1)显示,TLR4、TLR7、MyD88、AP-1、TRAF-6蛋白均在十二指肠中表达,其主要表达区域为肠绒毛外侧与肠壁细胞内。
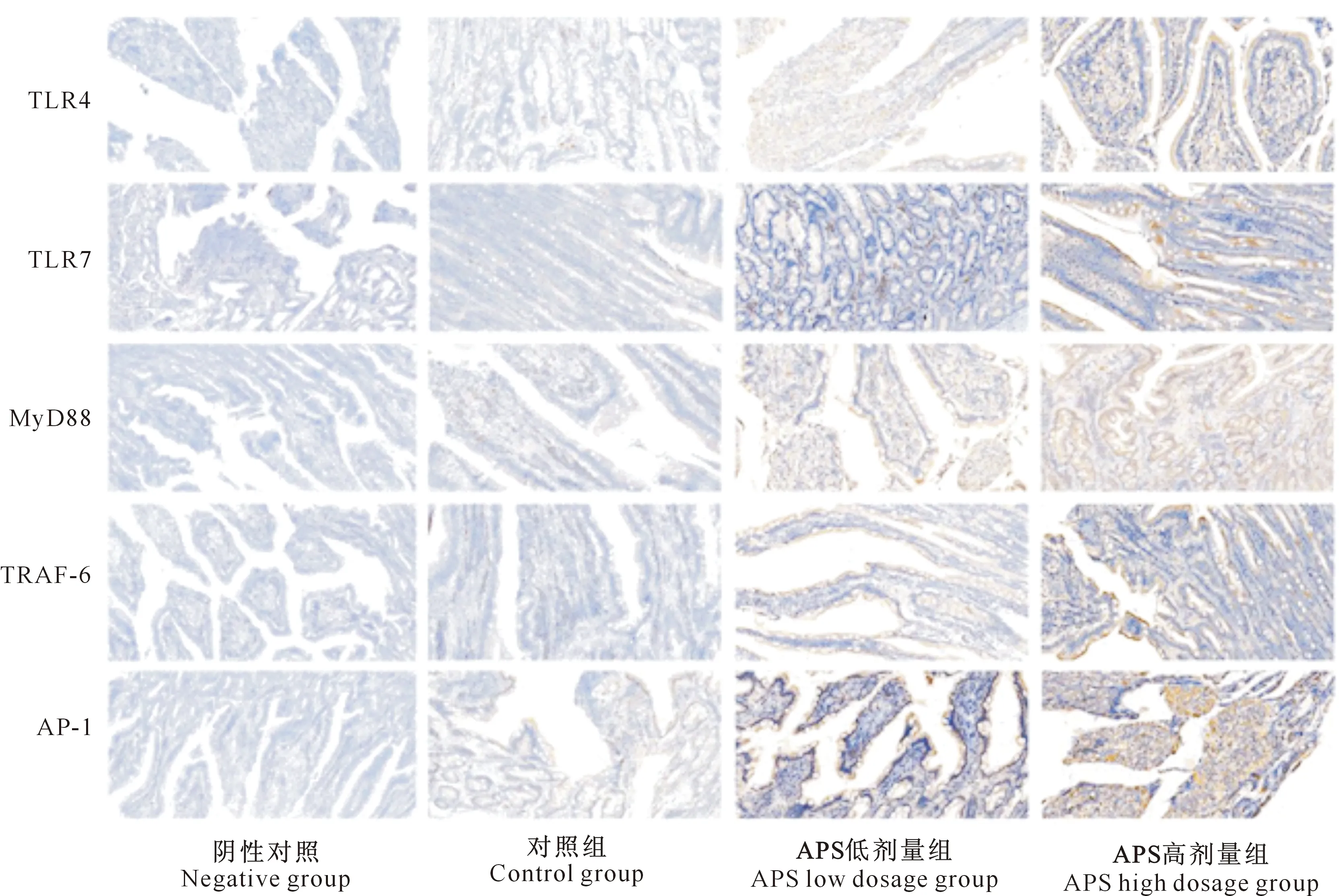
图1 不同剂量黄芪多糖影响下5种Toll样受体蛋白在犬十二指肠中的分布Fig.1 Distribution of five Toll-like receptor proteins in duodenum of canine treated by different doses of astragalus polysaccharide
由图2可知,APS低剂量组TLR4、TLR7、MyD88、TRAF-6和AP-1蛋白分布量(即平均光密度值)显著高于对照组(P<0.05),APS高剂量组TLR4、MyD88 、TRAF-6和AP-1蛋白分布量显著高于对照组(P<0.05),TLR7极显著高于对照组(P<0.01)。APS低剂量组与APS高剂量组相比,5种蛋白分布量均无显著差异(P>0.05)。
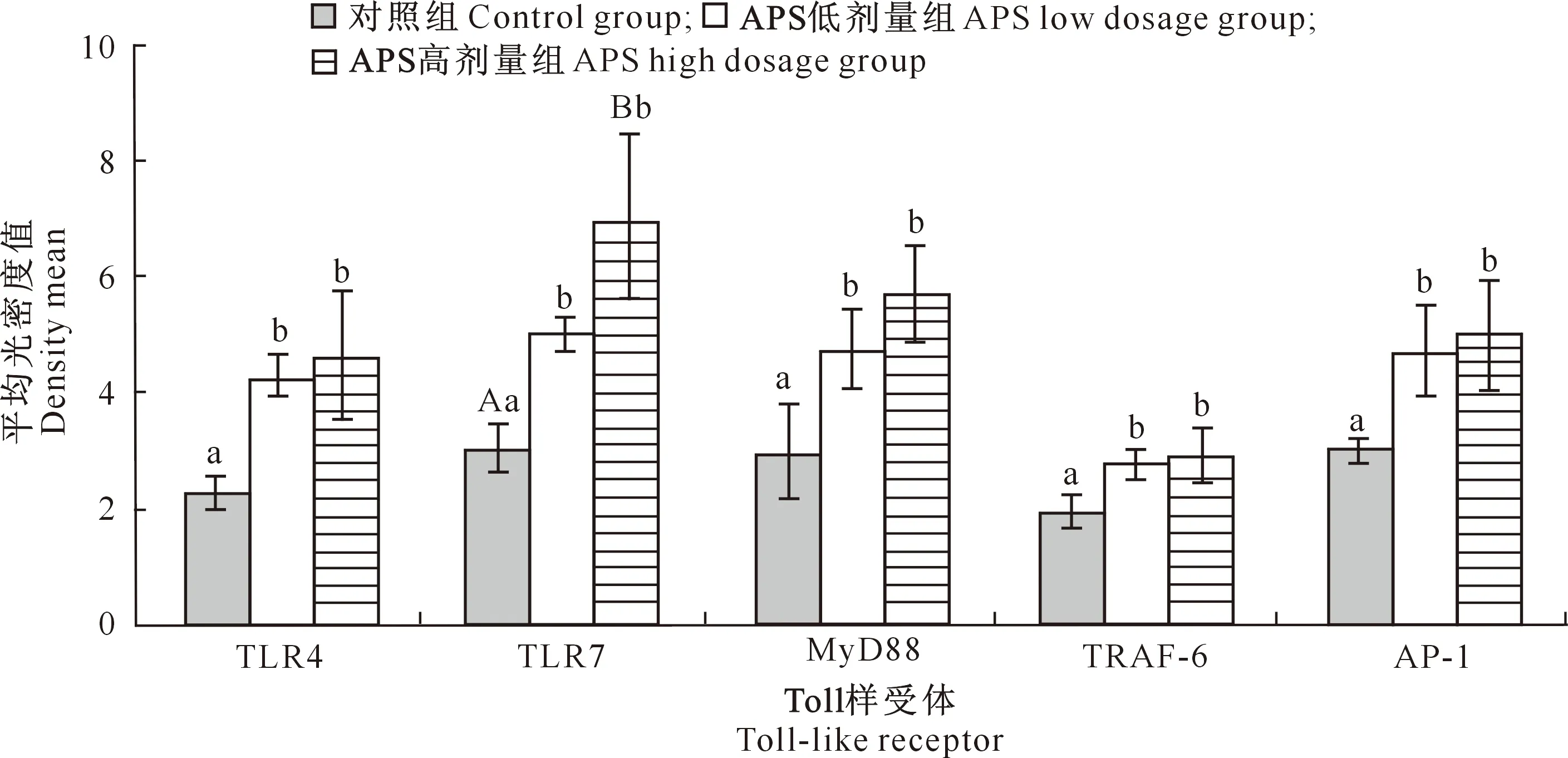
图柱上标不同小写字母表示差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01),下同Different lowercase letters indicate significant difference (P<0.05),and different uppercase letters indicate extremely significant difference (P<0.01),the same below图2 黄芪多糖(APS)对犬十二指肠中TLR4、TLR7、MyD88、TRAF-6和AP-1蛋白分布量的影响Fig.2 Effect of APS on distribution of TLR4,TLR7,MyD88,TRAF-6 and AP-1 proteins in canine duodenum
2.3 黄芪多糖(APS)对犬十二指肠中5种Toll样受体基因mRNA相对表达量的影响
由图3可知,APS低剂量组TLR4、TLR7、MyD88、TRAF-6和AP-1 mRNA相对表达量均显著高于对照组(P<0.05);APS高剂量组TLR4、TRAF-6和AP-1 mRNA相对表达量显著高于对照组(P<0.05),TLR7和MyD88 mRNA相对表达量极显著高于对照组(P<0.01)。APS低剂量组与APS高剂量组相比,5种基因 mRNA的相对表达量均无显著差异(P>0.05)。
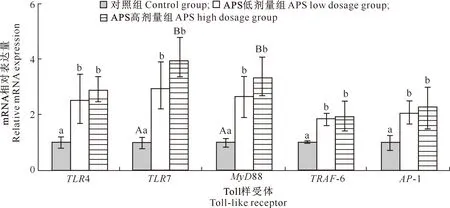
图3 黄芪多糖(APS)对犬十二指肠TLR4、TLR7、MyD88、TRAF-6和AP-1基因mRNA相对表达量的影响Fig.3 Effect of APS on the relative expression of TLR4,TLR7,MyD88,TRAF-6 and AP-1 mRNA in canine duodenum
2.4 黄芪多糖(APS)对犬十二指肠中5种Toll样受体蛋白表达量的影响
由图4可知,与对照组相比,APS低剂量组十二指肠TLR7、MyD88、TRAF-6和AP-1蛋白表达量显著上升(P<0.05),TLR4蛋白表达量极显著上升(P<0.01);APS高剂量组肠道TLR7和TRAF-6蛋白表达量显著上升(P<0.05),TLR4、MyD88和AP-1蛋白表达量极显著上升(P<0.01)。APS低剂量组与APS高剂量组相比,5种受体蛋白表达量差异均不显著(P>0.05)。
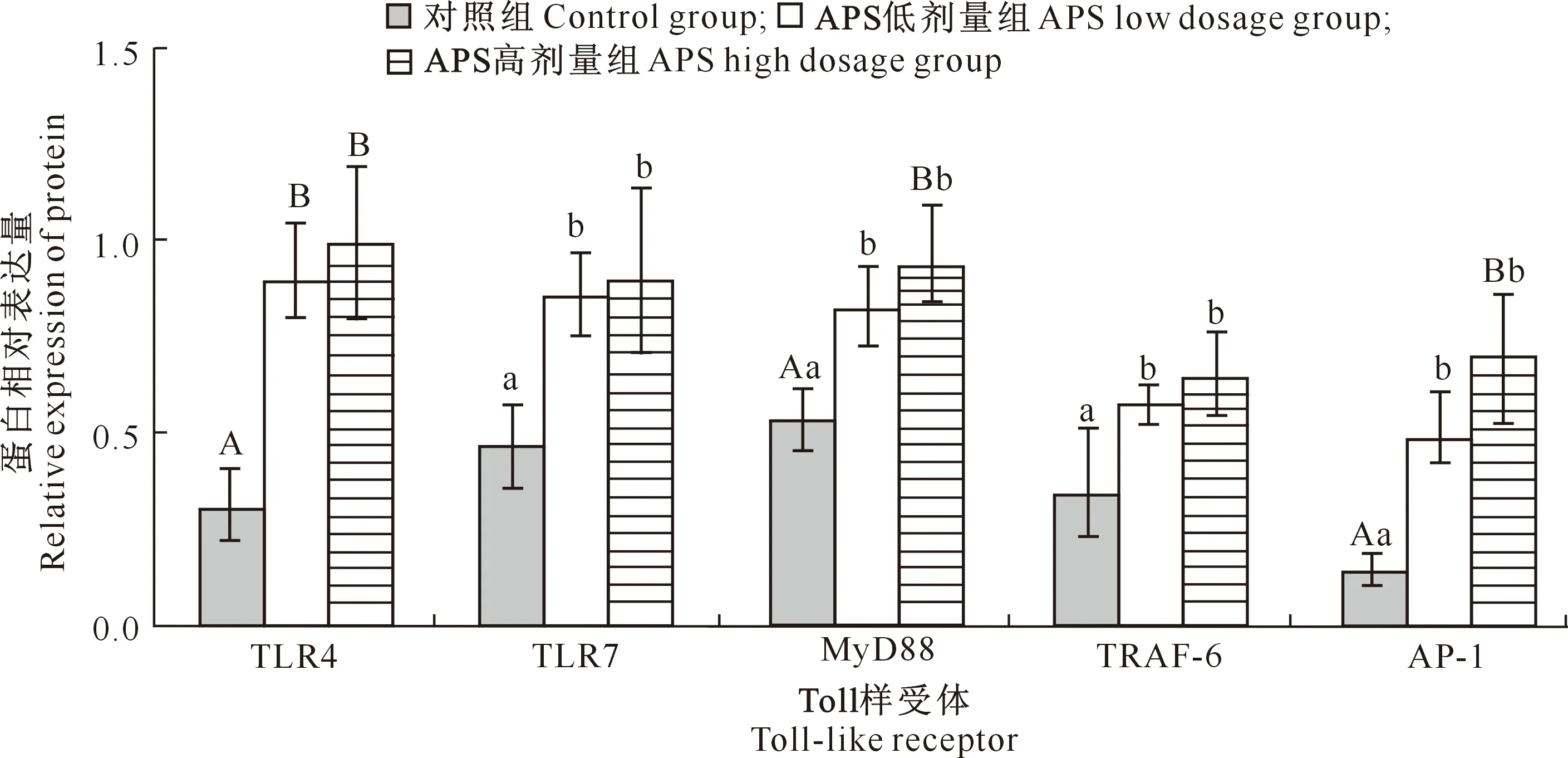
图4 黄芪多糖(APS)对犬十二指肠中TLR4、TLR7、MyD88、TRAF-6和 AP-1蛋白表达量的影响Fig.4 Effect of APS on expression of TLR4,TLR7,MyD88,TRAF-6 and AP-1 proteins in canine duodenum
3 讨 论
研究发现,黄芪多糖等中药多糖可以使血液中细胞免疫因子IL-2、IL-4和IL-6水平升高[16]。而血清中IL-2、IL-6水平升高,可刺激T细胞活性且能促进其分泌干扰素γ(IFN-γ),而且IL-2和IL-6可共同诱导细胞毒性T细胞增殖并延长其存活时间,从而起到抗肿瘤的作用[17]。IL-4在体内的主要作用为诱导淋巴B细胞增殖,增加免疫球蛋白分泌,提高机体体液免疫的能力[18]。因此,体内IL-2、IL-4、IL-6的适度提高可以增强机体免疫力,而过高的IL-2、IL-4、IL-6则会导致炎症的产生[19]。另外,在日粮中添加黄芪多糖可以使犬血清中IgG、IgA、IgM水平显著升高[20]。本研究发现,在犬日粮中加入1%和2%的黄芪多糖可以使血清IL-2、IL-4、IL-6水平显著升高;在第7 天时,黄芪多糖高剂量组IL-2、IL-4、IL-6水平显著高于黄芪多糖低剂量组;第14天时,黄芪多糖高剂量组IL-2水平显著高于黄芪多糖低剂量组,IL-4、IL-6与黄芪多糖低剂量组差异不显著。表明添加2%黄芪多糖可以短时间内使犬体内的IL-2、IL-4、IL-6升高至峰值,而添加1%黄芪多糖在饲喂14 d后也可以接近或达到添加2%黄芪多糖的效果。
Zhou等[21]研究证明,黄芪多糖可调节小鼠TLR4受体通路,并增加MyD88依赖型信号通路表达,Myd88蛋白可以通过影响下游蛋白TRAF-6与AP-1直接调节IL-6的分泌。另有研究表明,中药多糖可结合鸡淋巴细胞表面TLR4受体,介导TLR4通路下游TRIF依赖性途径,从而调节细胞免疫[22];TLR7受体蛋白通路则可以刺激淋巴B细胞产生IgG、IgA和IgM[23]。因此,Toll样受体通路可以通过影响细胞因子和免疫球蛋白分泌参与犬体内多种免疫反应。本研究发现,饲喂黄芪多糖可以显著提高犬肠道中TLR4、TLR7、MyD88、TRAF-6和AP-1蛋白及其mRNA的相对表达量,与之前研究结果相符,且这些蛋白及其mRNA相对表达量随黄芪多糖添加量的增加而增大,而血清IL-2、IL-4、IL-6水平与TLR4受体蛋白的变化趋势大致相符。
多项研究证明,日粮中添加黄芪多糖可有效提高动物的免疫力[24-25]。但关于黄芪多糖对Toll样受体通路影响的研究主要集中于禽类、小鼠以及小鼠细胞,其他动物涉及较少。本研究通过体内试验,探究了黄芪多糖对犬TLR4和TLR7受体通路的影响及对血清中IL-2、IL-4、IL-6水平的影响,但本研究目前只进行了体内饲喂试验,下一步将进行细胞试验,通过添加TLR4、TLR7通路蛋白抑制剂,验证黄芪多糖与IL-2、IL-4、IL-6水平的直接关联。
4 结 论
在犬日粮中添加黄芪多糖可显著提高血清中IL-2、IL-4和IL-6水平,增加肠道中TLR4、TLR7、MyD88、TRAF-6、AP-1蛋白水平及mRNA水平的相对表达量,通过调节Toll样受体信号通路提高机体免疫力。
