碳化硼促进Psendomonas stutzeri A1501电催化固氮产氨及机制
2021-05-29董国文任国平金曙光周顺桂
董国文,陈 飘,任国平,王 超,金曙光,叶 捷*,周顺桂
碳化硼促进A1501电催化固氮产氨及机制
董国文1,2,陈 飘1,任国平1,王 超1,金曙光3,叶 捷1*,周顺桂1
(1.福建农林大学资源与环境学院,福建省土壤健康与调查重点实验室,福建 福州 350002;2.三明学院资源与化工学院,福建 三明 365004;3.中国科学院生态环境研究中心,北京 100085)
以() A1501为模式固氮菌株、碳化硼(B4C)为典型电子传递载体构建电催化氮还原体系,探究B4C添加对该体系固氮产氨性能的影响.结果表明,B4C能够显著提高A1501介导的电催化氮还原体系的产氨性能.在0.4g/L投加量条件下,900℃煅烧温度下制备的B4C(B4C900)的添加能够使电催化体系氨累积量提高117%,这是由于B4C900表面丰富的活化位点能够促进N2吸附与活化.此外,电化学和光谱学谱图表明,B4C900的添加不仅能够促使A1501分泌更多的氧化还原活性物质,而且驱动高活性阴极生物膜的形成,进而强化电极电子的长距离传递及利用.
A1501;B4C;电催化;生物固氮
氮是构成生物的最主要元素之一,其在自然界中主要以氮气(N2)的形式存在[1].由于N2键能较高、活化困难,只有将N2有效转化为氨时,才能被生物体有效吸收和利用,因此固氮产氨过程在生物地球化学循环中起着至关重要的作用[2].传统的Haber- Bosch工艺能够利用铁基催化剂将空气中游离的氮转化为氨,但是该过程存在反应条件苛刻(105.1× 105~303×105Pa,300~550℃)、能耗高(14kW×h/kg NH3)、产生大量温室气体等问题[3].为克服Haber- Bosch工艺存在的缺陷,有研究学者以钼、铁、钴基过渡金属络合物作为催化剂驱动温和条件下的固氮产氨过程[4],但这些过渡金属络合物为均相催化剂,难以回收利用,且需要额外添加还原剂等物质,导致该技术的实用性不强.因此,开发简易高效的固氮产氨工艺是目前研究的热点.
电催化氮还原为近年来兴起的研究方向,该工艺具有常温常压操作和反应速率可控等明显优势,可为绿色、持续地固氮产氨提供有效途径[5].不同催化剂包括Mo2N、pAu/NF、TiO2等被广泛应用于电催化氮还原体系中[6],但是该过程仍然存在产物合成效率低及选择性差等缺点.虽然固氮酶的存在被证实能够有效克服传统电催化氮还原体系存在的问题[7],但由于其缺乏自我复制能力且耐氧性弱,因此限制了固氮酶介导的电催化氮还原体系的大规模推广应用[8].将固氮微生物与传统电催化氮还原体系相结合目前受到了广泛关注[9].相比于固氮酶,固氮微生物更能够适应复杂的环境,从而为实现氨的绿色合成带来了契机.但是目前对于固氮微生物介导的电催化氮还原体系的研究还处于起步阶段,仅有的研究结果显示该体系的固氮产氨效率较低[10],需要进一步优化改进.
提高固氮微生物介导的电催化氮还原体系产氨性能的核心是强化固氮微生物与电催化阴极微界面的相互作用,即促进电催化阴极电子的传递及利用[11].研究表明,固氮微生物介导的电催化氮还原体系中,阴极生物膜成膜是一个艰难且缓慢的过程,这主要是由于阴极作为电子供体,其表面所聚集的负电荷会对表面同样带负电的微生物产生排斥作用,进而影响固氮微生物附着于阴极表面接收电子[12].此外,还有研究显示,与阴极直接接触的生物膜的活性会随着代谢终产物的积累而显著降低,从而影响电极电子向生物膜外层及溶液中传输[13],进而降低固氮微生物介导的电催化氮还原体系产氨性能.相比于电极材料改性、微生物基因修饰/改造等手段,电子传递载体的添加被证实能够有效促进电极电子的传递与利用[14].目前常用的电子传递载体包括甲基紫精、铕(Ⅲ/Ⅱ)基配合物、钴铈阳离子络合物等[15].但是这些电子传递载体的制备方法较为复杂且价格昂贵,不利于规模化推广应用.相比较下,碳化硼(B4C)由于具有良好的机械强度、(电)化学稳定性及导电性而引起研究者的广泛关注[16].Qiu等[17]研究显示,B4C表面存在不同的活性位点,能够有效促进N2吸附.Yu等[18]证实,碳基骨架的硼掺杂能够促进电子密度的重新分布,进而增强其与电子及N2结合能力.与此同时,B4C虽然在高温下制备,但其克服了传统工艺中的高压、使用高纯N2和H2作为载流体等问题.并且传统工艺制备的材料多以铁或钌基金属为主,而碳化硼可以有效避免金属离子的排放,在一定程度上减少对环境造成污染的风险.但是目前尚未有研究将B4C应用于固氮微生物介导的电催化氮还原体系,其对该体系固氮产氨性能的影响及作用机制也不明确.
A1501是我国从水稻根际分离出的一株内生固氮菌,在微好氧条件下具有较强的生物固氮能力[19].已有研究证明该菌株能够接收胞外电子驱动自身代谢[20],且在缺乏碳源时,代谢合成的NH3难以被同化利用而分泌到胞外[21].因此,本研究以A1501为模式固氮菌株、B4C为典型电子传递载体构建固氮微生物介导的电催化氮还原体系,探究不同条件下该体系产氨性能,分析B4C的添加对反应体系浮游微生物及阴极生物膜分布及氧化还原活性的影响,阐明相关电子传递机制,以期为构建高效的电催化固氮产氨体系提供新的见解.
1 材料与方法
1.1 B4C的合成及P. stutzeri A1501的培养
将硼酸和可溶性淀粉以1:5的质量比在玛瑙研钵中充分研磨以制备B4C的混合前驱体.随后将制备好的混合前驱体置于合肥科晶材料技术有限公司GSL-1100X-S气氛管式电阻炉中,设置煅烧温度分别为500, 700, 900, 1100℃,在氩气条件下煅烧3h.待冷却后将所得产物用0.1mol/L HCl洗涤3次,再用去离子水反复冲洗3次,随后将所有样品置于德国Alpha 1-4LDplusde冻干机冷冻干燥备用[18].最终得到的样品标记为B4C,其中为煅烧温度.
A1501由中国农业科学院林敏研究员提供.将获得的A1501接入LB培养基中,置于30℃恒温培养箱中培养,收集对数期的菌液(OD600≈0.6),4℃保存作为原始菌液.实验过程中所使用的菌液是将原始菌液按5%接种量进行二次培养所获得的对数期菌液(OD600≈0.6).然后取1000mL对数期菌液,在6000r/min条件下离心5min,去掉上清液,用等量0.9%生理盐水重悬浮,重复3次,然后加入10mL的生理盐水备用.
1.2 电催化体系的构建及固氮产氨实验
构建H型双室电催化反应器[22],各室总体积为150mL,中间以Nafion 117质子交换膜分隔[23].将改良后的无机培养基(去除乳酸和氯化铵)和一定量的B4C接入阴极室(100mL,pH=6.8),阳极室接入磷酸盐缓冲溶液(110mL,pH=7).将反应器置于高温灭菌锅121℃灭菌30min,冷却后曝氮气1h去除2个室的氧气.然后将1mL准备好的A1501菌液接入阴极室中.最后将反应器接入辰华CHI1000C电化学工作站,在30℃恒温培养箱中进行培养反应.反应器工作电极和对电极均采用石墨板(30mm×20mm×3mm),参比电极为饱和甘汞电极(SCE).设置一定电压,每60s记录电流1次,每隔24h测定反应器中氨的累积量.
为探究不同操作条件对A1501介导的电催化体系固氮产氨性能的影响,实验设置不同处理,包括不同煅烧温度(B4C500、B4C700、B4C900、B4C1100)、投加量(0, 0.2, 0.4, 0.6, 0.8g/L)及电压条件(-0.3, -0.5, -0.7, -0.9V).通过对照实验评估驱动电催化体系固氮产氨的关键因素.此外,为了分析所产生氨中N元素的来源,将20mL15N标记的N2注入反应器中,反应16d后利用赛默飞253plus同位素质谱仪测定15N(/= 29)/14N(/=28)的比率.所有实验均设置3组重复.
1.3 分析方法
采用靛酚蓝比色法进行NH4+浓度测定[24].采用赛默飞IS 50FTIR傅里叶红外光谱分析仪分析B4C官能团[25].采用美国康塔仪器公司AutoChem II2920全自动程序升温化学吸附仪(TPD)研究B4C对N2的吸附能力[26].采用辰华CHI 660E电化学工作站进行B4C接受电子能力(EAC)和提供电子能力(EDC)及循环伏安(CV)测定[27-28].采用阿美特克VersaSCAN SECM进行SECM光谱扫描,扫描速率为200 μm/s[29].采用赛默飞原位电化学-傅里叶红外变换光谱仪(FTIR)对样品进行表征[30].采用赛默飞LIVE/DEAD BacLight Bacterial Viability Kit试剂盒测定细胞活/死比率[31].使用德国卡尔蔡司公司Zeiss Sigma 300场发射扫描电镜对样品形貌进行表征.
通过ART Prism 7500序列检测系统进行实时定量PCR测定.用于qRT-PCR的引物对RT、RT、RT、RT的序列参照于Zhan 等[32].扩增和检测特异性产物方法为:95℃10min;95℃30s,40个循环;55℃1min;72℃30s,然后进行解离曲线分析.以16sRNA作为内参基因,相对基因表达量用2-∆∆CT计算[33].
采用origin 9.0软件进行数据处理,并利用SPSS 22.0软件中的检验来进行数据分析,当< 0.05认为具有统计学意义.
2 结果与讨论
2.1 B4C表征
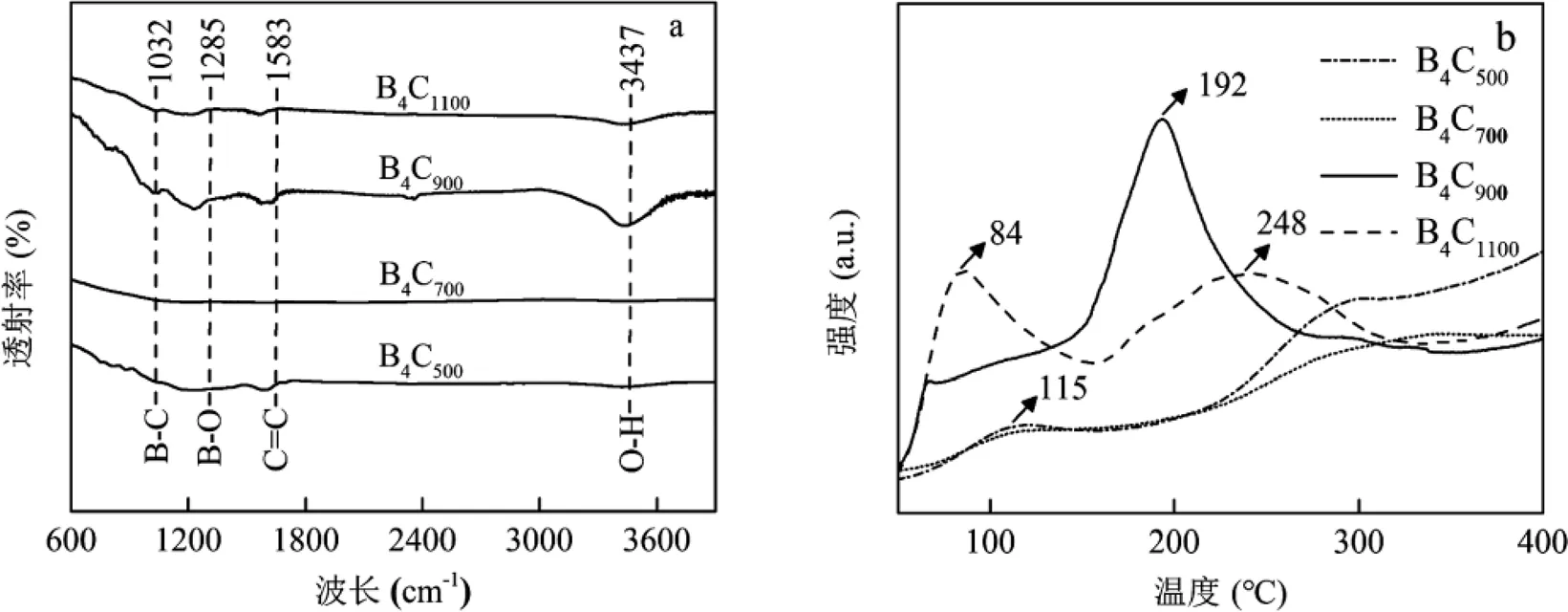
a: FTIR光谱图;b: N2-TPD图;c: EAC图;d: EDC图
对不同温度制备的B4C材料进行傅里叶红外光谱表征,结果如图1a所示.在所制备样品中,以3437和1583cm-1为中心的特征峰分别归因于O-H键的拉伸振动及C=C键的拉伸振动[18].此外,在1285和1032cm-1处出现了2个明显的特征峰,分别为B-O键和B-C键的拉伸振动[18].这表明成功制备了B4C材料,其中B4C900具有最强的红外响应.通过程序升温脱附实验来测定B4C材料对N2的吸附性能.如图1b所示,不同温度制备的B4C材料具有不同的N2物理吸附的解吸峰.相比于B4C500和B4C700而言,B4C900存在更高的N2解吸温度且峰面积更大,这意味着适当提高煅烧温度能够有效活化材料表面的吸附位点,促进N2吸附[34].但是当温度过高时,容易导致材料结构发生变化,从而减少其表面有效N2吸附位点(B4C1100).此外,由EAC及EDC组成的电子交换容量是表征材料氧化还原活性的重要指标[35].研究结果显示(图1c、d),随着B4C悬浮液的加入,EAC及EDC均出现了明显的电流响应,证实B4C具有接收及提供电子能力,这可能是归因于碳主链之间快速的电子传递动力学特性[36].这其中B4C900的电流峰面积最大,意味着其所转移的电子数最多.本研究还发现B4C900的EAC值明显高于其EDC值,说明B4C900表面的氧化还原基团主要处于氧化状态,这有利于其从电极表面接收电子[37].
2.2 B4C促进电催化体系固氮产氨性能
不同煅烧温度对B4C-A1501介导的电催化体系固氮产氨性能的影响如图2a所示.虽然添加不同B4C(B4C500、B4C700、B4C900、B4C1100)体系中均能检测到氨的持续产生,但是从第2d开始, B4C900体系中氨的累积量逐渐高于其它反应体系.第14d时B4C900体系中氨累积量达到(1.192±0.08) mg/L,比B4C500、B4C700、B4C1100分别提高了71.42%、53.19%、26.31%.这些结果表明,900℃是制备B4C的最佳煅烧温度.
不同B4C900投加量对B4C900-A1501介导的电催化体系固氮产氨性能的影响如图2b所示.随着B4C900投加量的增加,反应器产氨性能逐渐增强,在投加量为0.4g/L条件下氨的累积量达到最大值.此后,随着B4C900投加量的继续增加,氨累积量却呈现出降低的趋势.这可能是由于过多的B4C900会导致彼此之间聚集而沉淀,不仅造成表面有效N2吸附位点的减少,而且影响B4C900对电极电子的捕获及利用.
不同电压对B4C900-A1501介导的电催化体系固氮产氨性能的影响如图2c所示.当电压从-0.3V增加到-0.9V时,反应器中氨累积量呈现先增加后降低的趋势.当电压为-0.5V时,反应器的氨累积量达到最大值.这可能是因为过低的电势不足以提供足够的电子驱动N2还原,而电势过高不仅会加剧竞争性析氢反应的进行,而且会影响细胞内外氧化还原电位,进而可能造成微生物的死亡[38].
如图2d所示,在仅有A1501的条件下,经过2d的培养仅有少量氨生成((0.015±0.03)mg/L),这可能是由于A1501二次培养过程中残留的代谢产物而引起.而在没有电极的条件下,各系统的固氮产氨性能均较低,这说明电极作为电子供体是该体系固氮产氨过程的重要因素之一.相比较之下,当没有B4C900的条件下,A1501能够接收电极电子进行固氮产氨过程,其氨累积量达到了(0.43±0.05)mg/L.而随着B4C900的添加,氨累积量提高了117%,这说明B4C900显著提高了生物电催化体系固氮产氨性能.
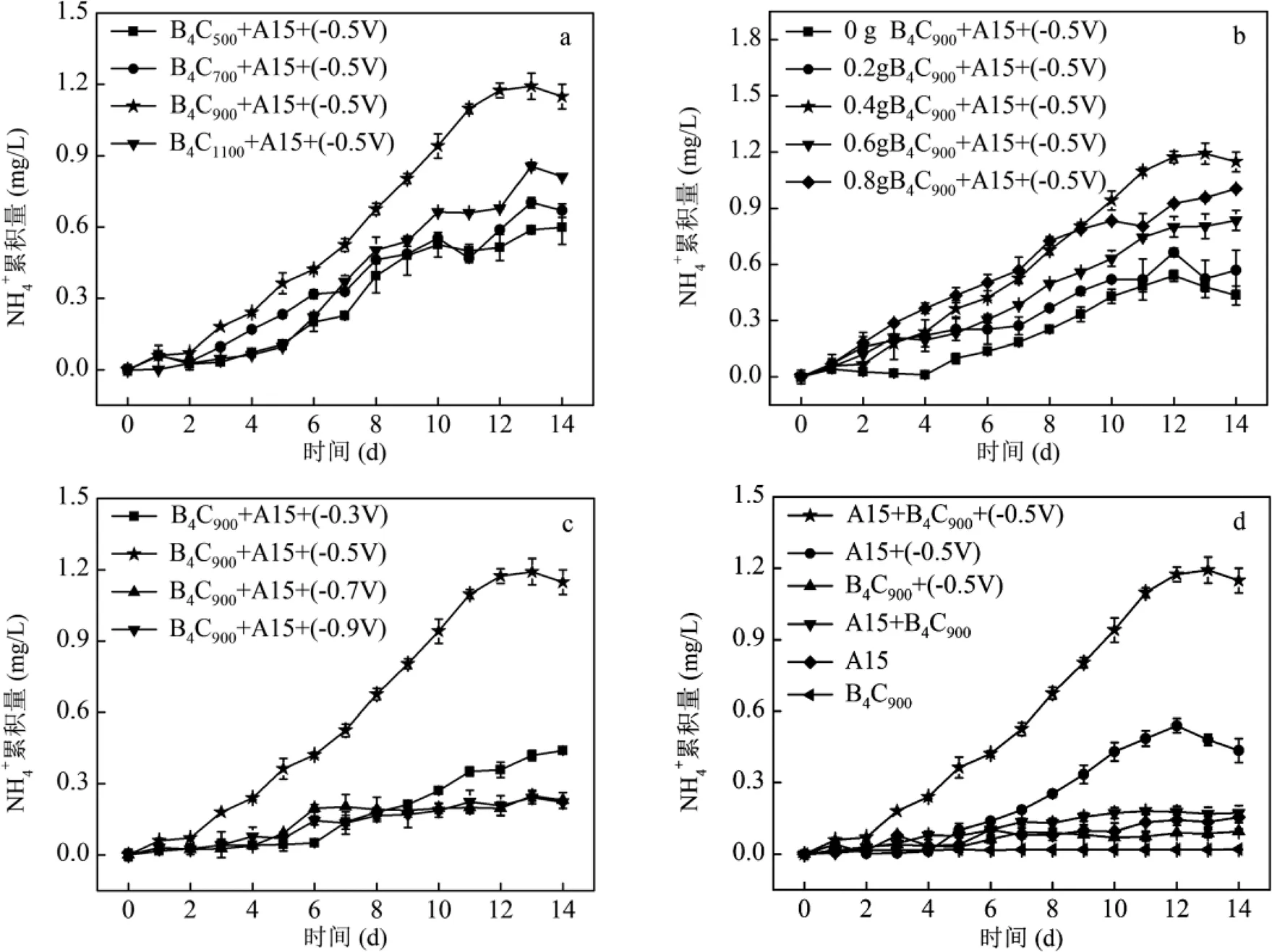
a:不同温度制备的B4C材料的氨累积量;b:不同B4C900材料投加量的氨累积量;c:不同电压下的氨累积量;d:纯材料、纯菌及不加电体系的氨累积量;e:对照组A15+(-0.5V)的15N/14N和14N/14N同位素比质谱图;f:实验组A15+B4C900+(-0.5V)的15N/14N和14N/14N同位素比质谱图;g:对照组和实验组的基因相对转录丰度
利用元素分析仪-同位素质谱法分析对照组(图2e)和实验组(图2f)δ15N信号.结果显示,实验组相比于对照组具有更高的15N/14N比率,因此证实在B4C900存在的条件下,A1501具有更强的固氮能力[34].A1501主要通过胞内固氮酶的复合物实现N2还原产氨[39].这些胞内固氮酶复合物主要是由及等基因编码组成[32,40].为了探究B4C900-A1501介导的电催化体系固氮产氨量增加的原因,对不同体系的固氮酶基因表达进行定量PCR检测.结果表明(图2g),在实验组(A1501+B4C900+(-0.5V))体系中,A1501固氮酶的4个关键基因的相对转录丰度都比对照组(A1501+(-0.5V))高出4倍以上,这为B4C900-A1501介导的电催化体系固氮产氨提供了有力证据.
2.3 B4C900提高溶液氧化还原活性
如图3a、b所示,相比于对照组(A1501+(-0.5V)),A1501 +(-0.5V)+ B4C900反应器中添加的B4C900与A1501有较紧密的结合,这可能是归因于B4C900较大的比表面积能够为微生物的富集提供载体,从而驱动二者之间进行电子传递与交换.
利用循环伏安法(CV)进一步评估B4C900添加对溶液氧化还原活性的影响.图3c~d为实验组(A1501 +(-0.5V)+ B4C900)和对照组(A1501+(-0.5V))溶液样品在第0d和第14d循环伏安图谱和相应的CV基线处理图谱.CV曲线形状越接近矩形,表明电容性越好[41].由图4c可知,随着反应的进行,两个体系的电容都逐渐增加,且B4C900实验组的电容大于对照组.电容计算结果显示,实验组与对照组在第14d时电容分别为15.39及9.77mF/cm2,这说明B4C900的添加可以有效提高电催化体系的氧化还原活性.此外,不同电位的特征峰表征不同的氧化还原活性物质,其能够有效介导电子传递过程[42].如图3d所示,随着反应进行,实验组和对照组都出现了不同的特征峰,且实验组的特征峰峰值电流明显比对照组高.有研究表明,峰值与细胞表面的氧化还原活性物质含量呈正相关[43].因此,B4C900的添加可促使溶液A1501分泌更多的氧化还原活性物质,从而驱动固氮产氨过程.虽然尚不清楚这些氧化还原物质如何参与电子转移,但是暗示A1501可通过不同的电子转移途径从电极获取电子.需要指出的是,在体系中加入B4C900后,实验组中出现了新的氧化还原峰(-0.03V(1)和-0.01V(2)),有研究表明该特征峰处的物质接近于细胞色素C-500[20].
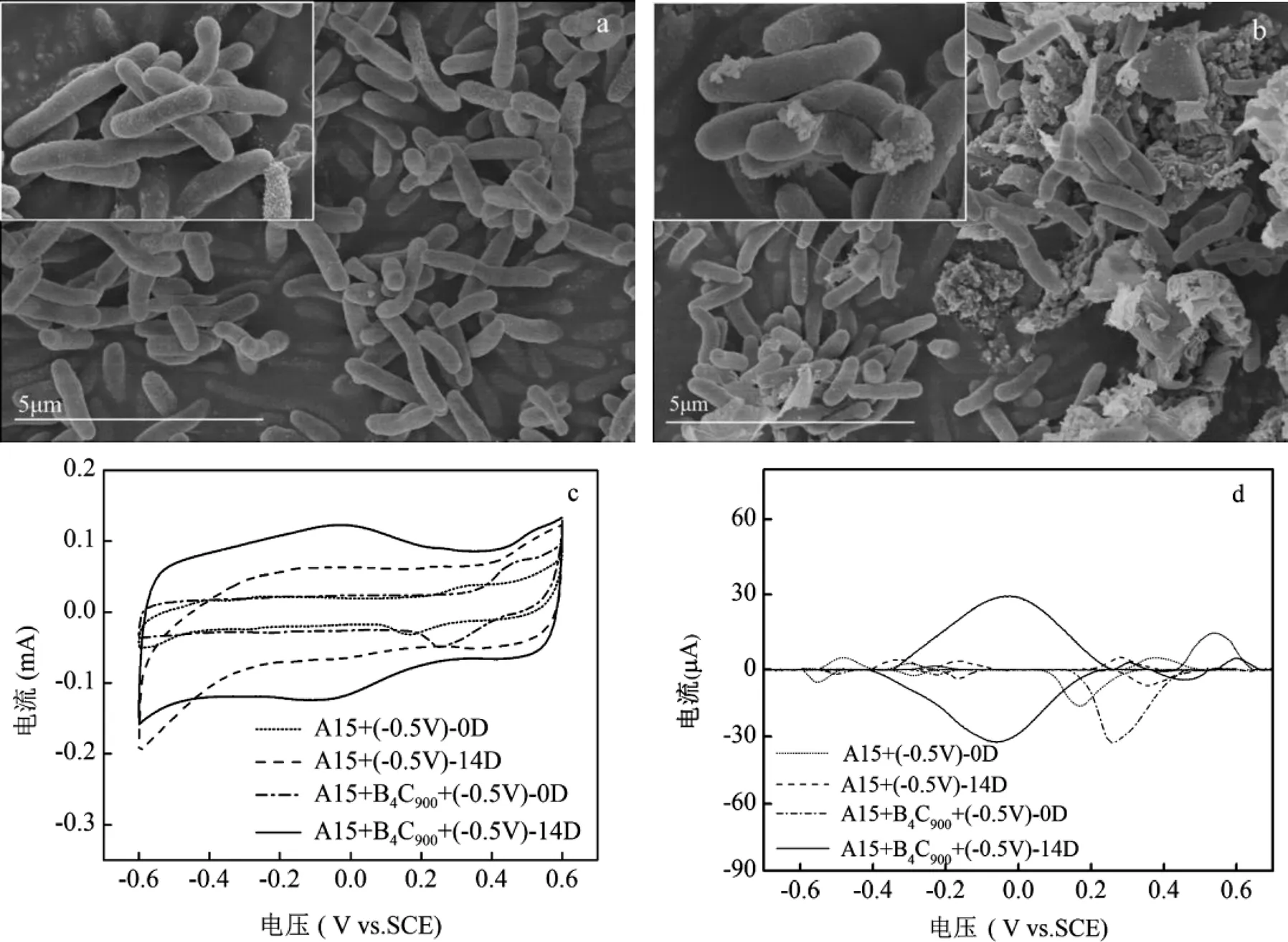
图3 对照组P. stutzeri A1501+(-0.5V)与实验组P. stutzeri A1501+B4C900+(-0.5V)生物扫描电镜图(SEM)和循环伏安(CV)表征
a:对照组的扫描电子显微镜图(内插图为SEM放大图);b:实验组的扫描电子显微镜图(内插图为SEM放大图);c:对照组和实验组的第0d, 第14d的CV图;d:对照组和实验组的第0d、第14d CV基线处理图
如图4a所示,未添加B4C900的对照组(A1501+(-0.5V))分别在1205, 1400, 1457, 1552和1643cm-1处出现5个红外吸收峰.1643cm-1的吸收峰可能与细胞色素中的氨基I或氨基II伸缩振动有关[44].1552cm-1的吸收峰可能是由于酰胺II键的C=N伸缩振动引起[45].1457和1400cm-1处的吸收峰可能是与多糖有关的C-OH、C-H2、C-H3变形振动和血红素相关的O-H变形振动引起[46].1205cm-1的信号主要来自于核酸[48].与对照组相比,B4C900的添加导致位于1205cm-1处的特征峰消失,同时,在1737, 1335, 1245和1168cm-1处出现了新的特征峰.随着电势从-0.8V增加到+0.4V,这些特征峰的吸收峰值也随之变化,证明这些氧化还原基团位于A1501生物膜[47].以上结果表明,在体系中添加B4C900会使A1501出现更多氧化还原活性基团,这可能对促进胞外电子传递和产氨效率有积极的作用.
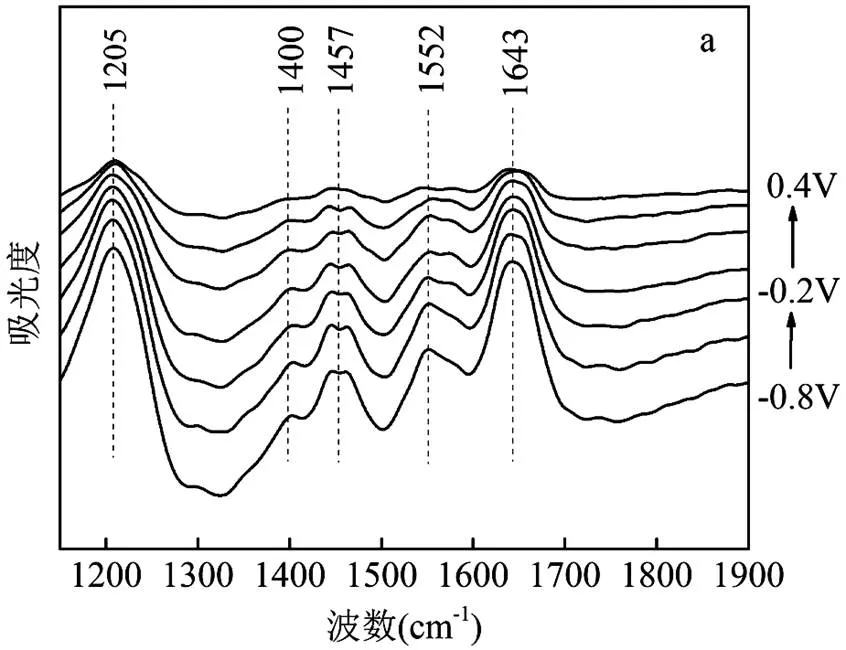
利用2DCOS进一步分析B4C900的添加对氧化还原基团结构的影响.交叉峰的正负值不仅可以表征构型变化方向的异同,还可以分析不同氧化还原基团的变换顺序[44].表1列出实验组的每个交叉峰所对应的基团波数和符号.其中,1737和1643cm-1、1457和1400cm-1、1400和1335cm-1、1245和1168cm-1交叉峰为正,表明构型变化方向相同;1552和1457cm-1、1335和1245cm-1交叉峰为负,表明构型变化方向相反.根据Noda’s的规则,基团变化顺序为:羧基C=O伸缩振动→酰胺II键C=N伸缩振动→细胞细胞色素中的氨基I或氨基II伸缩振动→与磷酸化蛋白相关的P-O伸缩振动→与多糖有关的C-OH、C-H2、C-H3变形振动→与血红素相关C-O伸缩振动→与血红素相关O-H变形振动→与脂肪质相关的C-H变形振动(表1).

表1 实验组P. stutzeri A1501+B4C900+(-0.5V) 从- 0.8V到+ 0.4V的2DCOS同步和异步图分析
注:+/-表示同步图对应峰的正负; (+)/(-)表示异步图对应峰的正负.
2.4 B4C900促进高活性阴极生物膜形成
阴极生物膜的组成和活性对电极电子的远距离传输及利用有着重要影响[14].通过SEM可以直观观察A1501在阴极的成膜状况.如图5a、b所示, B4C900的添加能够有效促进A1501在阴极表面的附着,这有利于i A1501直接接收电极电子进行产氨.此外,还发现B4C900的添加能够驱动A1501在电极表面分泌类似于纳米导线的物质,虽然这些物质的产生及作用机制尚未被证实,但值得进一步深入研究.为了进一步观察B4C900添加对A1501生物膜活性的影响,对运行第10d的阴极生物膜进行活/死细胞染色实验.结果显示,对照组(A1501+(-0.5V))电极表面的生物膜主要由死菌组成,这将抑制生物膜中化学物质的传输及电极电子的长距离传递[46],从而影响体系的固氮产氨性能.B4C900的添加不仅能够促进电极表面生物膜厚度显著增加,而且导致活/死细胞比例也从10.2%提高到了80.6%,这可能是由于阴极生物膜中的B4C900能够作为导体促进电极电子从电极表面传输至远离电极的浮游微生物,从而有利于维持电极表面的微环境(合适的pH值等)[48];此外,B4C900存在能够导致不均匀生物膜的形成,这有利于降低气体在生物膜内聚集从而影响A1501的活性[49].
微区扫描电化学显微镜(SECM)是一种新颖的扫描探针技术,可了解电极上不同类型的电化学底物浓度和空间分布状态,并记录电流响应[50].从图6c、d中可以看出添加B4C900反应器比未添加B4C900的反应器出现更多的电流高峰,表明在微米尺度上的电极表面具有更高的氧化还原活性且导电小分子浓度更高[51],其最高电流峰值达到-0.59mA.以上结果表明,添加B4C900会促进阴极表面氧化还原活性小分子的生成,这为A1501从电极获得电子进行固氮产氨提供了有力证据.
综上所述,在反应器溶液中,B4C900可以接收电极电子以及传递电子(图7),有效地缩短溶液中电极电子到A1501的距离,且可促使溶液中的A1501分泌更多的氧化还原活性物质,从而驱动固氮产氨过程.同时,B4C900的添加能够有效促进A1501在阴极表面的附着,这有利于i A1501接收电极电子进行产氨.此外,碳化硼促进A1501电催化固氮产氨工艺有效克服了传统固氮产氨工艺需要高压条件、且使用高纯N2和H2作为载流体等问题,并且无需使用金属催化剂,从而有效避免金属离子的排放,在一定程度上减少了环境污染的风险.但是该工艺也存在一些问题有待改进.比如:(1)尽管B4C900的添加能够有效改善该体系的产氨效率,但该工艺的法拉第效率较低,这可能是由于阴极发生析氢反应,进而与固氮反应形成竞争关系争夺氢离子,从而降低该体系的固氮产氨效率;(2)所使用的B4C900是在900℃下煅烧而成,较高的温度限制了该工艺在实际过程中的应用与推广.因此,在接下来的研究中需要对这些问题进一步探索.

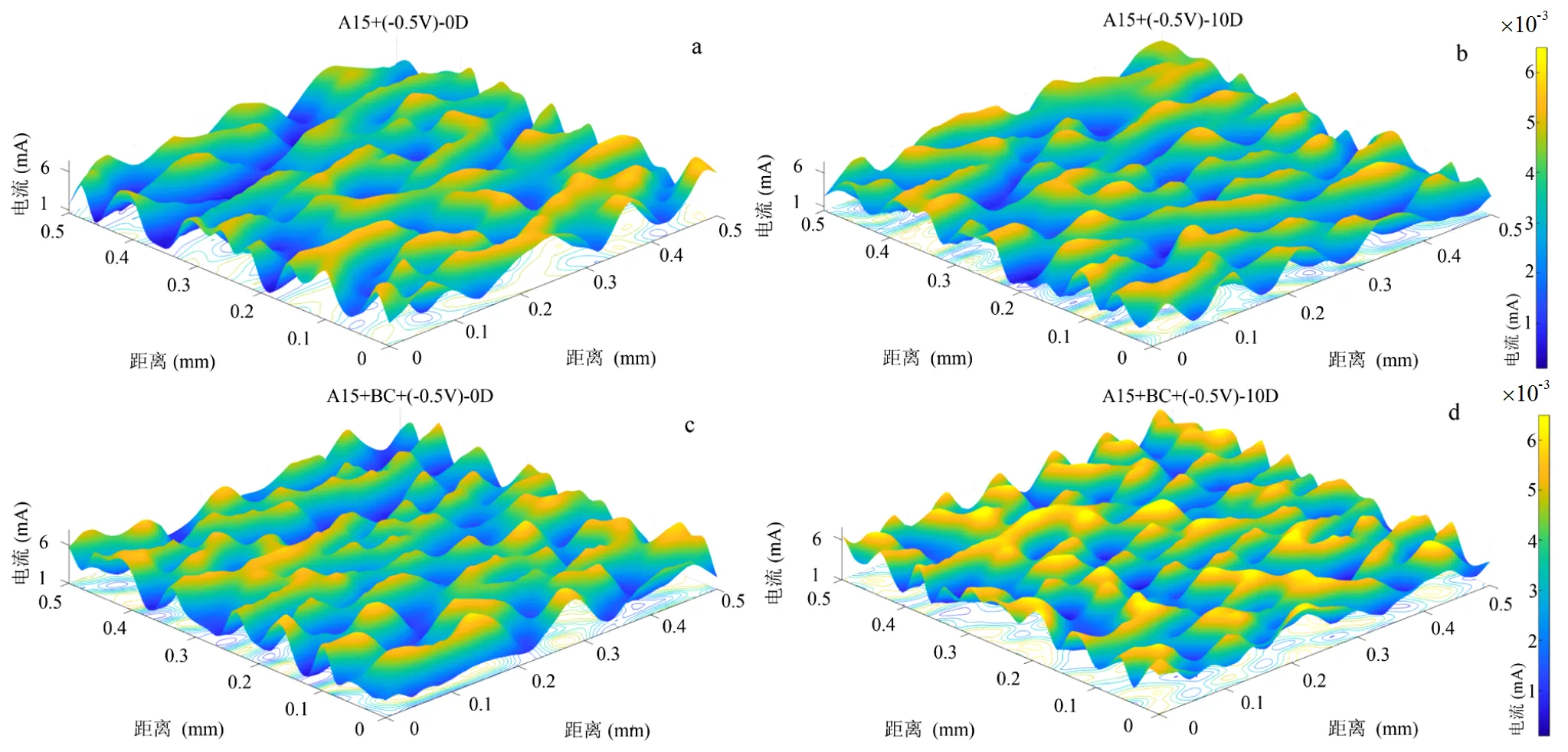
图6 阴极表面的微区扫描电子显微镜图(SECM)
a: 对照组A1501+(-0.5V)第0d SECM图;b: 对照组第10d SECM图;c: 实验组A1501+B4C900+(-0.5V)第0d SECM图;d: 实验组第10d SECM图

图7 B4C900驱动生物电催化体系固氮产氨的机理
3 结论
3.1 B4C可以有效强化A1501介导的电催化体系固氮产氨性能.在0.4g/L投加量条件下, 900 ℃煅烧温度下制备的B4C(B4C900)的添加促使电催化体系氨的累积量提高117%.
3.2 B4C900表面丰富的活性位点能够有效促进N2吸附与活化,较大的比表面积能够为微生物的富集提供载体,并且促使溶液中A1501分泌更多的氧化还原活性物质.
3.3 B4C900的添加可以有效驱动高活性阴极生物膜的形成,它能够作为导体强化电极电子的长距离传递及利用.本研究结果为固氮微生物介导的电催化氮还原体系的实际应用提供了新的见解.
[1] Barbara K, David J. Mechanism of molybdenum nitrogenase [J]. Chemical Reviews, 1996,96(7):2983-3012.
[2] McGlynn S E, Boyd E S, Peters J W, et al. Classifying the metal dependence of uncharacterized nitrogenases [J]. Frontiers in Microbiology, 2013,3(10):1-8.
[3] 任晓玲,严孝清,龚湘姣,等.光(电)催化氮气还原合成氨研究进展 [J]. 化工进展, 2020,39(12):4856-4876.Ren X L, Yan X Q, Gong X J, et al. Research progress of light (electro) catalytic reduction of nitrogen to ammonia [J]. Chemical Industry and Engineering Progress, 2020,39(12):4856-4876.
[4] Yandulov D V, Schrock R R. Catalytic reduction of dinitrogen to ammonia at a single molybdenum center [J]. Science, 2003,301(5629): 76-78.
[5] Sclafani A, Augugliaro V, Schiavello M. Dinitrogen electrochemical reduction to ammonia over iron cathode in aqueous medium [J]. Journal of the Electrochemical Society, 1983,130(3):734-735.
[6] 喻兰兰,秦疆州,杨 涵,等.电催化固氮的研究进展与挑战 [J]. 工业催化, 2019,27(10):1-6. Yu L L, Qin J Z, Yang H, et al. Research progress and challenges of electrocatalytic nitrogen fixation [J]. Industrial Catalysis, 2019,27(10): 1-6.
[7] Brown K A, Harris D F, Wilker M B, et al. Light-driven dinitrogen reduction catalyzed by a CdS: nitrogenase MoFe protein biohybrid [J]. Science, 2016,352(6248):448-44.
[8] 肖 瑶,胡文娟,任衍彪,等.仿生光电催化氮气还原 [J]. 化学进展, 2018,30(4):325-337. Xiao Y, Hu W J, Ren Y B, et al. Bioinspired photo/electrocatalytic N2Fixation [J]. Progress in Chemistry, 2018,30(4):325-337.
[9] Dmitry V, Yandulov, Schrock R R. Catalytic reduction of dinitrogen to ammonia at a single molybdenum center [J]. Science, 2014,301(76): 76-78.
[10] Juan F, Ortiz-Medina, Amy M, et al. Nitrogen gas fixation and conversion to ammonium using microbial electrolysis cells [J]. ACS Sustainable Chemistry & Engineering, 2019,7(3):3511-3519.
[11] Rago L, Zecchin S, Villa F, et al. Bioelectrochemical nitrogen fixation (e-BNF): Electro-stimulation of enriched biofilm communities drives autotrophic nitrogen and carbon fixation [J]. Bioelectrochemistry, 2019,125:105-115.
[12] Zottola E A, Sasahara K C. Microbial biofilms in the food processing industry — Should they be a concern? [J]. International Journal of Food Microbiology, 1994,23(1994):125-148.
[13] Baranitharan E, Khan M R, Prasad D M R, et al. Effect of biofilm formation on the performance of microbial fuel cell for the treatment of palm oil mill effluent [J]. Bioprocess and Biosystems Engineering, 2014,38(1):15-24.
[14] Lovley D R. Syntrophy goes electric: direct interspecies electron transfer [J]. Annual Review of Microbiology, 2017,71(1):643-664.
[15] Wu Y D, Liu T X, Li X M, et al. Exogenous electron shuttle-mediated extracellular electron transfer of200: electrochemical parameters and thermodynamics [J]. Environmental ScienceTechnology, 2014,48(16):9306-9314.
[16] Vineesh T V, Kumar M P, Takahashi C, et al. Bifunctional electrocatalytic activity of boron-doped graphene derived from boron carbide [J]. Advanced Energy Materials, 2015,5(17):1500658.
[17] Qiu F, Chu J G, Hu W, et al. Study of effect of Zr addition on the microstructures and mechanical properties of (TiC-TiB2)/Cu composites by combustion synthesis and hot press consolidation in the Cu-Ti-B4C-Zr system [J]. Materials Research Bulletin, 2015,70:167- 172.
[18] Yu X M, Han P, Wei Z X, et al. Boron-Doped Graphene for electrocatalytic N2reduction [J]. Joule, 2018,2(8):1610-1622.
[19] Yan Y L, Ping S Z, Peng J P, et al. Global transcriptional analysis of nitrogen fixation and ammonium repression in root-associatedA1501 [J]. Bmc Genomics, 2010,11(1):1-13.
[20] Sathishkumar K, Sathiyaraj S, Parthipan P, et al. Electrochemical decolorization of methyl red by RuO2-IO2-TiO2electrode and biodegradation withMN1 andMN3: An integrated approach [J]. Chemosphere, 2017,183:204-211.
[21] Kleiner D. Bacterial ammonium transport [J]. FEMS Microbiol Lett, 1985,32(2):87-100.
[22] 刘诗彧,王荣昌,马翠香,等.氧化石墨烯与聚苯胺修饰阴极的微生物燃料电池电化学性能 [J]. 中国环境科学, 2019,39(9):3866-3871. Liu S Y, Wang R C, Ma C X, et al. Electrochemical properties of microbial fuel cells with graphene oxide and polyaniline modified cathodes [J]. China Environmental Science, 2019,39(9):3866-3871.
[23] Yu L P, Yuan Y, Christopher R, et al. Combined spectroelectrochemical and proteomic characterizations of bidirectional-electrode electron transfer [J]. Biosensors Bioelectronics, 2018,106:21-28.
[24] Chaney A L, Marbach E P. Modified reagents for determination of urea and ammonia [J]. Clinical Chemistry, 1962,8(2):130-132.
[25] 周玉莲,于永波,黄 湾,等.氧化石墨烯电催化高效降解有机燃料RBk5 [J]. 中国环境科学, 2019,39(11):4653-4659. Zhou Y L, Yu Y B, Huang W, et al. Highly efficient degradation of organic dye RBk5 by graphene oxide electrocatalysis [J]. China Environmental Science, 2019,39(11):4653-4659.
[26] Dong G H, Ho W K, Wang C Y. Selective photocatalytic N, fixation dependent on g-C3N4induced by nitrogen vacancies [J]. Journal of Materials Chemistry A. 2015,3(46):23435-23441.
[27] Ye J, Hu A D, Ren G P, et al. Red mud enhances methanogenesis with the simultaneous improvement of hydrolysis-acidification and electrical conductivity [J]. Bioresource Technology, 2018,247:131- 137.
[28] 牛雨薇,袁林江,刘冰茵,等.两株产电菌电子介体介导的胞外电子传递机理研究 [J]. 中国环境科学, 2020,40(11):4911-4918. Niu Y W, Yuan L J, Liu B Y, et al. Electron mediator mediated extracellular electron transport mechanism in two electricity- producing bacteria [J]. China Environmental Science, 2019,39(11): 4653-4659.
[29] Ren G P, Hu A D, Huang S F, et al. Graphite-assisted electro- fermentation methanogenesis: Spectroelectrochemical and microbial community analyses of cathode biofilms [J]. Bioresource Technology, 2018,269:74-80.
[30] Ye J, Hu A D, Cheng X Y, et al. Response of enhanced sludge methanogenesis by red mud to temperature: Spectroscopic and electrochemical elucidation of endogenous redox mediators [J]. Water Research, 2018,143:240-249.
[31] Ye J, Yu J, Zhang Y Y, et al. Light-driven carbon dioxide reduction to methane by-CdS biohybrid [J]. Applied Catalysis B: Environmental, 2019,257:117916.
[32] Zhan Y H, Deng Z P, Yan Y L, et al. NfiR, a new regulatory noncoding RNA (ncRNA), is required in concert with the NfiS ncRNA for optimal expression of nitrogenase genes inA1501 [J]. Applied and Environmental Microbiology, 2019,85(14): e00762-19.
[33] Ding R I, Cao S H, Chen H, et al. Preparation of tellurium doped graphitic carbon nitride and its visible-light photocatalytic performance on nitrogen fixation [J]. Colloids and Surfaces A, 2019, 563(20):263-270.
[34] Hori T, Müller A, lgarashi Y, et al. Identification of iron-reducing microorganisms in anoxic rice paddy soil by13C-acetate probing [J]. The ISME Journal, 2010,4(2):267-278.
[35] Brownson D A C, Kampouris D K, Banks C B. Graphene electrochemistry: fundamental concepts through to prominent applications [J]. Chemical Society Reviews, 2012,41(21):6944-6976.
[36] Zhang L, Ji X Q, Ren X, et al. Efficient electrochemical N2reduction to NH3on MoN nanosheets array under ambient conditions [J]. ACS Sustainable Chemical Engineering, 2018,6(8):9550-9554.
[37] Wang B, Xiao K M, Jiang Z F, et al. Biohybrid photoheterotrophic metabolism for significant enhancement of biological nitrogen fixation in pure microbial cultures [J]. EnergyEnvironmental Science, 2019, 12(7):2185-2191.
[38] Boyd E S, Peters J W. New insights into the evolutionary history of biological nitrogen fixation [J]. Frontiers in Microbiology, 2013,4: 201-210.
[39] Mantri Y, Williams K P. Islander: a database of integrative islands in prokaryotic genomes, the associated integrases and their DNA site specificities [J]. Nucleic Acids Research, 2004,32:D55-D58.
[40] Liu X M, Zhang X G, Fu S Y. Preparation of urchinlike NiO nanostructures and their electrochemical capacitive behaviors [J]. Materials Research Bulletin, 2006,41(3):620-627.
[41] Fricke K, Harnisch F, Schróder U. On the use of cyclic voltammetry for the study of anodic electron transfer in microbial fuel cells [J]. Energy &Environmental Science, 2008,1(1):144-147.
[42] Yang G Q, Huang L Y, You L X, et al. Electrochemical and spectroscopic insights into the mechanisms of bidirectional microbe- electrode electron transfer inbiofilms [J]. Electrochemistry Communications, 2017,77:93-97.
[43] 汤 佳,文 萍,刘敏如,等.电化学红外光谱解析五氯酚的阴极微生物还原脱氯机制 [J]. 中国科学:技术科学, 2019,49(12):1483-1494. Tang J, Wen P, Liu M R, et al. Electrochemical infrared spectroscopy analysis of the cathodic microorganisms of pentachlorophenol [J]. Science China Technological Science, 2019,49(12):1483-1494.
[44] Ataka K, Heberle J. Electrochemically induced surface-enhanced infrared difference absorption (SEIDA) spectroscopy of a protein monolayer [J]. Journal of the American Chemical Society, 2003, 125(17):4986-4987.
[45] Chen W, Habibul N, Liu X Y, et al. FTIR and synchronous fluorescence heterospectral two-dimensional correlation analyses on the binding characteristics of copper onto dissolved organic matter [J]. Environmental ScienceTechnology, 2015,49(4):2052-2058.
[46] Ataka K, Heberle J. Functional vibrational spectroscopy of a cytochrome c monolayer: SEIDAS probes the interaction with different surface-modified electrodes [J]. Journal of the American Chemical Society, 2004,126(30):9445-9457.
[47] Sun D, Cheng S A, Wang A J. Temporal-spatial changes in viabilities and electrochemical properties of anode biofilms [J]. Environmental ScienceTechnology, 2015,49(8):5227-5235.
[48] Blanchet E, Pécastaines S, Erable B, et al. Protons accumulation during anodic phase turned to advantage for oxygen reduction during cathodic phase in reversible bioelectrodes [J]. Bioresource Technology, 2014,173:224-230.
[49] Eerten-Jansen M C, Veldhoen A B, Plugge C M, et al. Microbial community analysis of a methane-producing biocathode in a bioelectrochemical system [J]. Archaea, 2013:481784.
[50] Polcari D, Philippe D, Mauzeroll J. Scanning electrochemical microscopy: a comprehensive review of experimental parameters from 1989 to 2015 [J]. Chemical Reviews, 2016,116(22):13234-13278.
[51] Koley D, Ramsey M M, Bard A J. Discovery of a biofilm electrocline using real-time 3D metabolite analysis [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011,108(50):19996-20001.
Boron carbide promotes the ammonia production by electrocatalytic nitrogen fixation withA1501.
DONG Guo-wen1,2, CHEN Piao1, REN Guo-ping1, WANG Chao1, JIN Shu-guang3, YE Jie1*, ZHOU Shun-gui1
(1.Fujian Provincial Key Laboratory of Soil Environmental Health and Regulation, College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, China;2.College of Resources and Chemical Engineering, Sanming University, Sanming 365004, China;3.Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China)., 2021,41(5):2449~2458
() A1501was used as a model nitrogen-fixing strain and boron carbide (B4C) was selected as a typical electron transfer carrier to construct an electrocatalytic nitrogen reduction system. The effect of B4C addition on the ammonia production under different conditions was explored. The results showed that B4C significantly enhanced the ammonia production of the electrocatalytic nitrogen reduction system mediated byA1501. With the dosage of 0.4g/L, the addition of B4C (B4C900) prepared at 900 ℃ calcination temperature improved the ammonia yield by 117%. This was because the abundant activation sites on the surface of B4C900promote N2adsorption and activation. In addition, the electrochemical and spectroscopic spectrograms showed that the addition of B4C900not only triggeredA1501 to secrete more redox active substances, but also drove the construction of highly active cathode biofilms, thereby enhancing the long-distance transfer and utilization of electrode electrons.
A1501;B4C;electrocatalysis;biological nitrogen fixation
X172
A
1000-6923(2021)05-2449-10
董国文(1981-),男,安徽宿松人,副教授,博士,主要从事污染环境生物修复.发表论文30余篇.
2020-10-20
国家自然科学基金资助项目(41977281)
* 责任作者, 副教授, jieye@fafu.edu.cn
