磷化氢生物净化体系及抑制作用机理
2021-05-28刘树根
余 硕,刘树根,李 婷
磷化氢生物净化体系及抑制作用机理
余 硕,刘树根*,李 婷
(昆明理工大学环境科学与工程学院,云南 昆明 650500)
在PH3生物净化体系中添加呼吸链电子传递抑制剂,对比分析微生物生长代谢、磷的迁移转化、活性氧(ROS)产生及氧化酶活性等变化规律.当鱼藤酮或抗霉素A分别添加至R1、R2PH3生物反应器后,其微生物体O2-▪含量在运行时间14~17d期间的平均值分别上升至0.68, 0.96mmol/g,明显高于空白对照组R0反应器.除自由基O2-▪外,另一类型的活性氧HO▪也存在于PH3净化系统中;受累积的活性氧影响,生物体内丙二醛(MDA)含量处于较高水平,PH3净化效率通常不超过75%,添加抑制剂的R1与R2反应体系在15~17d期间PH3平均去除率分别下降至65.1%、59.5%. pH值、ROS含量以及氧化酶活性等因素均明显影响PH3生物净化效果,当Fe3+、Cu2+、Mg2+等金属阳离子迁移转运至微生物体内时,超氧化物歧化酶(SOD)与过氧化氢酶(CATase)活性得以不同程度的增强,可缓解活性物质O2-▪或HO▪导致的氧化胁迫作用,PH3净化效能得以适度提升.
PH3;生物转化;抑制;活性氧
PH3是自然界磷循环的重要物质形态和气相载体,黄磷生产、电石制备、垃圾填埋、湿地沼泽等场所均可检测到PH3存在[1-2].目前,工业生产过程高浓度PH3烟气特征及净化处理研究颇为深入,但污水处理厂、垃圾填埋场等处低浓度PH3的产生机制、尾气净化等问题并未得到充分关注.
相比于催化转化、化学吸收、碳基材料吸附等技术,低浓度PH3尾气的生物处理具有运行成本较低、适应性强等优点,具有良好的应用前景.邓菁等[3]较早报道以PH3作为驯化气体筛选功能微生物,并探究了金属离子浓度、营养液等因素对菌种活性的影响.在稳定运行的活性污泥处理体系中[4],碳源、pH值等工艺条件明显影响PH3净化效率.相比而言,采用生物滴滤系统[5-6]净化PH3尾气时,因复合填料能促进气态PH3的吸附,净化效果可达到80%;生物滴滤塔内具有较高的微生物种群多样性,主要的细菌种属有:鞘氨醇单胞菌()、嗜甲基菌()及伯克氏菌().
已有研究同时表明,PH3对海洋微藻具有双重作用:低浓度PH3诱导抗氧化酶活性的升高,对细胞增长具有一定的刺激作用;高浓度的PH3会损伤细胞膜系统,对微藻的酶活性和基因表达等产生抑制作用[7]. PH3具有较强的生物毒性,它能抑制桔小实蝇、谷蠹、玉米象等体内的过氧化氢酶活性[8],并对该类昆虫具有熏蒸杀灭效果;但水稻生长过程中,根际土壤中的碱性磷酸酶随PH3浓度和暴露时间的增加而增加,反映了一定浓度的PH3对土壤磷表现出活化效应[9].
采用生物技术净化PH3尾气时,系统的启动与运行特征、微生物群落多样性等已有研究报道[4-5],但PH3是否对生物净化体系产生明显抑制作用、如何缓解PH3生物毒性并提升生物净化效果,这类深层次问题尚不明晰.本研究在PH3生物体系中添加特定的呼吸链电子传递抑制剂鱼藤酮或抗霉素A以抑制电子传递过程的不同位点,对比分析PH3生物代谢过程中磷的迁移转化过程、氧化酶活性以及活性氧变化规律,探究PH3生物净化体系的抑制作用机理.研究成果为PH3生物转化过程分析及效能提升提供参考.
1 材料与方法
1.1 微生物增殖培养
从连续运行6个月的PH3生物净化活性污泥体系[4]中选取微生物样本,利用有效容积为6L的全自动发酵罐对微生物进行增殖培养.培养过程中每隔24h从发酵罐内排出250mL混合液,同时加入等体积液体培养基.培养过程控制发酵罐内混合液pH值为7.0、温度为25℃、溶解氧(DO)3.5mg/L、搅拌桨转速120r/min.当混合培养液OD600值基本稳定时,将其移入反应器中开展后续对比试验.
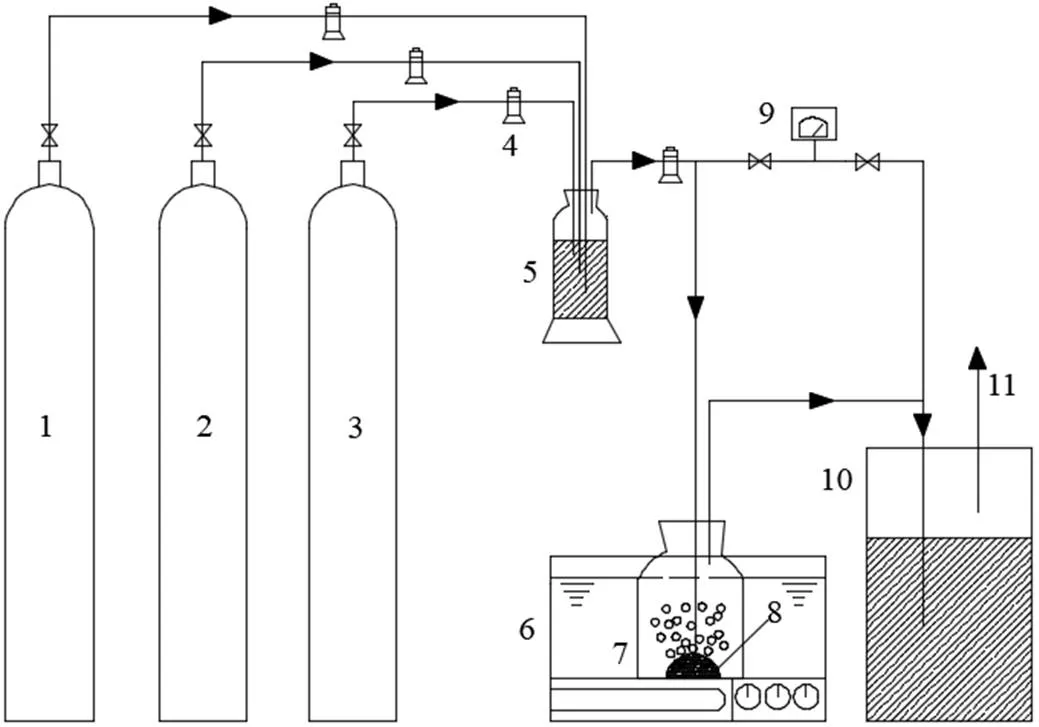
图1 PH3生物净化工艺流程
1-PH3, 2-压缩空气, 3-N2, 4-质量流量计, 5-缓冲瓶, 6-水浴摇床, 7-吸收装置, 8-多孔曝气盘, 9-气相色谱, 10-尾气吸收装置 11-出口尾气
液体培养基主要组分如下:C6H12O61.4g, (NH4)2SO40.165g,K2HPO4·3H2O 0.05g,MgSO40.10g, NaCl 0.15g,KCl 0.15g,FeCl30.015g,MnSO4·H2O 0.015g,CuSO4·5H2O 0.015g,CoCl2·6H2O 0.015g,配制成1L溶液,调节pH值至7.0,灭菌后备用.
1.2 PH3生物净化
采用活性污泥体系对模拟的PH3混合气进行净化处理,工艺流程如图1所示. 分别取2.0L增殖培养的微生物混合液至总容积3.0L的反应器R0、R1、R2中.生物净化过程中,混合气进气流量为120mL/min,PH3浓度为5mg/m3;定期监测吸收装置进出口气体中PH3浓度,计算其去除率.每24h从反应器内移出250mL混合液,及时加入等体积液体培养基,用0.5mol/L NaOH调节混合液pH值为7.0;随后,R1与R2反应器中各自添加浓度为100μmol/L的抗霉素A与鱼藤酮5mL,R0反应器中不添加外源抑制剂.
收集生物净化装置定期排放的污泥混合液,测试pH值、OD600、酶活性等物化指标,并测定上清液中COD、可溶性总磷酸盐(TP)与正磷酸盐(Ortho-P)含量.
1.3 分析测试方法
采用气相色谱仪(GC-9790plus,浙江福立仪器公司)检测吸收装置进出口气相中PH3浓度.使用紫外可见分光光度计(HACH-DR600,美国哈希公司)于波长600nm处测试微生物增殖培养液以及净化体系吸收混合液的吸光度,间接反应微生物的生长状况.混合液pH值采用pH计(PHS-3C,上海雷磁仪电公司)测定.所有物化指标均进行3次平行测试.
收集定期排出的活性污泥混合液,于12000条件下高速离心10min.所得上清液采用标准方法[10]测试其COD、TP等物化指标;采用电感耦合等离子体(PQ-9000,德国耶拿公司)测定金属离子(Fe3+、Cu2+、Mn4+、Mg2+)浓度.所得底物添加磷酸盐缓冲溶液并在冰浴条件下超声破碎处理5min,之后用于酶活性指标测试,超氧化物歧化酶(SOD)活性根据黄嘌呤氧化酶--羟胺法测定,过氧化氢酶(CAT)活性根据标准GB/T 23195-2008[11]测定,氧负自由基(O2-▪)采用改良羟胺氧化法分析[12],羟基自由基(HO▪)利用电子顺磁共振仪(EPR A300-6/1,德国布鲁克公司)检测[13],脂质过氧化物采用丙二醛(MDA)试剂盒(A003-1,南京建成生物公司)基于硫代巴比妥酸法进行测定[14].
取部分活性污泥混合液进行超声破碎(Scientz- 750F,宁波新芝生物科技公司)处理5min后,采用过硫酸钾消解-钼锑抗分光光度法测定其中的混合液总磷(STP)含量.
2 结果与分析
2.1 PH3去除效果
按照对比试验方案的设计,生物净化装置连续运行时,反应器内的污泥停留时间(SRT)为8d,取运行时间第7d后的测试结果比较分析. PH3去除率在运行前期波动较为明显,运行时间达15d后,生物吸收体系的PH3净化效果开始趋于稳定(图2);15~17d期间,R0、R1与R2三个生物反应器内的PH3平均去除率分别为71.4%、65.1%、59.5%.
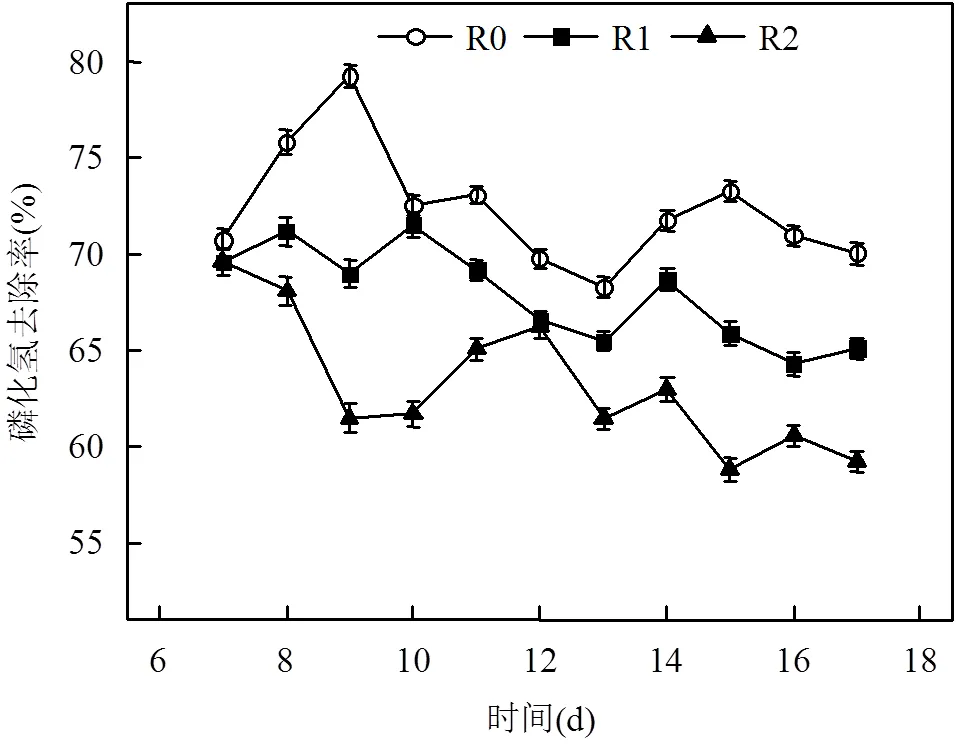
图2 净化体系中PH3去除效率
抗霉素A抑制电子从细胞色素b到细胞色素c1的传递过程[15-16],而鱼藤酮则能阻断电子从NADH向CoQ的传递[17-18].添加抗霉素A或鱼藤酮至生物反应器内吸收混合液中,R1与R2生物体系的PH3净化效果已经受到不同程度的抑制,而这种抑制作用与净化体系微生物代谢、酶活性变化的内在关联,将在本文后续章节加以分析.
2.2 微生物生长与代谢
生物净化试验开始启动时,各反应器内混合液悬浮固体物浓度(MLSS)为1820mg/L,OD600值为1.08,pH值为7.0.随着生物净化过程的推进,R0、R1和R2生物反应器OD600均有所降低;运行时间15~17d期间,3个反应器内OD600处于0.85~0.90这一较为稳定的水平;相比而言,没有添加外源抑制剂的R0反应器OD600略高于R1与R2生物净化体系(图3a).以上结果表明:PH3生物净化体系中,其生物量通常不会太高;当呼吸链电子传递抑制剂添加至吸收混合液后,净化系统OD600呈现更低的水平,PH3去除率也明显偏低(图2).
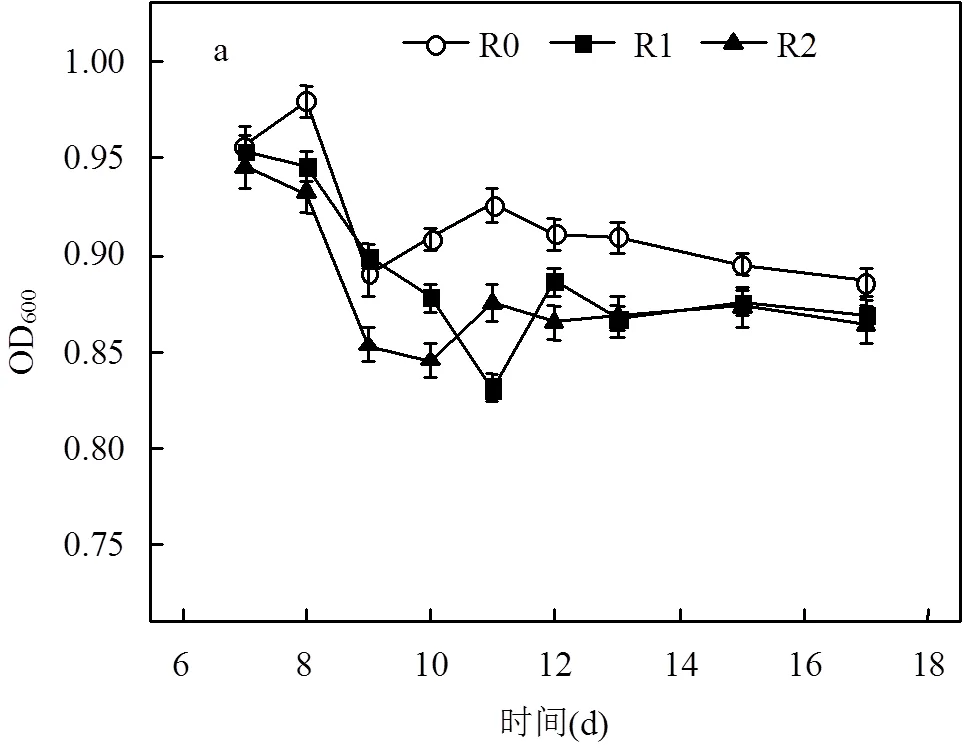
空白方框代表pH值的基准值为7
实验过程中,混合吸收液每隔24h调整pH值至7.0以维持适宜的微生物生长环境.吸收体系在运行过程中pH值均会有所下降;运行时间12~17d期间,R0、R1、R2这3个生物反应器OD600并没有明显降低,但每天排放的废弃液pH值均维持在酸性条件,其平均值分别为4.7, 5.3, 5.4,反映出生化体系酸碱度与碳源代谢及利用密切相关.相比R1与R2两个生物净化体系,R0反应器内pH值通常处于较低水平,这一结果与其PH3去除效果相对较高正好吻合,其内在原因为:不添加抑制剂的净化体系微生物活性相对较好,碳源代谢也更为明显.
2.3 磷形态及浓度变化
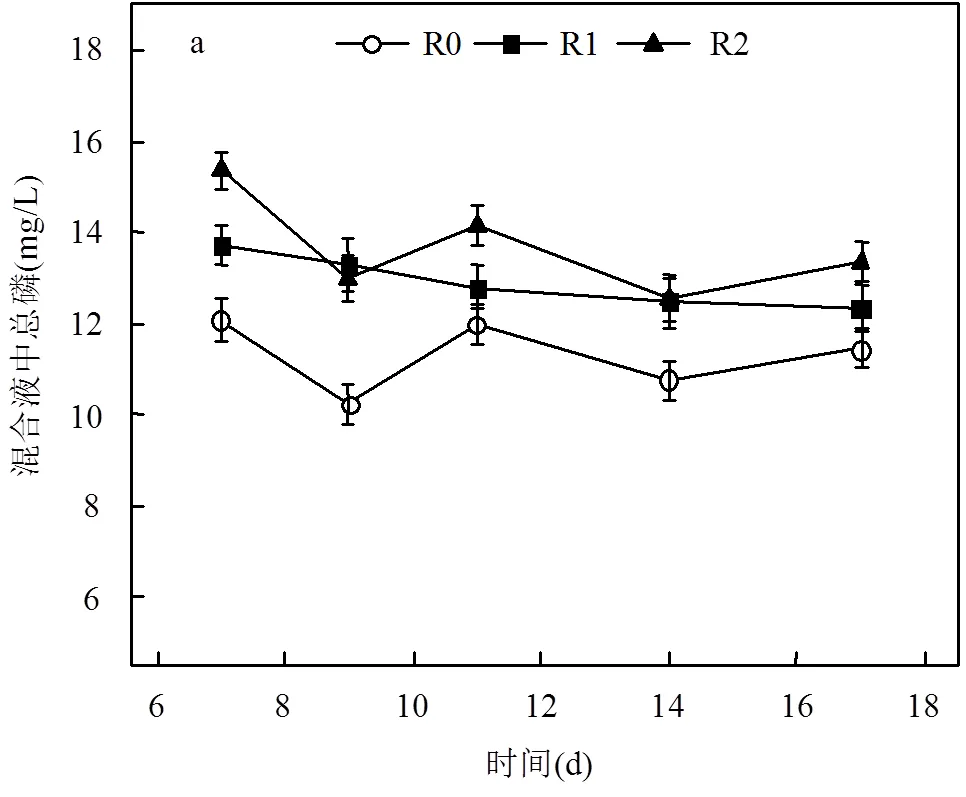
本研究考察了3个生物反应器中STP以及上清液中TP、Ortho-P含量变化,以分析PH3生物净化体系磷的迁移转化规律.各反应器运行一段时间后,吸收体系中STP、上清液中TP与Ortho-P逐步趋于稳定. 14~17d期间,R0、R1、R2三个反应器中STP平均值分别为11.1, 12.4, 12.9mg/L;与此相对应,3个反应器内TP分别为0.65, 0.72, 0.77mg/L,其Ortho-P为0.29, 0.04, 0.17mg/L.
生物净化体系磷的净增加量(net)可描述为:
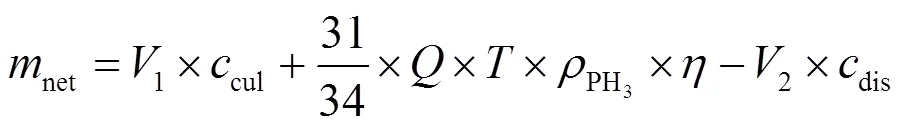
式中:1和2分别为每天加入的液体培养基体积、废弃吸收液体积,均为250mL;cul为液体培养基中TP浓度,根据本文1.1节液体培养基主要组分可知,cul为6.8mg/L;为入口混合气流量,200mL/min;为每次废弃吸收液并加入等体积培养基后的持续吸收时间,可视为24h;PH3(mg/m3)为入口混合气中PH3浓度;为PH3净化效率;dis为每天废弃的吸收混合液中总磷浓度.
尽管没有添加抑制剂的R0反应器PH3去除率相对稍高,理论上从气相转入吸收体系的磷含量会稍有上升,但该体系OD600值相对稍高(图3),每天从反应器混合液中排出的磷含量因而高于另外2个净化体系,从而导致R0反应器内STP反而最低(图4a). 连续运行14d后,各反应体系上清液中TP浓度通常低于0.9mg/L,这就反映出上清液中磷最终可被微生物同化利用而转入生物体内;相比而言,生物吸收体系中正磷酸盐浓度维持在较低水平,一般不超过0.35mg/L,这与PH3生物净化体系中能检测到次磷酸盐、亚磷酸盐的前期研究发现[19]正好吻合.
2.4 氧化胁迫与酶活性
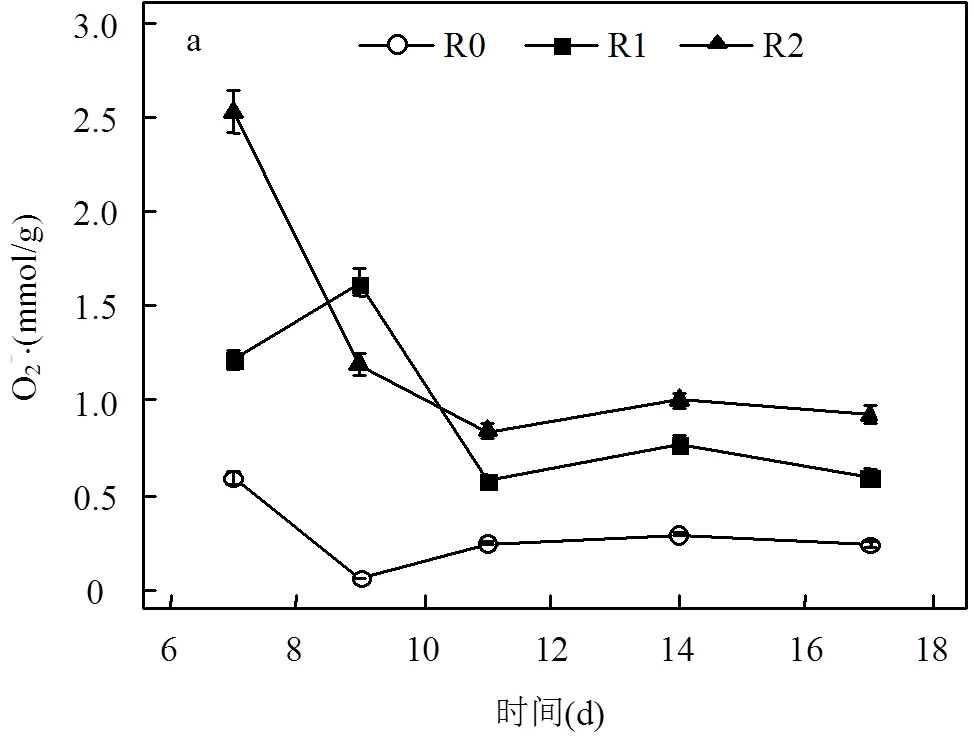
2.4.1 自由基及氧化胁迫 R0、R1和R2生物反应器内微生物体O2-▪含量在运行时间11d前波动较为明显,14~17d期间保持较为稳定水平,其平均值分别为0.26, 0.68, 0.96mmol/g. 在添加电子传递抑制剂抗霉素A与鱼藤酮后,R1与R2生物净化体系O2-▪含量明显更高(图5a),其氧化胁迫作用将更为明显. 与此相对应,这两个生物体系中MDA含量相对稍高,且R2反应器内MDA含量在3个反应体系中处于最高水平(图5b),与该反应体系呈现高活性氧(ROS)、低PH3去除率(图2)正好相一致.
采用EPR仪测试运行15d条件下各生物净化体系中自由基生成情况.从图6可以看出,3个PH3净化体系中均可检测到活性氧HO▪以及O2-▪或其他环境持久性自由基[20]存在,且添加抑制剂的R1和R2生物反应器中ROS强度明显高于对照组R0. PH3本身具有一定的生物毒性,其生物净化体系添加抗霉素A或鱼藤酮后,有机底物代谢过程的电子传递受到更进一步的抑制,ROS累积现象更为明显. ROS可以攻击细胞膜上的多不饱和脂肪酸并导致脂质结构过度氧化[21],其典型产物MDA含量相对更高,这也将明显抑制PH3的生物净化效果.
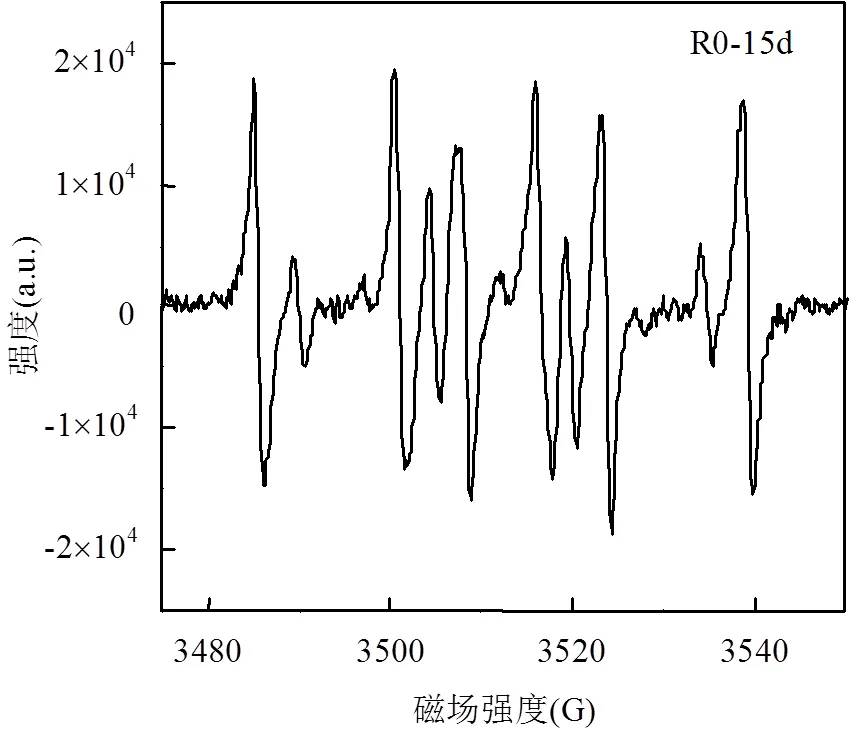
1-HO▪特征峰;2-EPFRs特征峰(包括O2-▪)
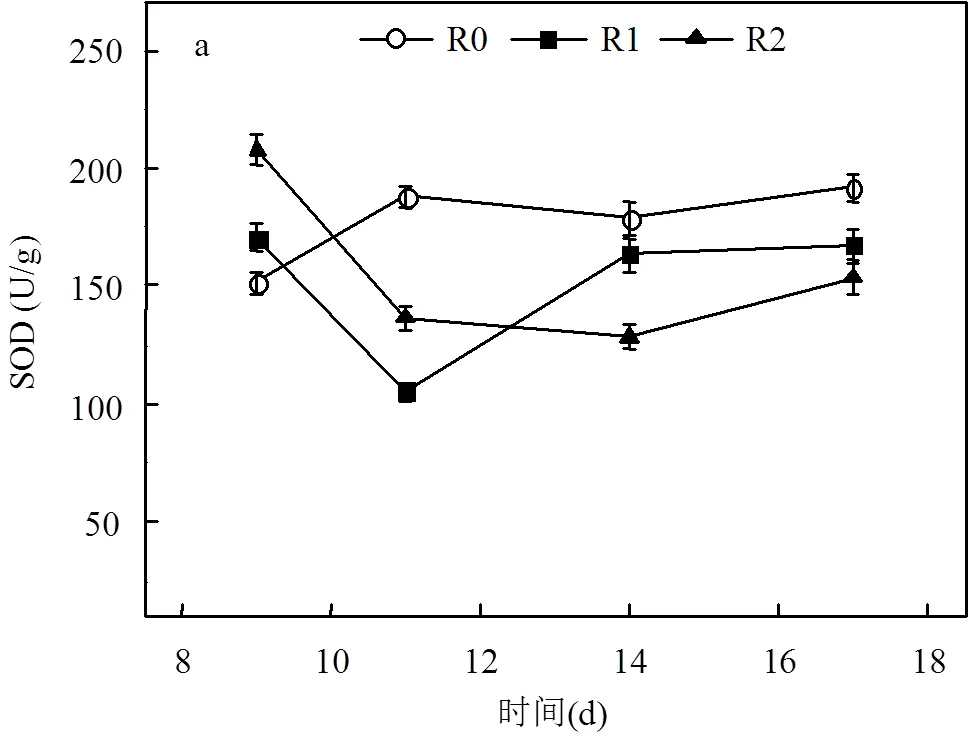
2.4.2 氧化酶活性 从不同生物反应器中氧化酶活性(图7)可以看出,净化体系运行较为稳定时,添加抗霉素A或鱼藤酮抑制剂的R1与R2反应器SOD酶活性略低于R0对照组,但其CATase活性却相对较高. 14~17d期间,R0、R1与R2生物反应器内SOD酶活性平均值分别为185.4, 165.6, 141.1U/ g,其相应的CATase活性平均值分别为25.1, 37.7, 48.0U/g. R0反应器中微生物体内O2-▪累积本身并不十分明显(图5a),但SOD酶活性相对稍高,活性氧对生物体的氧化胁迫作用得以减弱,这也反映出生物净化体系在受到PH3生物毒性[22]后具有一定的自我调控功能.
生物体内O2-▪在SOD酶作用下可分解为H2O2;而H2O2也会引发生成自由基HO▪,对胞内物质同样具有较强的氧化作用,只有在CATase活性也得以增强的条件下,H2O2最终分解为O2与H2O,这种氧化胁迫作用才会得以缓解.添加抑制剂的R1与R2反应体系O2-▪含量相对较高,但SOD酶活性却并没有相应显著增加,很明显,由O2-▪导致的生物体胞内物质过度氧化会更为明显.图6b也表明,R1与R2这2个体系中CATase活性相比空白对照组均有所提升,有利于促进O2-▪代谢产物H2O2的进一步分解,从而减轻自由基HO▪对微生物体的不利影响.以上研究结果表明:微生物体内活性氧的类型及其浓度均会直接影响PH3生物净化效果.
3 净化过程的抑制因子及作用途径
生化反应取决于各种酶的活性,而金属阳离子对其具有重要作用,运行时间第15d时3个生物反应器上清液中金属离子浓度比较如表1所示. 相比每天置换而添加的液体培养基,PH3生物净化体系上清液中Fe3+、Cu2+、Mn4+、Mg2+这4种离子的浓度均有所降低,尤其以Fe3+、Mg2+两类离子下降程度更为显著;相反,生物净化体系中K+离子浓度略微升高,而Na+离子浓度明显高于液体培养基. 添加抗霉素A或鱼藤酮后,R1与R2生物反应器中上清液Fe3+浓度高于空白对照组,但Cu2+、Mn4+离子浓度反而相对较低.以上研究结果表明:不同类型的金属离子与PH3生物净化效果密切关联.
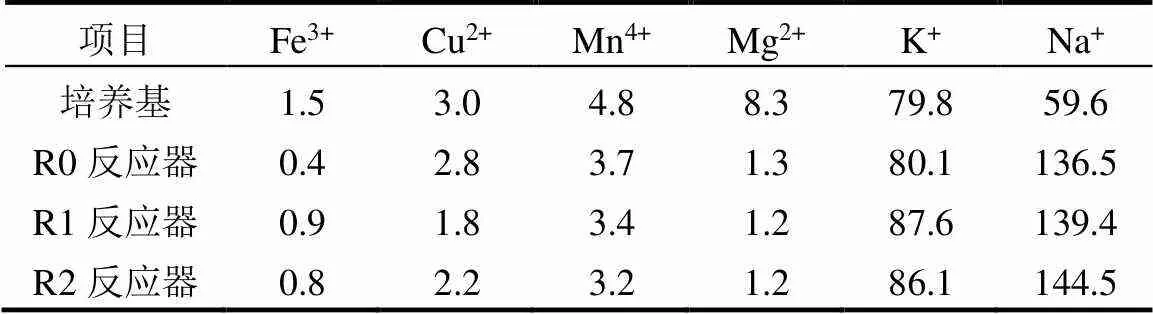
表1 生物净化体系上清液中金属离子浓度(mg/L)
基于生物化学基本原理与本研究试验结果,PH3生物净化体系潜在的抑制因子及作用途径如图8所示.对于PH3生物净化体系,C6H12O6为微生物生长提供碳源物质,有机底物经TCA循环最终转化为CO2与H2O,该过程同时伴随着质子、电子的传递与产能代谢.当代谢过程电子传递受到明显抑制时,生物体系对碳源-葡萄糖的分解代谢作用也有所下降,酸累积的现象得以适当缓解,R1与R2两个吸收体系在置换吸收液1/8并随后运行24h时,其pH均稍高于对照组R0反应器(图3b).由于底物代谢,各反应器微生物混合液pH值降至4.6~6.0,此时细胞外H+通过质子泵机制进入微生物体内,从而导致胞内钾离子(K+)或钠离子(Na+)迁移至溶液中,生物体系吸收液中K+、Na+含量明显高于液体培养基(表1).有毒气体PH3对微生物存在胁迫作用,引起胞内ROS增加[4];另外,鱼藤酮与抗霉素A均会抑制呼吸链氢和电子的传递,使氧化作用受阻,ATP无法合成;鱼藤酮抑制NADH向CoQ的转化过程(I过程),抗霉素A则抑制细胞色素b到细胞色素c1代谢进程(II过程)[15-16].生物氧化过程中电子传递受阻时,累积的活性氧ROS更为明显(图5和6),会对微生物细胞膜多不饱和脂肪酸(PUFA)造成过度氧化,生物体内MDA含量相应有所上升.为抵抗活性氧的潜在不利影响,更多的Fe、Cu、Mg等金属阳离子将迁移转运至微生物体内(表1),氧化酶活性得以不同程度的增强(图7),从而缓解由活性物质O2-▪或HO▪导致的氧化胁迫作用.
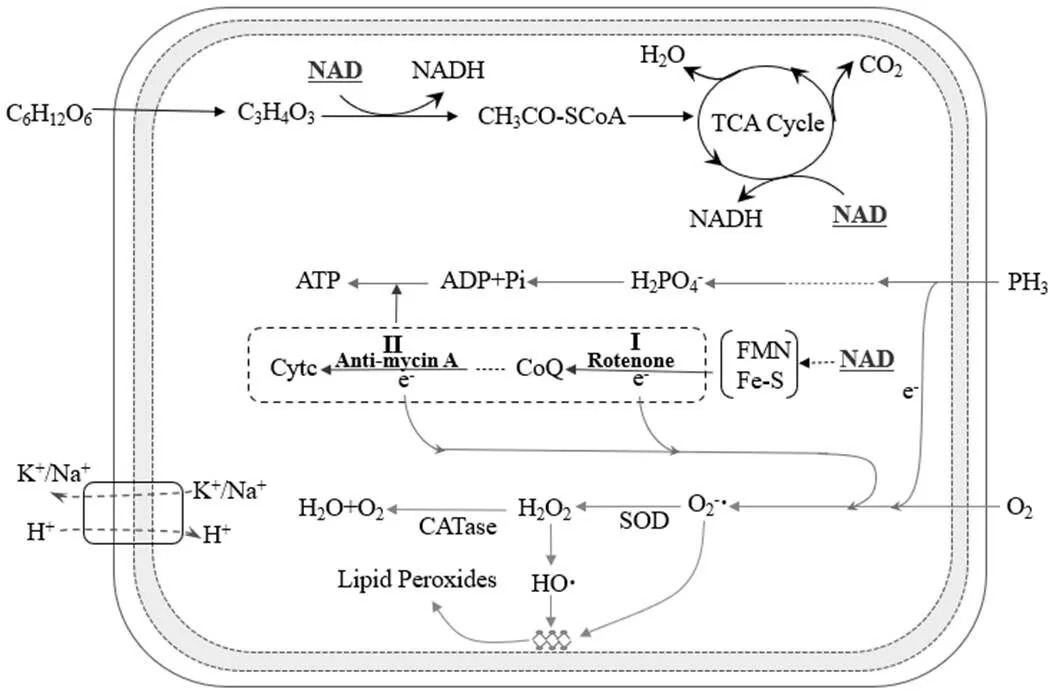
图8 PH3生物净化过程的抑制因子及作用途径
4 结论
4.1 PH3生物净化体系中添加抗霉素A或鱼藤酮后,生化代谢进程受到抑制,生物体内活性氧累积更为明显,MDA含量相对较高,PH3去除效率相应下降.
4.2 采用生物技术净化处理低浓度PH3尾气时,可考虑在净化过程中添加活性氧清除剂以降低ROS氧化胁迫作用,从而提升PH3生物净化效能.
4.3 PH3生物净化过程中,上清液正磷酸盐浓度维持在较低水平,PH3经生物转化后更多存储于微生物体内;碳源代谢导致体系pH值下降,引发生物体胞内Na+、K+流失并对净化过程产生不利影响.吸收液pH值环境、生物体内活性氧累积及氧化酶活性等因素均明显影响PH3生物净化效果.
[1] Fan Y, Lv M, Niu X J, et al. The key step of gaseous phosphorus release in anaerobic digestion [J]. Process Safety and Environmental Protection, 2020,137:238-245.
[2] 王 强,耿金菊,金红梅,等.太湖沉积物中微生物和磷化氢的时空分布及关系 [J]. 中国环境科学, 2006,(3):350-354. Wang Q, Geng J J, Jin H M, et al. Temporal and spatial distributions of microbes and phosphine in Lake Taihu sediments [J]. China Environmental Science, 2006,(3):350-354.
[3] 邓 菁.微生物法去除一氧化碳气中磷化氢的研究[D]. 昆明:昆明理工大学, 2013. Deng Q. The study biological removal the PH3in the carbon monoxide [D]. Kunming: Kunming University of Science and Technology, 2013.
[4] 肖 瑢,刘树根,杨 希,等.活性污泥体系中磷化氢生物降解特性 [J]. 环境工程学报, 2018,12(3):855-862. Xiao R, Liu S G, Yang X, et al. Biodegradation characteristics of phosphine in activated sludge systerm [J]. Chinese Journal of Environmental Engineering, 2018,12(3):855-862.
[5] 刘树根,苏福家,李 婷,等.生物滴滤法净化低浓度磷化氢及其微生物群落分析 [J]. 环境工程学报, 2018,12(12):124-132. Liu S G, Su F J, Li T, et al. Purification of low concentration phosphine by bio-trickling filter system and analysis of microbial community [J]. Chinese Journal of Environmental Engineering, 2018,12(12):124-132.
[6] 倪建国,吴成强,朱润晔,等.生物滴滤塔反硝化净化NO废气的启动 [J]. 中国环境科学, 2008,28(5):444-448. Ni J G, Wu C Q, Zhu R Y, et al. Study on start-up of biotrickling filter for nitric oxide denitrification [J]. China Environmental Science, 2008,28(5):444-448.
[7] 付 梅.磷化氢对海洋微藻的影响及作用机制研究 [D]. 北京:中国科学院, 2013. Fu M. The effect and mechanism of phosphine on marine algae [D]. Chinese Academy of Science, 2013.
[8] 汪丽军,刘 涛,董书军,等.磷化氢熏蒸对桔小实蝇氧化代谢体系的影响研究 [J]. 中国农学通报, 2013,29(33):351-357. Wang L J, Liu T, Dong S J, et al. The effect of phosphine fumigation on oxidative metabolism of bactrocera dorsalis hendel [J]. Chinese Agricultural Science Bulletin, 2013,29(33):351-357.
[9] 李 丽,牛晓君,陆美青,等.环境中磷化氢对水稻根际环境与土壤有效磷的影响研究 [J]. 环境科学学报, 2015,35(6):1851-1857. Li L, Miu X J, Lu M Q, et al. Effect of phosphine in the environment on rice rhizosphere and available phosphorus in soil [J]. Acta Scientiae Circumstantiae, 2015,35(6):1851-1857.
[10] 国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.SEPA(State Environmental Protection Administration). Methods for monitoring and analysis of water and wastewater (4th Edition) [M]. Beijing: China Environmental Press, 2002.
[11] GB/T 23195-2008 蜂花粉中过氧化氢酶的测定方法紫外分光光度法 [S]. GB/T 23195-2008 Method for the determination of catalase in bee pollen—Ultaraviolet spectrophotometry [S].
[12] Liu S G, Yang X, Yao X F. Impacts of ammonia nitrogen on autothermal thermophilic micro-aerobic digestion for sewage sludge treatment [J]. Chemosphere, 2018,213:268-275.
[13] 刘 曼,李一兵,王彦斌,等.掺铜介孔碳活化过硫酸氢盐高效降解双酚A [J]. 中国环境科学, 2017,37(11):4151-4158.Liu M, Li Y B, Wang Y B, et al. Activation of peroxymonosulfate by copper doped ordered mesoporous carbon for efficient destruction of bisphenol A [J]. China Environmental Science, 2017,37(11):4151-4158.
[14] 张秋萍,吴霞红,郑剑恒,等.生物样本中丙二醛测定方法的研究进展 [J]. 理化检验:化学分册, 2016,52(8):979-985. Zhang Q P, Wu X H, Zheng J H, et al. Progress of researches on methods for determination of malondialdehyde in biological samples [J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2016,52(8):979-985.
[15] 邱小忠,欧阳钧,余 磊,等.抗霉素A抑制PC12细胞线粒体COⅡ基因表 [J]. 神经解剖学杂志, 2004,20(2):167-170. Qiu X Z, Ou Y J, Yu L, et al. Antimycin A inhibit the expressiion of mitochondrial COⅡ Gene in PC12Cells [J]. Chinese Journal of Neuroanatomy, 2004,20(2):167-170.
[16] 陈 莎,张 翔,张舒越,等.抗霉素A直接刺激线粒体所引起的超氧阴离子含量和膜电位变化的单线粒体水平研究 [J]. 厦门大学学报(自然科学版), 2013,52(4):525-530. Chen S, Zhang X, Zhang S Y, et al. Study the effect of antimycin A on superoxide anion production and mitochondrial membrane potential of isolated mitochondria at the single-mitochondrion level [J]. Journal of Xiamen University(Natural Science), 2013,52(4):525-530.
[17] 竺飞燕,张 雄,王百辰,等.鱼藤酮诱导PC12细胞凋亡及线粒体膜电位变化 [J]. 中国药理学通报, 2014,30(2):266-269. Zhu F Y, Zhang X, Wang B C, et al. Rotenone induces apoptosis of PC12 cells and alteration in mitochondrial membrane potential [J]. Chinese Pharmacological Bulletin, 2014,30(2):266-269.
[18] 邓 勇,逯 军.鱼藤酮致线粒体氧化损伤的作用和机制[J]. 中南大学学报(医学版), 2014,39(10):1093-1099. Deng Y, Lu J. Role of rotenone in mitochondrial oxidative damage and the underlying mechanisms [J]. Journal of Central South University (Medical Science), 2014,39(10):1093-1099.
[19] Li T, Liu S G, Yao X F. Addition of reactive oxygen scavenger to enhance PH3biopurification: Process and mechanism [J]. Process Safety and Environmental Protection, 2020,142:118-125.
[20] Khachatryan L, Dellinger B. Environmentally persistent free radicals (EPFRs)-2. Are free hydroxyl radicals generated in aqueous solutions? [J]. Environmental Science & Technology, 2011,45(21):9232-9239.
[21] Ahamd S, Maryam P, Bahareh S Y, et al. Inhibition of glucose-6-phosphate dehydrogenase protects hepatocytes from aluminum phosphide-induced toxicity [J]. Pesticide Biochemistry & Physiology, 2017,143:141-146.
[22] Wang Z, Gao M, Wang Z, et al. Effect of salinity on extracellular polymeric substances of activated sludge from an anoxic-aerobic sequencing batch reactor [J]. Chemosphere, 2013,93(11):2789-2795.
Inhibition mechanism of phosphine biological purification system.
YU Shuo, LIU Shu-gen*, LI Ting
(Faculty of Environmental Science and Engineering, Kunming University of Science and Technology, Kunming 650500, China)., 2021,41(5):2219~2225
Two electron transport inhibitors (rotenone and anti-mycin A) were introduced to phosphine bio-purification systems, then comparative experiments were conducted to investigate the variations of the microbial growth and metabolisms, phosphorus transport and transformation, the production of reactive oxygen species (ROS), and oxidase activities. When rotenone and anti-mycin A were respectively added to R1 and R2 bioreactors, the average O2-▪ content in these two systems increased to 0.68 and 0.96 mmol/g during the operation time of 14~17 days, which was significantly higher than control group (i.e. R0 reactor). Besides O2-▪, another kind of reactive oxygen species, i.e. HO▪, was also detected in bio-purification systems. In addition, due to the ROS accumulation, the malondialdehyde (MDA) content in microorganisms kept at a high level, caused the purification efficiency of phosphine less than 75%. The average phosphine removal efficiency in the R1 and R2 bioreactors decreased to 65.1% and 59.5% respectively, after 15~17 days operation. The factors, e.g., pH, ROS, and oxidase activity, had significant effects on phosphine biological purification. As metal cations such as Mg2+and Cu2+migrated into the microbial cells, the enzyme activities of superoxide dismutase and catalase were dramatically improved, which led to the alleviation of the oxidative stress derived from the reactive species such as O2-▪ and HO▪. As the consequence, the purification efficacy of phosphine was improved moderately.
phosphine;biotransformation;inhibition;reactive oxygen species
X701
A
1000-6923(2021)05-2219-07
余 硕(1995-),男,四川资阳人,昆明理工大学硕士研究生,主要从事废物资源化及环境生物技术方面研究工作.
2020-09-20
国家自然科学基金资助项目(51868029)
*责任作者, 教授, bridgelsg@sina.com
