低温下AHLs对多级A/O工艺中好氧生物膜特性的影响
2021-05-28周荣煊马潇然张林华张亚超
周荣煊,马潇然,李 军*,张林华,张 晶,张亚超,韩 浩
低温下AHLs对多级A/O工艺中好氧生物膜特性的影响
周荣煊1,马潇然1,李 军1*,张林华2,张 晶1,张亚超1,韩 浩1
(1.北京工业大学城建学部,北京 100124;2.北京质宝信息科技有限公司,北京 102600)
针对低温条件下多级A/O工艺出水氨氮容易超标问题,进行外源添加酰基高丝氨酸内酯类信号分子(AHLs)对低温下多级A/O工艺好氧段生物膜特性的影响研究.结果表明:添加100nmol/L的己酰基高丝氨酸内酯(C6-HSL)后生物膜硝化效率提高了22.34%,十二烷酰基高丝氨酸内酯(C12-HSL)则将生物附着量提高了24.47%,且C6-HSL和C12-HSL对生物膜硝化效率和生物附着量的提高作用均具有长期性.这是因为C6-HSL能够将低温下好氧段生物膜硝化活性提高17.56%,而C12-HSL可以将胞外聚合物(EPS)中蛋白质(PN)的含量提高67.37%.此外,C6-HSL和C12-HSL均能促进对应信号分子的内源释放,因此对生物膜硝化活性和附着性能具有长期积极影响.高通量测序分析表明C6-HSL可提高(亚硝化单胞菌)的丰度,故能提高R2中生物膜硝化活性;而外源添加C12-HSL对r(红杆菌属)丰度影响较大,这是实验组R5生物膜EPS中PN含量增加的重要原因.
多级A/O;生物膜;低温;群体感应
水中含氮污染物浓度过高容易导致水体富营养化,与传统活性污泥法相比,多级A/O工艺具有有机负荷均匀,碳源利用充分,氧气利用率高等优点[1].此外,采用生物膜形式可以富集世代周期较长的硝化细菌,并提高多级A/O工艺抗冲击能力,但是在低温条件下应用生物膜形式的多级A/O工艺面临的瓶颈问题之一是低温导致微生物活性降低(尤其是硝化细菌的活性在低温条件下更容易被抑制),进而导致工艺硝化能力不足,严重影响工艺的脱氮效果.此外,低温条件下微生物活性下降容易导致反应器生物量降低,从而影响污染物去除效果,因此探究可以提高低温下多级A/O工艺硝化能力的方法具有重要实际意义.
群体感应(QS)是一种与细胞密度紧密相关的细胞交流方式,QS是指细菌向环境中分泌信号分子,当环境中信号分子浓度到达一定阈值后即可激活下游目标基因,从而调节细菌群体行为模式[2].N-酰基高丝氨酸内酯(AHLs)是由革兰氏阴性菌分泌的一类信号分子,AHLs可以影响胞外聚合物(EPS)的合成、调整菌群结构、促进生物膜形成等[3],从而影响反应器处理效果.有关AHLs对生物膜的影响主要集中在生物膜形成阶段[4].Tan等[5]发现在SBR反应器中外源添加皮摩尔浓度(10-12nmol/L)的AHLs可以促进复杂种群生物膜EPS合成,Hu等[6]研究发现在低温(14℃)条件下向SBBR反应器投加50nmol/L的AHLs混合物可以缩短生物膜反应器启动时间.然而污水厂中污染物的降解主要是靠成熟生物膜来完成的,但是有关群体感应对成熟生物膜的影响方式尚不明确.Wang等[4]通过调查实际污水处理厂成熟生物膜信号分子含量,发现成熟生物膜AHLs浓度与温度呈负相关,与生物膜活性呈正相关. Li等[7]发现AHLs类信号分子可促进微生物附着生长,从而促进生物量增长.多级A/O工艺在低温条件下存在微生物硝化能力不足、生物量下降等问题.因此研究如何通过群体感应提高低温下多级A/O工艺好氧段生物膜硝化活性和生物附着能力对提高低温条件下多级A/O工艺的污染物去除能力有重要意义.
本文研究对象为多级A/O工艺好氧区成熟生物膜.在低温条件下通过外源添加不同种类的AHLs类信号分子,研究AHLs类型对低温条件下成熟生物膜附着能力、硝化活性的影响,并探索其影响机理,以期为提高低温条件下多级A/O工艺的脱氮性能提供理论参考及技术支撑.
1 材料与方法
1.1 多级A/O反应器

图1 多级A/O反应器
1.进水泵;2.生活污水;3.A1室;4.O11室;5.O21室;6.A2室;7.O21室;8.O22室;9.A31室;10.O31室;11.O32室;12.二沉池;13.出水;14.硝化液回流;15.曝气泵
多级A/O生物膜反应器如图1所示.反应器材质为有机玻璃,长×宽×高=90cm×60cm×60cm,有效水深50cm,有效体积270L.反应器分9个隔室,以填充于琉璃球中的鲍尔环作为生物载体,反应器载体填充率100%.反应器好氧区采用曝气盘曝气,通过转子流量计控制曝气量,缺氧区采用潜水泵进行搅拌,缺氧区体积:好氧区体积均为1:2.控制反应器温度为(10±1)℃.
1.2 多级A/O生物膜反应器启动及运行工况
反应器进水为实际生活污水.接种污泥首先进行闷曝活化,再将进水量从20%起逐渐提高至100%,待污染物去除有一定效果后加入载体进行挂膜并控制曝气量,约48d后生物膜基本成熟,反应器启动成功.反应器稳定运行时期进出水主要指标和运行工况如表1,反应器稳定在运行时期硝化能力不足,氨氮去除率不足70%.

表1 多级A/O反应器进出水指标及工况
1.3 实验装置及运行
前期检测发现反应器好氧区生物膜可分泌C4-HSL、C6-HSL、C7-HSL、C10-HSL和C12-HSL类信号分子,故选用这几种信号分子进行实验.
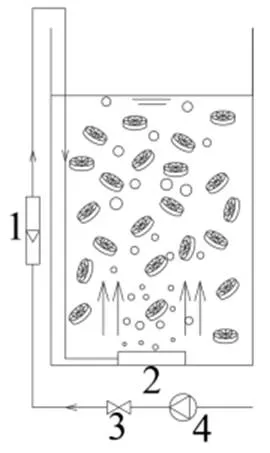
图2 批次实验装置
1.转子流量计;2.曝气盘;3.止回阀;4.曝气泵
批次实验装置如图2,SBR反应器有效体积4L.将稳定运行时期的多级A/O生物膜反应器一级好氧区填料取出,用自来水洗去表面基质残留后放入各SBR反应器,填充率为50%,再注入模拟废水4L,模拟废水成分参考文献[8].实验设置对照组R0,进水不添加AHLs;实验组R1、R2、R3、R4和R5,进水分别添加100nmol/L的C4-HSL、C6-HSL、C7-HSL、C10-HSL和C12-HSL信号分子(sigma公司).
批次实验运行条件如下:水力停留时间(HRT) 12h,换水率100%,通过低温槽控制温度为10℃,每天测量进出水氮素浓度,实验进行20d后停止投加AHLs并维持原工况继续运行10d.
1.4 分析方法
每天收集进出水样品,根据标准方法[9]测定氨氮(NH4+-N)、亚硝酸盐氮(NO2--N)和硝酸盐氮(NO3--N)浓度,生物量测定参考文献[10].所有数据均测量3次取平均值.
1.4.1 EPS提取和分析 采用热提法分离总EPS[11],并做一些修正,具体步骤如下:首先用机械方法从填料上分离生物膜,在离心机(sigma)中4000r/min离心2min后倒掉上清液,加入PBS缓冲溶液至30mL,再放入60℃水浴箱水浴30min,之后将混合液在12000r/min下离心10min,用0.22μm微孔滤膜过滤上清液,滤后溶液即为总EPS.以葡萄糖为标准物,用蒽酮-硫酸法定量测量多糖.用改良Bradford法测定蛋白质.
1.4.2 三维荧光光谱分析(EEM) 采用荧光光谱仪(F-7000,日本日立)对胞外聚合物进行荧光光谱(EEMs)分析.设置激发波长(x)200~420nm,发射波长(m)240~600nm,间隔分别为5和2nm,激发光和发射光的狭缝宽度均为5nm,扫描前用超纯水作为空白样消除背景噪音及拉曼散射.
1.4.3 AHLs提取和检测 在第30d提取各反应器生物膜中的AHLs.首先用机械方法剥离填料上的生物膜,然后4000r/min离心2min后除上清液,再将样品重溶于20mL甲醇,在冰水浴中用20kHz,100W超声处理20min以破碎细胞,再用0.22μm纤维素过滤器过滤,将滤后溶液在40℃氮气条件下干燥,最后重溶于400μL甲醇中.样品在检测前需于-20℃条件下保存,AHLs检测方法参考文献[12].
1.4.4 微生物种群分析 实验20d时收集各反应器的生物膜样品.样品用PBS缓冲溶液洗涤3次后送往上海生工生物工程技术服务有限公司,采用Illumina Miseq测序平台进行高通量测序分析[13].
2 结果与讨论
2.1 AHLs类型对反应器硝化效率的影响

a对照组;b添加C4-HSL;c添加C6-HSL;d添加C7-HSL;e添加C10-SHSL;f添加C12-HSL
仅在实验第1~20d添加AHLs类信号分子,第20~30d则不再添加.结果如图3所示,第20d时R2和R5出水氨氮分别为12.26和11.04mg/L,与对照组R0相比硝化效率分别提升22.34%和28.75%,表明低温条件下C6-HSL和C12-HSL能显著提高生物膜硝化效率.而R1、R3和R4出水氨氮浓度变化不明显,说明低温下C4-HSL、C7-HSL和C10-HSL对生物膜硝化效率影响微弱.实验第20~30d期间未添加AHLs类信号分子,但R2和R5的出水氨氮基本维持在10~15mg/L,说明低温(10℃)下投加C6- HSL和C12-HSL对反应器硝化效率的提高作用具有长期性.
2.2 AHLs类型对生物膜硝化活性和生物附着量的影响
2.2.1 AHLs类型对生物膜硝化活性的影响 如图4,第20d时反应器R2的生物膜硝化速率为54.74mgNH4+-N/(gVSS·d),与对照组R0相比上升17.56%,说明C6-HSL显著提高了生物膜硝化活性. C6-HSL侧链较短,分子量较低而亲水性较高,因此传质性能强,能更有效刺激细胞活性,这是C6-HSL能提高R2硝化效率的重要原因.R4生物膜硝化速率为43.01mgNH4+-N/(gVSS·d),较R0下降7.63%,说明C10-HSL对生物膜硝化活性有轻微抑制作用. R1、R3和R5的生物膜硝化速率则基本稳定.虽然C4-HSL侧链最短、分子量最低,但R1生物膜硝化速率无明显变化,这可能是C4-HSL过低的分子量使得其在环境中更容易被降解,从而难以充分刺激细菌活性.实验前后R5生物膜硝化速率无明显变化,但是C12-HSL可显著提高生物膜生物量(图5),从而提高R5的硝化效率.
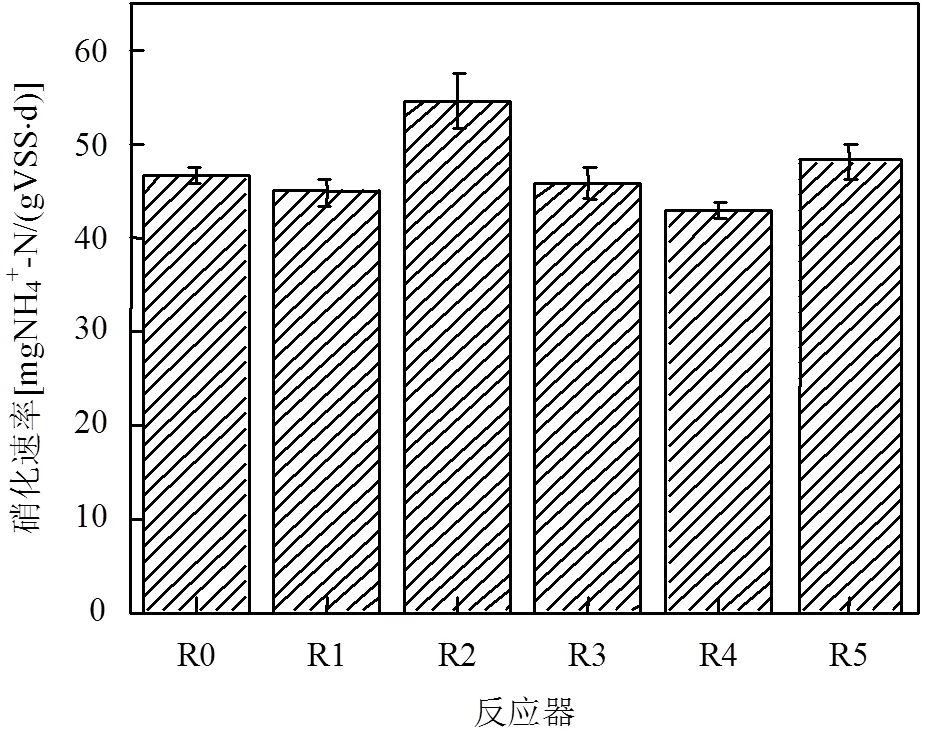
图4 反应器第20d生物膜硝化速率
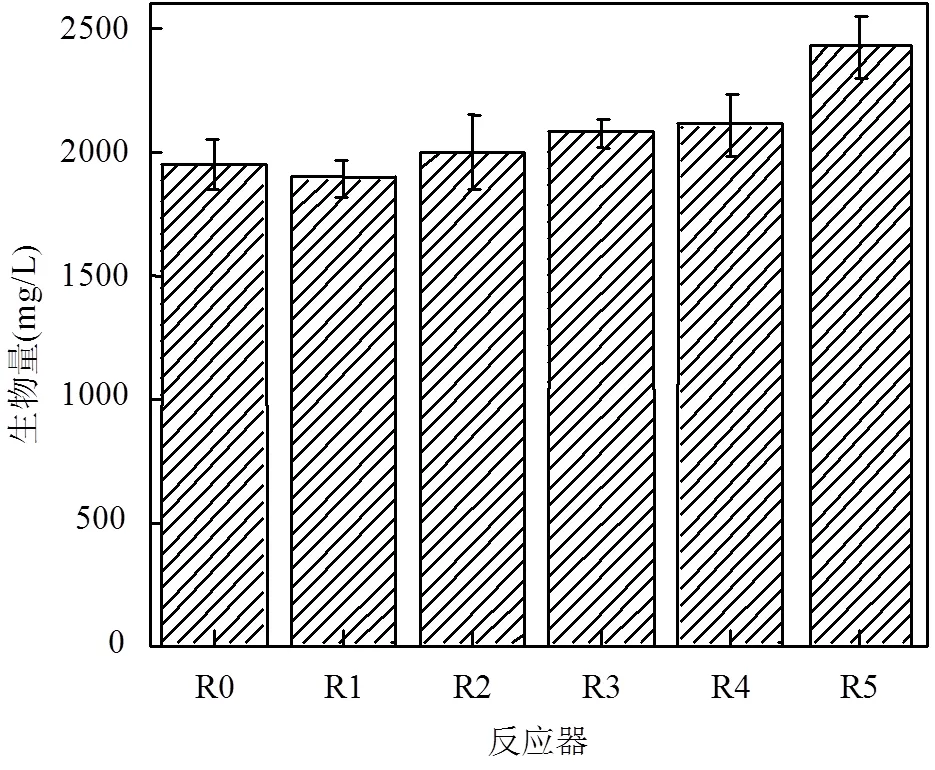
图5 反应器第20d生物量
2.2.2 AHLs类型对生物膜附着量的影响 如图5所示,与对照组R0相比,R5生物量提高了24.47%,表明低温下C12-HSL可显著增加生物膜生物量,这是R5硝化效率提高的重要原因.R3和R4的生物量分别提高了6.40%和7.99%,说明C7-HSL和C10- HSL对生物膜生物量有轻微促进作用.而R1和R2生物量变化较小,C4-HSL和C6-HSL对生物膜生物量的影响较微弱.实验结果发现随着投加AHLs侧链长度的增加,反应器生物量大体呈上升趋势.Li等[7]在硝化污泥中投加不含侧链基团的AHLs时发现,随着侧链长度增加,污泥的粘附性增长越明显.这与本研究结果基本一致.
2.3 AHLs类型对生物膜微生物群落和EPS的影响
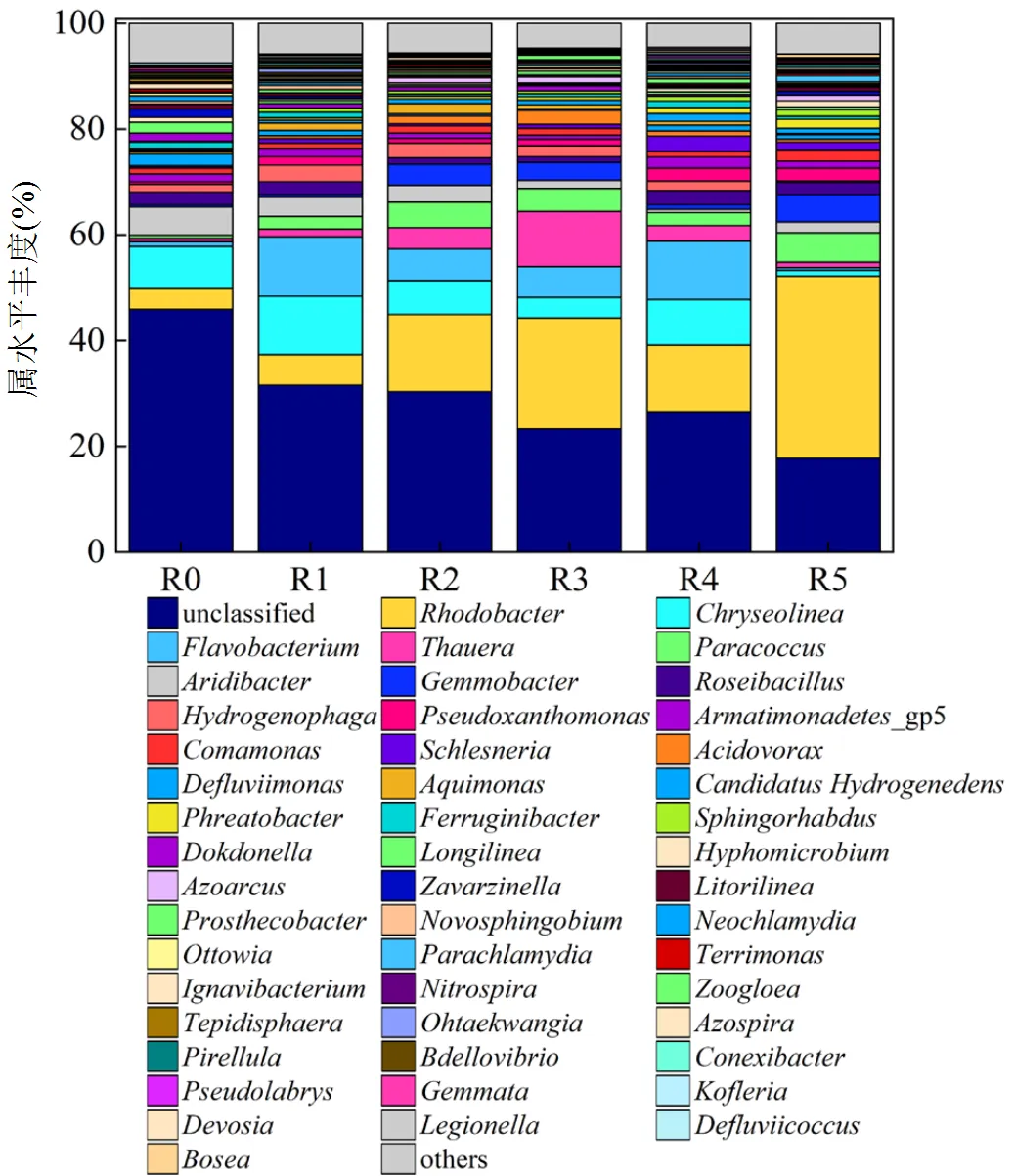
图6 实验第20d时微生物属水平丰度
2.3.1 AHLs类型对生物膜微生物群落的影响 实验第20d时对各反应器生物膜进行高通量测序分析,如图6所示,低温下添加AHLs会显著影响成熟生物膜的菌群结构:R2中属于氨氧化细菌(AOB)的含量从0.10%上升至0.25%,说明低温下C6-HSL对AOB的富集效果最明显,这是R2硝化活性提高的主要原因.R5中的含量上升至0.22%,说明C12-HSL对AOB的富集也有一定促进作用,而R1、R3和R4中含量变化较小,C4-HSL、C7-HSL和C10-HSL对AOB富集作用较微弱.这与反应器的硝化实验结果基本一致(图3).上述结果表明C6-HSL和C12-HSL可不同程度上促进生物膜AOB的富集,从而提升硝化能力,而C4-HSL、C7-HSL和C10-HSL对生物膜AOB含量影响较轻微,因此,这3类AHLs信号难以提高生物膜硝化能力.而作为市政污水中常见的亚硝酸盐氧化细菌(NOB)[22],其在R1~R5中的含量与在R0中含量(0.24%)相比变化较小,说明上述各类信号分子对NOB的调控作用较微弱.
信号分子对反应器主要菌种含量也有显著影响.如表2所示,R1~R5生物膜中的、、含量较R0均有明显上升. R5中含量上升至34.47%,变化最为显著,这与反应器生物量变化趋势一致.原因可能为能够分泌EPS来辅助细菌附着生长,其含量上升有助于提高膜生物量[23].R1~R4属于异养硝化菌的[24]含量分别上升至11.23%、5.97%、5.79%和11.01%,的富集有助于提高反应器硝化效果,但R5的含量仅为0.46%,说明C12-HSL对富集作用不明显,其硝化效果的提升可能与其它硝化细菌有关,这与冯惠[25]的发现一致.所有类型信号分子均增加了含量,但该菌种并非群体感应或群体猝灭细菌.一些研究认为为一类特殊细菌,这类细菌虽然并没有AHLs编码基因但有lux-R编码基因,所以能够感应AHLs类信号分子而参与到群体感应中,所以会对AHLs含量变化产生反应[25-26].
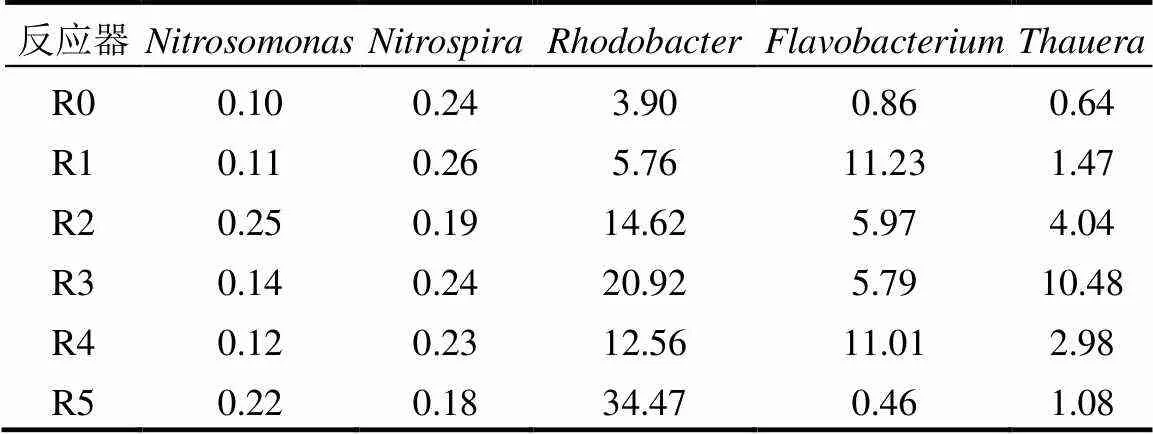
表2 反应器第20d生物膜部分细菌含量(%)
2.3.2 AHLs类型对生物膜EPS的影响 EPS是生物膜重要特性之一,生物膜中的细菌通过分泌EPS来固定自身,EPS的含量及成分比对生物膜的物理特性和传质能力都有影响[8].第20d时测定各反应器生物膜EPS含量,结果如图7所示,与R0相比,R5生物膜EPS含量增加了56.97%,说明低温下C12-HSL可显著促进生物膜EPS含量.R2、R3和R4生物膜EPS含量分别增加了9.90%、15.65%和26.65%,说明C6-HSL、C7-HSL和C10-HSL对生物膜EPS含量也有一定促进作用.而R1的EPS含量下降了8.61%,说明C4-HSL对生物膜EPS含量有一定抑制作用.实验结果发现低温下生物膜EPS含量会随着投加AHLs侧链长度增长而增加.群体感应可以促进细菌分泌EPS从而粘连更多微生物,促使生物膜厚度增加[14-15].Wang等[16]也发现添加AHLs可以提高成熟生物膜中EPS的浓度.EPS的增加可提升成熟生物膜的生物量,但是,过厚的生物膜会导致传质效果变差,从而降低细胞活性[17],然而在本实验中,R5在生物量上升24.47%的前提下其生物膜硝化速率仍保持稳定,C12-HSL对反应器硝化效果提升作用最好.
EPS主要成分为多糖(PS)和蛋白质(PN),两者含量和比值对EPS性质有很大影响.如图7所示,与R0相比,R1中生物膜的PS和PN含量分别下降了19.75%和5.42%,说明低温下C4-HSL对生物膜EPS中的PN和PS含量有不同程度抑制作用.PN与EPS疏水性紧密相关[18],它可以调节EPS表面电荷并与PS通过共价键形成稳定复合物,从而提高生物膜的稳定性[19].PS是一种亲水性高分子聚合物[8],其长碳链骨架可提高EPS絮凝性,并充当EPS中细胞其他组分的骨干.PN和PS的减少不利于细菌附着生长,这是投加C4-HSL后R1生物量下降的重要原因.而R5生物膜EPS中的PN含量上升了67.37%,PS含量基本稳定,说明低温下C12-HSL可以大幅提高生物膜中PN的含量,从而促进细胞附着生长,这是R5生物量比R0高24.47%的主要原因.R2~R4生物膜EPS中PN含量较R0分别上升了12.41%、18.77%和34.19%,说明低温下C6-HSL、C7-HSL和C10-HSL也能一定程度上提高EPS中PN含量,所以R2、R3和R4的生物量出现不同程度增加.
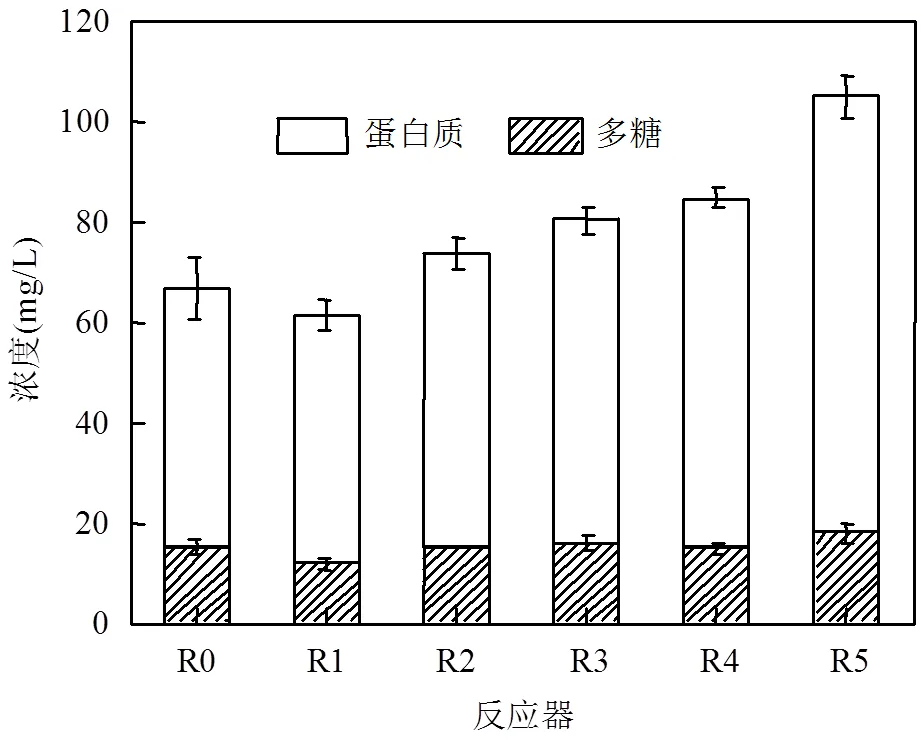
图7 第20d反应器生物膜EPS分析

a.对照组;b.添加C4-HSL;c.添加C6-HSL;d.添加C7-HSL;e.添加C10-SHSL;f.添加C12-HSL
波峰A、B分别代表酪氨酸类蛋白质和类色氨酸物质,属于细胞代谢物[20].波峰C、D和E代表芳香族蛋白质物质,属于细胞成分[21]
采用三维荧光(EEM)对EPS组分进行进一步分析.如图8所示,与R0相比,R1的A峰基本稳定,新出现E峰说明其代谢活性变化不大但种群演替剧烈,结合R1硝化效果,说明C4-HSL对生物膜的种群结构影响大于细菌代谢活性影响.R2和R5的波峰B、C和D强度大幅增大,说明投加C6-HSL和C12- HSL后生物膜细菌生命活性更旺盛,细胞更替剧烈.R5的A峰消失而R2的A峰存在,说明C12-HSL对生物膜种群结构影响大于C6-HSL.R3和R4的A峰变化不大而C、D峰均有小幅上升,说明添加C7- HSL和C10-HSL后生物膜细胞代谢活性基本稳定但更替水平略有上升.
2.4 AHLs类型对内源信号分子释放的影响
实验第30d时测定R0~R5生物膜中AHLs含量,结果如图9所示:添加C4-HSL、C6-HSL、C7-HSL、C10-HSL和C12-HSL后R1~R5的该类AHLs浓度分别比R0高9.45,36.73,26.35,40.73和39.80ng/g,而其它类型AHLs浓度基本稳定.这表明外源添加AHLs对生物膜AHLs的内源释放影响具有长期性,这是停止添加AHLs后反应器硝化效果还能持续维持的主要原因.低温条件下添加上述几类AHLs均能持续促进生物膜分泌对应种类信号分子,其中C10-HSL、C12-HSL、C6-HSL和C7-HSL促进作用较大,而C4-HSL促进作用较小,这可能是因为C4-HSL在多菌种复杂环境中稳定性不如其它信号分子,从而难以充分刺激细菌分泌C4-HSL.添加C4-HSL后R1生物膜EPS浓度下降了8.61%,AOB丰度和硝化效果变化均不明显,说明C4-HSL对低温下生物膜硝化能力影响微弱,不具备实际工程价值.
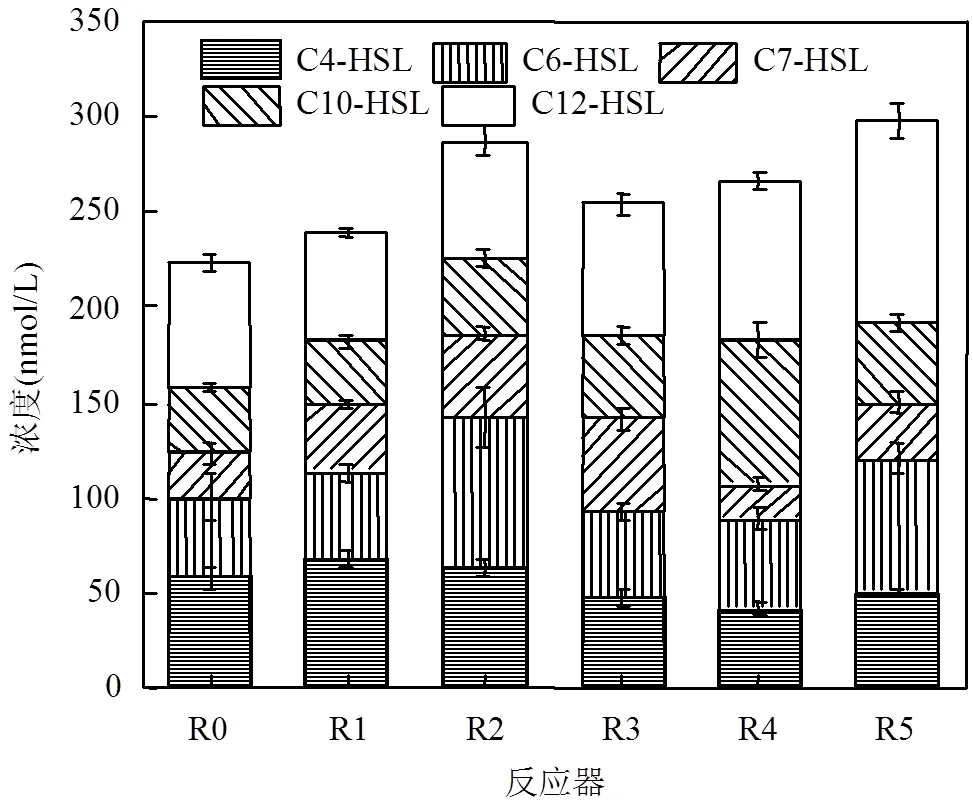
图9 第20d反应器生物膜AHLs浓度
3 结论
3.1 低温下外源投加合适类型的AHLs可促进成熟生物膜的硝化效果,其中C6-HSL主要通过提升生物膜硝化活性(17.56%)来实现,C12-HSL主要通过增加生物量(24.47%)来实现.
3.2 低温下外源添加合适类型的AHLs可通过增加EPS中的蛋白质含量来提升生物膜附着性能,其中C12-HSL对EPS中蛋白质含量促进作用最明显,可将蛋白质含量提升67.37%.
3.3 低温下外源添加C6-HSL、C7-HSL、C10-HSL和C12-HSL可长期促进生物膜分泌对应AHLs,从而对反应器硝化性能产生持久影响.
[1] 金 可.移动床生物膜多级AO反应器脱氮试验研究[D]. 重庆:重庆大学, 2013. Jin K. Experimental study on nitrogen removal in moving bed biofilm multistage AO reactor [D]. Chongqing: Chongqing University, 2013.
[2] Bassler M, Miller. Quorumsensing in bacteria [J]. Annual Review of Microbiology, 2001,55:165-199.
[3] Wang X, Wang W, Li Y, et al. Biofilm activity, ammonia removal and cell growth of the heterotrophic nitrifier,sp., facilitated by exogenous N-acyl-homoserine lactones [J]. RSC Advances, 2018, 8(54):30783-30793.
[4] Wang J, Liu Q, Hu H, et al. Insight into mature biofilm quorum sensing in full-scale wastewater treatment plants [J]. Chemosphere, 2019,234:310-317.
[5] Tan C H, Koh K S, Xie C, et al. The role of quorum sensing signalling in EPS production and the assembly of a sludge community into aerobic granules [J]. The ISME Journal, 2014,8(6):1186-1197.
[6] Hu H, He J, Yu H, et al. A strategy to speed up formation and strengthen activity of biofilms at low temperature [J]. RSC Advances, 2017,7(37):22788-22796.
[7] Li A, Hou B, Li M. Cell adhesion, ammonia removal and granulation of autotrophic nitrifying sludge facilitated by N-acyl-homoserine lactones [J]. Bioresource Technology, 2015,196:550-558.
[8] 胡惠秩.常/低温下AHLs类群体感应信号分子对SBBR系统影响的研究[D]. 哈尔滨:哈尔滨工业大学, 2017. Hu H Z. Study on the influence of AHLs group sensing signal molecules on SBBR system under normal/low temperature [D]. Harbin, Harbin Institute of Technology, 2017.
[9] APHA. Standard Methods for the Examination of Water and Wastewater [M]. Washington, D.C, USA, 2005.
[10] 郑照明,李 军,杨京月,等.不同C/N比和碳源种类条件下的SNAD生物膜脱氮性能[J]. 中国环境科学, 2017,37(4):1331-1338. Zheng Z M, Li J, Yang J Y, et al. Nitrogen removal performance of snad biofilm under different C/N ratios and carbon sources [J]. Chinese Environmental Science. 2017,37(4):1331-1338.
[11] Ma H, Wang X, Zhang Y, et al. The diversity, distribution and function of N-acyl-homoserine lactone (AHL) in industrial anaerobic granular sludge [J]. Bioresource Technology. 2018,247:116-124.
[12] Zhang J, Li J, Zhao B, et al. Long-term effects of N-acyl-homoserine lactone-based quorum sensing on the characteristics of ANAMMOX granules in high-loaded reactors [J]. Chemosphere, 2019,218:632- 642.
[13] 陈重军,张海芹,汪瑶琪,等.基于高通量测序的ABR厌氧氨氧化反应器各隔室细菌群落特征分析[J]. 环境科学, 2016,37(7):2652-2658. Chen C J, Zhang H Q, Wang Y Q, et al. Analysis of bacterial community characteristics in each compartment of ABR anammox reactor based on high-throughput sequencing [J]. Environmental Science. 2016,37(7):2652-2658.
[14] 宋志伟,邱 杰,张 晴,等.细菌群体感应在好氧颗粒污泥中的研究现状[J]. 绿色科技, 2018,(16):8-10. Song Z W, Qiu J, Zhang Q, et al. Research status of bacterial quorum sensing in aerobic granular sludge [J]. Green Technology, 2018,(16): 8-10.
[15] Costerton J W. Introduction to biofilm [J]. International Journal of Antimicrobial Agents. 1999,11(3):217-221.
[16] Wang J, Liu Q, Ma S, et al. Distribution characteristics of N-acyl homoserine lactones during the moving bed biofilm reactor biofilm development process: Effect of carbon/nitrogen ratio and exogenous quorum sensing signals [J]. Bioresource Technology, 2019,289: 121591.
[17] Torresi E, Fowler S J, Polesel F, et al. Biofilm thickness influences biodiversity in nitrifying mbbrs-implications on micropollutant removal [J]. Environmental Science & Technology, 2016,50(17): 9279-9288.
[18] 胡远超.外加AHLs和活性污泥对解体好氧颗粒污泥修复过程的影响[D]. 济南:山东大学, 2019. Hu Y C. Effects of addition of AHLs and activated sludge on the remediation process of decomposed aerobic granular sludge [D]. Jinan: Shandong University, 2019.
[19] Shi Y, Huang J, Zeng G, et al. Exploiting extracellular polymeric substances (EPS) controlling strategies for performance enhancement of biological wastewater treatments: An overview [J]. Chemosphere, 2017,180:396-411.
[20] Chen W, Westerhoff P, Leenheer J A, et al. Fluorescence excitation−emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science & Technology, 2003,37(24):5701-5710.
[21] Wang Z, Gao M, Wang Z, et al. Effect of salinity on extracellular polymeric substances of activated sludge from an anoxic–aerobic sequencing batch reactor [J]. Chemosphere, 2013,93(11):2789-2795.
[22] 卞 伟.中低温条件下移动床生物膜工艺的亚硝化特性及调控策略[D]. 北京:北京工业大学, 2018. Bian W. Nitrosation characteristics and control strategy of moving bed biofilm process at medium and low temperatures [D]. Beijing: Beijing University of Technology, 2018.
[23] Lv Y, Wan C, Lee D, et al. Microbial communities of aerobic granules: Granulation mechanisms [J]. Bioresource Technology, 2014,169:344- 351.
[24] Kuenen J G, Robertson L A. Combined nitrification-denitrification processes [J]. FEMS Microbiology Reviews, 1994,15(2):109-117.
[25] 冯 惠.基于AHL的群体感应强化受微污染水中微生物去除氨氮及机制研究[D]. 哈尔滨:哈尔滨工业大学, 2017. Feng H. Study on mechanism and mechanism of microbial removal of ammonia nitrogen from micro polluted water enhanced by quorum sensing based on AHL [D]. Harbin: Harbin Institute of Technology, 2017.
[26] Yao Y, Martinez-Yamout M A, Dickerson T J, et al. Structure of the escherichia coli quorum sensing protein sdiA: Activation of the folding switch by acyl homoserine lactones [J]. Journal of Molecular Biology, 2006,355(2):262-273.
Effects of AHLs at low temperature on the characteristics of mature biofilms in aerobic zone of multi-stage A/O technology.
ZHOU Rong-xuan1, MA Xiao-ran1, LI Jun1*, ZHANG Lin-Hua2, ZHANG Jing1, ZHANG Ya-chao1, HAN Hao1,
(1.Faculty of Urban Construction of Beijing University of Technology, Beijing 100124, China;2.Beijing Zhibao Information Technology Co, Ltd, Beijing 102600, China)., 2021,41(5):2311~2140
Aiming at the problem that the ammonia nitrogen in the effluent of the multi-stage A/O technology is likely to exceed the standard under low temperature conditions, the effect of exogenous addition of acyl homoserine lactone signal molecules (AHLs) on the characteristics of the biofilm in the aerobic zone of the multi-stage A/O technology at low temperature was studied. Results showed that the addition of 100nmol/L hexanoyl homoserine lactone (C6-HSL) increased the biofilm nitrification efficiency by 22.34%, and lauryl homoserine lactone (C12-HSL) increased the amount of attachment biomass by 24.47%, both C6-HSL and C12-HSL had long-term effects on the nitrification efficiency and biological adhesion of biofilm. This was because C6-HSL can increase the aerobic biofilm nitrification activity by 17.56% at low temperature, while C12-HSL could increase the content of protein (PN) in EPS by 67.37%. In addition, both C6-HSL and C12-HSL could promote the endogenous release of the same signal, thus having a long-term positive impact on the nitrification activity and adhesion performance of biofilm. The high-throughput sequencing analysis showed that C6-HSL can increase the abundance of, and thus enhancing the nitrification activity of biofilm in R2; while the addition of C12-HSL had a greater impact on the abundance ofwhich was an important reason for the increase of PN content in EPS of R5 biofilm.
multi-stage A/O technology;biofilm;low temperature;quorum sensing
X703 文献识别码:A
1000-6923(2021)05-2133-08
周荣煊(1995-),男,四川雅安人,北京工业大学硕士研究生,主要从事分段进水多级A/O工艺研究.
2020-09-08
水体污染控制与治理科技重大专项(2018ZX07701001-25)
* 责任作者, 教授, jglijun@bjut.edu.cn
