甘草酸对多重耐药大肠杆菌的抗菌增敏作用
2021-05-28王春光张子闯吕建存王文静姚姗姗刘静茹赵子玉
张 鹏,王春光,张子闯,吕建存,王文静,姚姗姗,刘静茹,赵子玉,张 铁*
(1.河北农业大学动物医学院,保定 071000;2.江西农业大学动物科技学院,南昌 330000)
1940年,Abraham和Chain[1]从大肠杆菌菌体内发现第一种水解青霉素酶,首次报道大肠杆菌耐药性,自此大肠杆菌耐药性逐步引起广泛关注,2012年,Su等[2]从中国南方地区分离3 456株大肠杆菌,其耐药率达到了89.1%,其中,87.5%菌株具有多重耐药性。大肠杆菌的多重耐药性多与RND型外排泵过表达有关[3],其中,AcrAB-TolC是大肠杆菌最主要的RND型外排泵[4]。
AcrAB-TolC外排泵是由AcrA、AcrB和TolC 3部分构成的复合物,融合蛋白(AcrA)存在于细菌胞质间隙,两端分别连接内膜转运蛋白(AcrB)和外膜通道蛋白(TolC)。其中,AcrB蛋白由3个AcrB原体聚合成一同源三聚体结构,位于细胞内膜,当药物进入细菌的细胞质内,会被其捕获,并将药物分子转运至膜外[5]。如果AcrB的外排机制受到干扰或抑制,将会使得进入菌体内的药物分子不断积聚,从而恢复现有抗菌药物的杀菌效能。因此,AcrB是十分理想的外排泵抑制剂靶点。
RND型外排泵能量来源质子浓度梯度[6],质子载体羰基氰化物3-氯苯腙(CCCP)是最典型的质子泵抑制剂,主要通过降低跨膜电位来抑制外排泵的活性,但是CCCP是非特异性外排泵抑制剂,不能确定外排泵的种类。目前,已知的大肠杆菌AcrB外排泵抑制剂有PAβN[7]、吡喃并吡啶化合物MBX2319(9)[8]、吡啶并咪唑类化合物D13-9001[9]等,这些抑制剂毒性较大,没有相关临床应用的报道,因此寻找安全的外排泵抑制剂有望成为解决大肠杆菌多重耐药的重要途径之一。
本试验利用计算机虚拟筛选从中药单体数据库中得到AcrB外排泵抑制剂——甘草酸,并通过尼罗红外排、外膜渗透稳定性、内膜质子梯度影响、AcrB 调控基因表达等试验阐明其作用机制,为耐药菌临床防治提供一种有潜质的外排泵抑制剂。
1 材料与方法
1.1 主要材料
禽源多重耐药大肠杆菌E320分离自临床大肠杆菌病鸡(本实验室测序并保存,NCBI登录号:CP020933,对头孢噻肟、氯霉素、庆大霉素、左氧氟沙星等多种抗生素耐药)、大肠杆菌ATCC35218、ATCC25922均购自美国组织细胞收藏中心(ATCC),头孢噻肟钠(2 560 μg·mL-1)、磷霉素钠、氯霉素购自北京酷来搏科技有限公司,甘草酸(98%)、多黏菌素B、头孢噻肟钠购自上海迈瑞尔化学技术有限公司,头孢噻吩购自美仑生物技术有限公司,PAβN(≥99%)购自上海麦克林生化科技有限公司,羰基氰化物3-氯苯腙(CCCP)、尼罗红购自北京索莱宝科技有限公司,RNAisoPlus、PrimeScript RT reagent Kit with gDNA Eraser试剂盒购自TaKaRa公司,DioC2(3)购自Abbkine生物技术有限公司,荧光分光光度计(JascoFP-750)购自日本Jasco公司,LyightCyler实时荧光定量PCR仪购自罗氏公司。
1.2 AcrB蛋白和中药单体化合物的结构处理
大肠杆菌AcrB蛋白晶体结构(PDBID:2 drd)从PDB(Protein Data Bank,www.rcsb.org)下载。用AutoDockTools(The Scripps Institute)进行处理,删除水分子,加电荷、加氢原子,并转换成pdbqt格式。中药单体化合物结构从ZINC数据库(http://zinc.docking.org)下载,并转换成pdbqt格式。
1.3 AcrB外排泵抑制剂虚拟筛选及作用力分析
通过AutoDoockTools的Grid Box工具找到2 drd 蛋白的活性口袋,用PyRx(The Scripps Institute)运行Autodock Vina完成虚拟筛选,并应用DS Visualizer(BIOVIA)进行作用力分析。
1.4 联合抑菌试验
采用微量肉汤二倍稀释法[10],用MHB营养肉汤分别测定甘草酸、抗生素对大肠杆菌E320与大肠杆菌ATCC25922的最小抑菌浓度(MIC)。
采用微量棋盘稀释法对大肠杆菌E320进行药物体外联合抑菌试验[11],在纵横两个方向上以甘草酸、抗生素的MIC为初始浓度,对甘草酸和抗生素分别进行倍比稀释,每孔加入大肠杆菌菌液使终浓度为5×105CFU·mL-1,37 ℃培养20 h,以无细菌生长的最低药物浓度为联合用药MIC,计算分级抑菌浓度指数(FICI),判定联合用药效果。
FICI=MIC(甘草酸联合用药)/MIC(甘草酸单用)+MIC(抗生素联合用药)/MIC(抗生素单用)
判定标准:FICI≤0.5判定为协同作用,0.5
1.5 尼罗红外排试验
试验分为4个组,分别为甘草酸3.125 mg·mL-1组、甘草酸6.25 mg·mL-1组、PAβN 25 mg·L-1(阳性AcrB抑制剂)组和空白对照组。将E320菌株培养14 h(37 ℃ 200 r·min-1),在室温下,4 400 r·min-1离心10 min,弃上清,在含有1 mmol·L-1MgCl2的50 mmol·L-1K3PO3缓冲液(pH=7)中洗涤3次,随后,将细菌悬浮在上述缓冲液中至OD660 nm=1.0,静置15 min,然后,分别将3 mL 样品转移到4 mL离心管中,并且分别加入羰基氰化物3-氯苯腙(CCCP)使终浓度为10 μmol·L-1,静置15 min后,加入甘草酸或PAβN至所需终浓度,空白对照组加入等量生理盐水,混匀静置15 min,4 400 r·min-1离心5 min,弃上清,重悬在3 mL 上述缓冲液中,转到15 mL离心管中,加入尼罗红使终浓度为10 μmol·L-1,在振荡器(37 ℃ 140 r·min-1)上孵育3 h。随后将细胞在室温下静置60 min,4 400 r min-1离心5 min。弃上清,用吸水纸吸去管壁上的液滴,将细胞重悬于3 mL PBS中,转移到比色皿中。荧光分光光度计中测量荧光信号,调节激发波长为544 mm,发射波长为650 mm,激发狭缝宽度为10 nm,发射狭缝宽度为5 nm。监测细胞悬液的荧光强度,100 s后加入50 mmol·L-1葡萄糖,观察其300 s后的荧光强度变化[13]。
1.6 外膜渗透稳定性试验
试验分为4个组,分别为甘草酸 3.125 mg·mL-1组、甘草酸6.25 mg·mL-1组、阳性对照和空白对照组。将ATCC35218菌株培养14 h(37 ℃ 200 r·min-1),在室温下,4 400 r min-1离心10 min,弃上清,悬浮于50 mmol·L-1磷酸钾缓冲液(pH=7.0)中,洗涤3次。随后将细菌重悬在上述缓冲液中至OD660 nm=0.5。加入羰基氰化物3-氯苯腙(CCCP)使终浓度为10 μmol·L-1,再分别加入甘草酸至所需浓度,阳性对照加入多黏菌素B至终浓度为128 μg·mL-1,空白对照加入等量生理盐水,最后加入头孢噻吩使终浓度为32 μg·mL-1。通过分光光度计测量490 nm处的吸光度值,检测头孢噻吩在20 min内的水解情况[13]。
1.7 内膜质子梯度影响试验
试验分为3个组,分别为甘草酸 3.125 mg·mL-1组、甘草酸6.25 mg·mL-1组和空白对照组。将E320菌株培养至OD660 nm约0.5(37 ℃ 200 r·min-1),在室温下,4 400 r·min-1离心10 min,弃上清,重悬于50 mmol·L-1磷酸钾缓冲液(pH=7.0)中,洗涤2次。随后将细菌重悬在含有2.5 mmol·L-1K-EDTA 和1%乙醇缓冲液中,并在37 ℃孵育20 min,再次在室温下4 400 r min-1离心10 min,弃上清,并重悬在上述缓冲液中至OD660 nm=1。加入甘草酸至所需浓度,空白对照组加入等量生理盐水,转移至比色皿中,荧光分光光度计中测量荧光信号,调节激发波长为488 mm,发射波长为613 mm,激发狭缝宽度为10 nm,发射狭缝宽度为5 nm。首先记录细胞悬液的荧光强度60 s,然后加入DiOC2(3)至终浓度为10 μmol·L-1,在荧光强度达到平稳后,加入25 mmol·L-1葡萄糖,待荧光强度稳定后,再加入CCCP,观察其荧光强度变化[13]。
1.8 qPCR检测甘草酸与头孢噻肟钠对AcrB正负向调控基因表达的影响
将菌株E320培养至OD600 nm约0.5(37 ℃ 180 r·min-1),稀释细菌悬液至1×106CFU·mL-1,取10 mL细菌悬液,分别进行以下处理:甘草酸组甘草酸终浓度为3.125 mg·mL-1;头孢噻肟钠组头孢噻肟钠终浓度为64 μg·mL-1;甘草酸与头孢噻肟钠联合应用组甘草酸的终浓度为3.125 mg·mL-1,头孢噻肟钠的终浓度为64 μg·mL-1;空白对照组加入等量生理盐水。各组于37 ℃ 200 r·min-1振摇培养12 h后,使用RNAisoPlus提取菌体RNA,OD260 nm/OD280 nm比值在1.8~2.0为合格样品。取1 μg总RNA使用PrimeScript RT reagent Kit with gDNA Eraser试剂盒制备cDNA。16S RNA及其他AcrB调控基因引物由生工生物工程股份有限公司合成(表1)。

表1 实时荧光定量PCR引物Table 1 RFQ-PCR primers
实时荧光定量PCR反应体系:Nuclease-Free H2O 7 μL,加入qPCR Master Mix 10 μL,上下游引物各0.5 μL,使终浓度为0.5 μmol·L-1,最后加入2 μL cDNA混匀。反应条件:95 ℃预变性3 min;95 ℃变性15 s,57 ℃退火60 s,循环45次;测定熔解曲线[14]。结果统计用2-ΔΔCt法[15]。
2 结 果
2.1 AcrB外排泵抑制剂的虚拟筛选
共筛选得到结合能低于-46.046 kJ·mol-1的中药单体14个,其中,以红杉黄酮(seguoiaflavone)结合能最高,为-50.232 kJ·mol-1,其次为豆甾醇(stigmasterol )结合能-48.976 2 kJ·mol-1、栝楼萜二醇-3-苯甲酸酯(karounidiol3-benzoate)结合能-48.557 6 kJ·mol-1、甘草酸(glycyrrhizin)结合能-47.720 4 kJ·mol-1,但考虑中药单体成分的溶解性、应用广泛性、价格等因素,选取甘草酸(glycyrrhizin)进行后续的研究。部分结果见表2。

表2 AutoDock Vina虚拟筛选的部分中药成分评分结果Table 2 Scoring results of some Chinese herbal medicinal ingredients screened virtually by AutoDock Vina
2.2 甘草酸配体与AcrB蛋白作用力分析
本试验对甘草酸(图1)与AcrB蛋白进行了分子间作用力分析,甘草酸与AcrB蛋白多个氨基酸残基形成了疏水作用力,并且还与对接部位形成多个氢键。其结合作用力为47.720 4 kJ·mol-1,主要作用位点为Gly126、Gln125、Ser48、Tyr49、Thr85、Thr87、Phe178、Phe615、Phe628、Ile277、Val612,与Gly126、Gln125、Ser48、Tyr49、Thr85、Thr87形成氢键,与Phe628、Phe615、Phe178、Val612、Ile277形成疏水作用力(图2)。
图1 甘草酸结构示意图Fig.1 Structure of glycyrrhizic acid
2.3 甘草酸和抗生素的联合抑菌试验
通过微量肉汤二倍稀释法测得甘草酸对大肠杆菌E320与大肠杆菌ATCC25922的MIC均>25 mg·mL-1,磷霉素钠、氯霉素、头孢噻肟钠对大肠杆菌E320的MIC分别为512、512和1 024 μg·mL-1。磷霉素钠、氯霉素、头孢噻肟钠对大肠杆菌ATCC25922的MIC分别为32、8和2 μg·mL-1。
联合抑菌试验结果显示甘草酸使磷霉素钠对大肠杆菌E320的MIC降为原来的1/8(64/512);甘草酸使氯霉素对大肠杆菌E320的MIC降为原来的1/2(256/512);甘草酸使头孢噻肟钠对大肠杆菌E320的MIC降为原来的1/8(128/1 024),详情见表3。
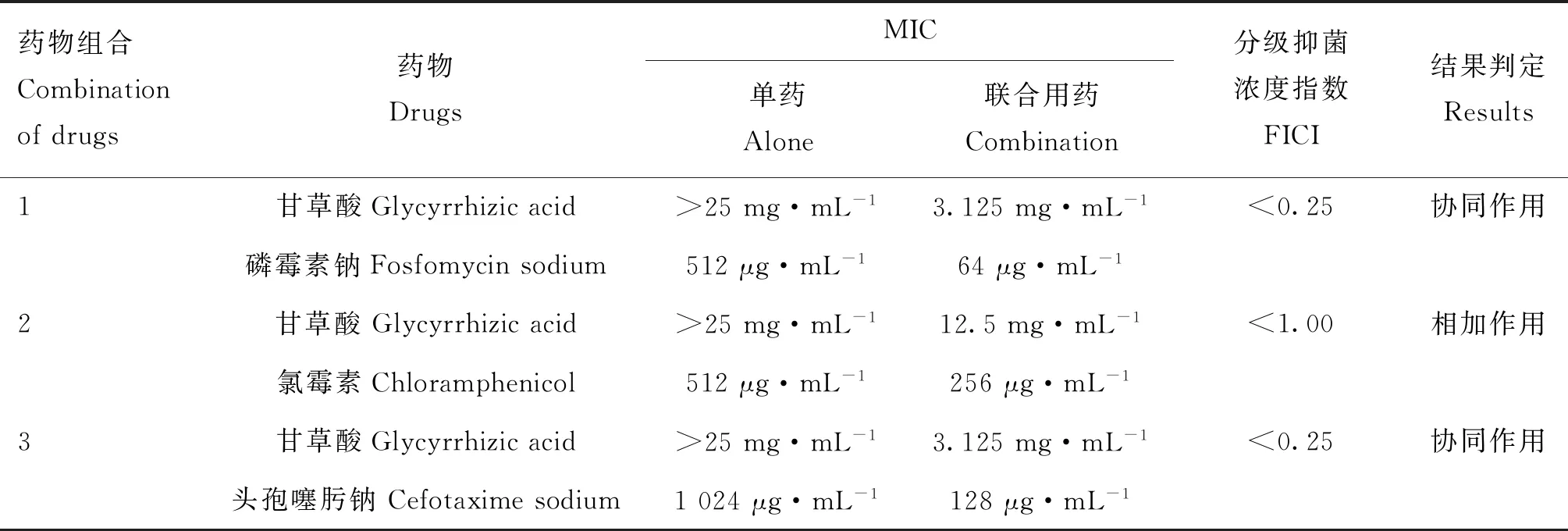
表3 甘草酸和抗生素联合抑菌试验Table 3 Combined drugs susceptibility test of glycyrrhizic acid and antibiotics
2.4 尼罗红外排试验
本试验中,甘草酸6.25 mg·mL-1组荧光强度(13.7 au)与25 mg·L-1PAβN组(13.9 au)均高于3.125 mg·mL-1组(12.8 au),并且均高于空白对照组(12.4 au),加入葡萄糖后,甘草酸6.25 mg·mL-1组荧光强度(11.6 au)下降明显小于3.125 mg·mL-1组(10.6 au)与25 mg·L-1PAβN组(11.0 au),且下降后荧光强度仍保持原有趋势,即高于空白对照组(10.3 au)(图3)。
2.5 外膜渗透稳定性测定
试验结果显示,甘草酸3.125、6.25 mg·mL-1组与空白对照组在20 min内荧光强度趋于稳定,均无明显上升(图4)。
2.6 内膜质子梯度影响试验
试验结果显示,甘草酸3.125 mg·mL-1组与空白对照组相比变化很小,但甘草酸浓度增加为6.25 mg·mL-1时与空白对照相比变化较大(图5)。
2.7 qPCR检测甘草酸与头孢噻肟钠对AcrB正负调控基因表达量的影响
AcrAB-TolC外排泵的调控基因包括AcrR、AcrS、Fis、MarA、MarR、MppA、RamA、Rob、RpoS、SdiA、SoxR、SoxS等,结果显示,甘草酸可显著诱导AcrS、MppA、RamA、RpoS、SdiA、SoxR的mRNA下调,头孢噻肟钠可显著诱导AcrB、AcrR、Fis、MarR、Rob、SdiAmRNA表达上调,甘草酸联合头孢噻肟钠使用可显著促进AcrR、Fis、MarR、Rob、RamAmRNA的表达和抑制AcrB、MarAmRNA的表达(图6)。

a.甘草酸与AcrB蛋白结合2D示意图(绿色圆形.氢键的蛋白残基;绿色虚线.氢键;黑色字体.键长;紫色、粉色圆形.疏水作用力残基);b.甘草酸与AcrB蛋白结合3D示意图(粗棒.配体;细棒.蛋白残基;绿色虚线.氢键;蛋白表面的颜色.疏水作用力;左下角图例.作用力)a.2D diagram of glycyrrhizic acid binding with AcrB protein (Green round.Hydrogen-bonded protein residue;Green dotted line.Hydrogen bond;Black font.Bond length;Purple or pink round.Hydrophobic residues);b.3D diagram of glycyrrhizic acid binding with AcrB protein (Thick rod.Ligand;Thin rod.Protein residue;Green dotted line.Hydrogen bond;Protein surface color.Hydrophobic force;Legend at bottom left.Interaction)图2 甘草酸与AcrB蛋白作用力分析Fig.2 Analysis of interaction between glycyrrhizic acid and AcrB protein
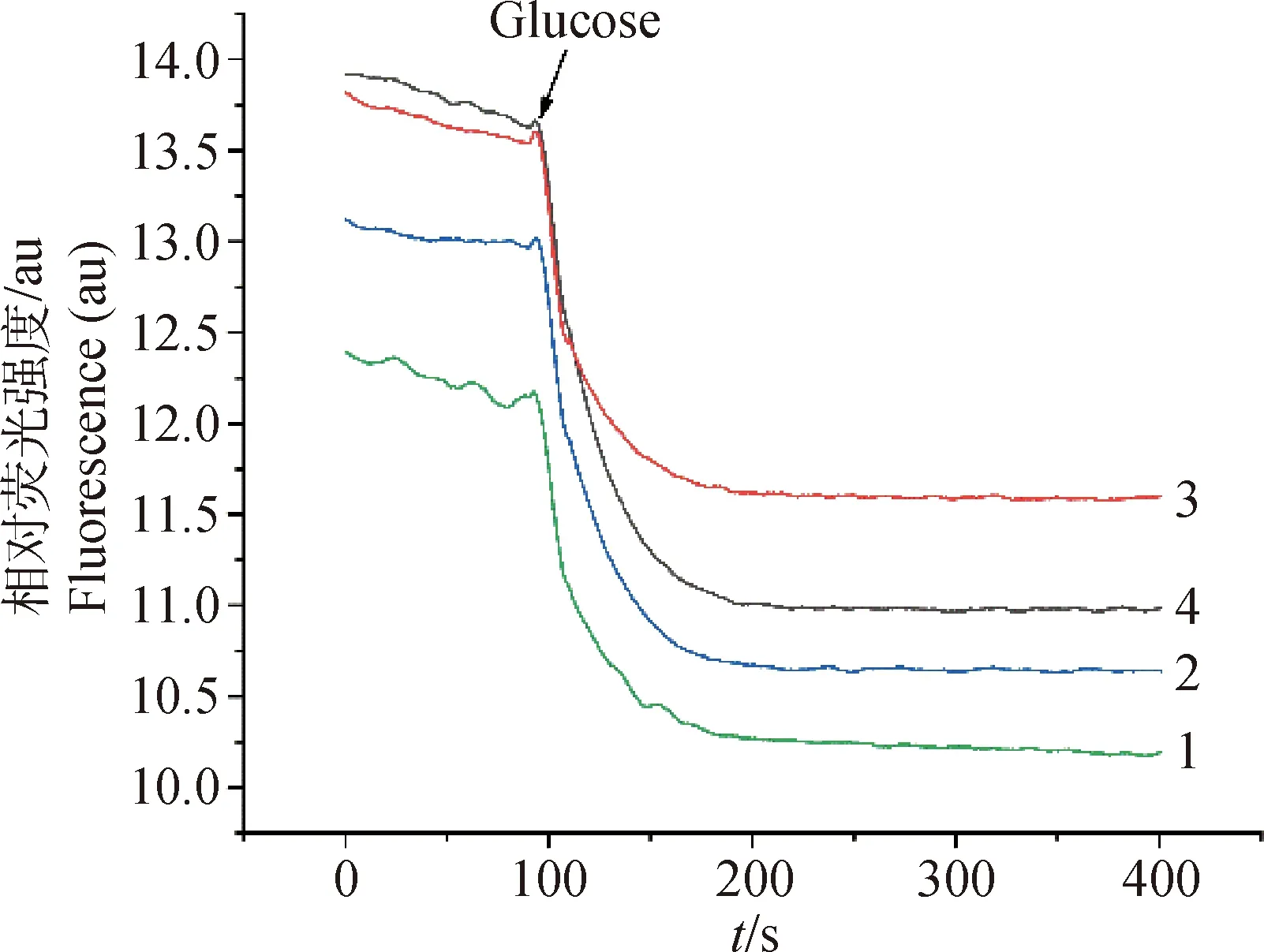
1.空白对照组;2.甘草酸3.125 mg·mL-1组;3.甘草酸6.25 mg·mL-1组;4.25 mg·L-1 PAβN组1.Blank control group;2.3.125 mg·mL-1 glycyrrhizic acid group;3.6.25 mg·mL-1 glycyrrhizic acid group;4.25 mg·L-1 PAβN group图3 甘草酸对大肠杆菌E320尼罗红外排的影响Fig.3 Effect of glycyrrhizic acid on Nile red efflux of E.coli E320
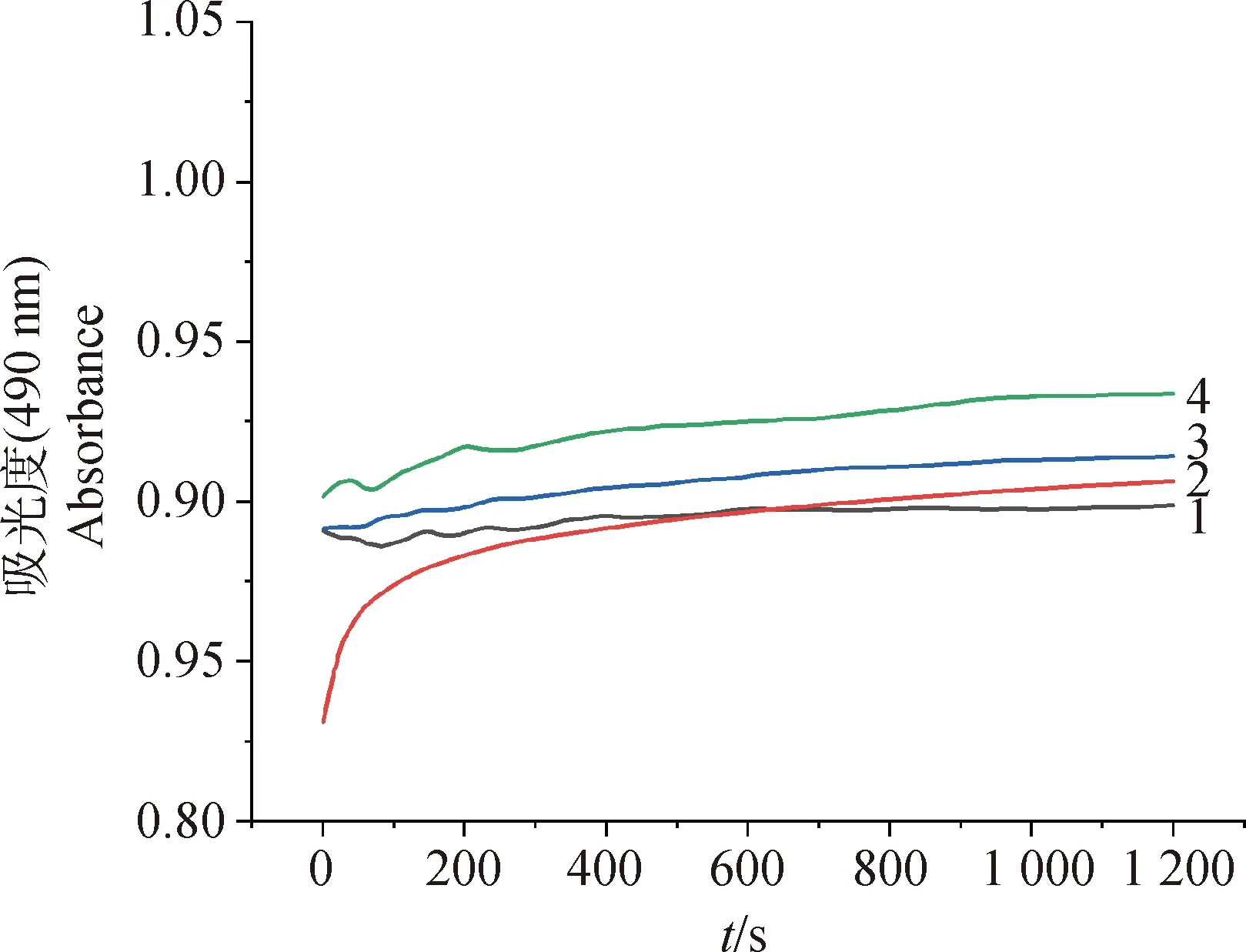
1.空白对照组;2.阳性对照组;3.甘草酸3.125 mg·mL-1组;4.甘草酸6.25 mg·mL-1组1.Blank control group;2.Positive control group;3.3.125 mg·mL-1 glycyrrhizic acid group;4.6.25 mg·mL-1 glycyrrhizic acid group图4 甘草酸对大肠杆菌ATCC35218外膜渗透性的影响Fig.4 Effect of glycyrrhizic acid on outer membrane permeability of E.coli ATCC35218

1.空白对照组;2.甘草酸3.125 mg·mL-1组;3.甘草酸6.25 mg·mL-1组1.Blank control group;2.3.125 mg·mL-1 glycyrrhizic acid group;3.6.25 mg·mL-1 glycyrrhizic acid group图5 甘草酸对大肠杆菌E320内膜质子浓度的影响Fig.5 Effect of glycyrrhizic acid on proton gradient across the inner membrane of E.coli E320
3 讨 论
计算机辅助药物设计(CADD)以计算模拟的方式使试验中效率低下的问题得以有效解决[16]。Autodock Vina由Scripps研究所研发,是AutoDock的第2代分子对接软件,Vina分子对接的精度较AutoDock更高。并且Vina操作简易,可进行并行计算,对接速度较AutoDock具有很大优势[17]。本研究通过Autodock Vina软件对中药单体与AcrB蛋白进行分子对接模拟,结果显示,多种中药单体与AcrB蛋白受体有好的结合作用。已知AcrB抑制剂PAβN主要与AcrB的Phe136和Phe628形成疏水作用[18]。甘草酸与PAβN具有相同的结合位点,且与其他已知的AcrB抑制剂(MBX2319[9]和D13-9001[19])重叠部分为Phe178、Phe615、Phe628,提示这些位点可能为AcrB蛋白抑制剂作用的主要位点。
联合抑菌试验显示甘草酸与氯霉素有相加作用,与头孢噻肟钠、磷霉素钠有协同作用,其中,氯霉素与头孢噻肟钠刚好属于大肠杆菌AcrAB-TolC外排泵底物[20-21],一定程度上提示甘草酸降低头孢噻肟钠的耐药性是外排泵活性降低引起的。
尼罗红是一种亲脂性染料,在水溶性介质中显示极弱的荧光,可以忽略,但是在非极性环境(如细胞膜中),其荧光水平将迅速增强。PAβN是一种已知的作用于革兰阴性菌(如大肠杆菌AcrB)主要的多药耐药外排泵抑制剂[22],本试验中结果显示,甘草酸可以抑制大肠杆菌E320的外排活性,且与PAβN具有相似的作用,并在加入葡萄糖激活外排泵后,仍具有一定抑制作用,表明甘草酸能够抑制大肠杆菌外排泵的活性,从而阻止头孢噻肟钠外排,进而杀死细菌,很好地解释了甘草酸降低头孢噻肟钠MIC的作用机制。

Control.空白对照组;Gly.甘草酸组;CTX.头孢噻肟组;CTX+Gly.头孢噻肟与甘草酸联用组。小写字母a~d.不同字母表示差异显著(P<0.05)Control.Blank control group;Gly.Glycyrrhizic acid;CTX.Cefotaxime sodium;CTX+Gly.Combination of cefotaxime sodium and glycyrrhizic acid.The lowercase letters a-d.Different letters indicated significant differences (P<0.05)图6 甘草酸对AcrAB-TolC外排泵调控基因相对表达量的影响Fig.6 Effect of glycyrrhizic acid on relative expression of regulatory genes of AcrAB-TolC efflux pump
革兰阴性菌的细胞外膜发挥着渗透屏障的作用,有些化合物可以通过破坏阴性菌的外膜渗透稳定性导致抗菌药物透过外膜屏障,进而增加细菌内该药物浓度的累积。头孢噻吩易被β-内酰胺酶水解,水解产物能够被分光光度计在490 nm处检测到。头孢噻吩的水解速率受其扩散透过细胞外膜的速率限制:头孢噻吩透过外膜的速率越快,其水解速率越快,水解产物的荧光强度就越高。因此头孢噻吩水解产物的荧光强度可以反映出外膜渗透性的强弱。本试验中加入甘草酸未对外膜渗透性产生影响,表明甘草酸能够增加细菌体内头孢噻肟钠的浓度不是由于外膜渗透性的改变引起的。
AcrB蛋白在外排转运底物时需要消耗能量,这种能量是以质子动力作为能源[23]。有些化合物能够阻碍AcrB外排泵的能量来源,通过破坏质子浓度梯度,使外排泵失去能量供应,进而瓦解其外排作用。对内膜质子梯度影响试验主要通过DioC2(3)荧光检测法来测定。本试验结果表明,浓度为3.125 mg·mL-1的甘草酸不会阻碍AcrB外排泵的能量来源。
AcrB蛋白的表达受多个调控因子的影响,其中主要的正向调控子有MarA、SoxS、RamA、Rob、SdiA,MarA基因编码MarA调控子与SoxS基因编码的SoxS调控子可以激活AcrAB的表达[24];SoxR基因编码的SoxR蛋白能够激发SoxS基因的转录。SoxS基因编码的SoxS蛋白属于全局调控蛋白,它可以激活AcrAB-TolC的表达从而使细菌对抗生素的敏感性降低[25];RamA基因编码的RamA调控子过表达可能通过诱导AcrAB-TolC外排泵的表达导致细菌出现多重耐药性[26];Rob基因所编码的Rob调控子与MarA、SoxS属于同一转录调控子家族,过表达会增加多种抗生素的低水平耐药性[27];SdiA基因所编码的SdiA调控子过量表达可激活AcrAB基因的表达[28]。主要的负向调控子有AcrR、MarR,AcrR基因编码的AcrR调控子能与AcrAB基因结合,抑制AcrAB蛋白的表达[29];MarR基因编码的MarR调控子能够抑制正向调控子MarA基因的转录激活[30]。当单个或多个Acr基因失活时,所有RND外排泵基因的表达均增加,提示存在一种激活同源外排泵基因转录的反馈机制[31]。Zhang等[32]发现转录调节基因RamA在AcrA或AcrB单一缺失突变体中表达显著增加,这一发现也从某种程度上证明了该反馈机制的存在。因此甘草酸联合头孢噻肟钠导致RamA、Rob、SdiA过表达很可能也是由于这一反馈机制的存在,甘草酸与AcrB蛋白结合使正常的AcrB蛋白失活,从而促进其表达。而AcrB的表达降低可能与负向调控子AcrR、MarR过表达相关。
甘草酸是甘草中主要的活性成分,具有抗炎、抗病毒、抗氧化等生物学活性[33-34],又称甘草甜素,作为甜味剂广泛用于各类食品。甘草为豆科植物的干燥根和根茎,是一种补益中草药,在临床上被广泛应用,有“十方九草”之称。
一个良好的AcrB抑制剂应该具备4个条件:1)对AcrB过表达菌株能增强抗生素的抗菌活性;2)对AcrB底物尼罗红具有外排抑制活性;3)不会破坏细菌外膜的渗透性;4)不会影响细菌的内膜质子梯度。通过本试验发现甘草酸有望成为1种新的AcrB外排泵抑制剂,对治疗耐药菌引发的疾病具有重要意义。
4 结 论
甘草酸可以抑制多重耐药大肠杆菌E320耐药性,其主要机制:甘草酸结合大肠杆菌多药外排泵转运蛋白AcrB,进而抑制其外排活性,不影响外膜通透性和内膜质子梯度;诱导负向调控子AcrR、MarR过表达,来抑制AcrB的表达,造成抗生素在菌体内蓄积从而提高抗生素的杀菌作用。
