牛胚胎性别鉴定荧光定量PCR方法的优化与应用
2021-05-28冯春涛顾文源王志仙赵增元朱宏波倪俊卿褚素乔余文莉李树静
冯春涛,顾文源,王志仙,赵增元,7,朱宏波,倪俊卿,褚素乔,余文莉*,李树静*
(1.石家庄天泉良种奶牛有限公司,石家庄 050200;2.石家庄市畜牧技术推广站,石家庄 050000;3.河北省动物疫病预防控制中心,石家庄 050035;4.河北省畜牧良种工作总站,石家庄 050020;5.河北省牛产业技术研究院,石家庄 050200;6.河北省奶牛良种繁育工程技术研究中心,石家庄 050200;7.河北省第三批“巨人计划”创新创业团队,石家庄 050200)
在畜牧业生产中,许多生产性状受性别控制,后代性别预选为提高畜牧业系统的盈利能力和可持续性提供了机会[1]。奶牛作为重要的经济动物,只有母牛可以产奶,性别决定和性别控制对奶业生产具有重要意义[2]。在奶牛胚胎移植行业中,胚胎性别鉴定是一项强有力的工具,可以帮助奶牛养殖者更有效地管理其育种资源[3]。为了控制后代的性别,必须对植入前的胚胎进行有效的性别鉴定[4]。早期胚胎性别鉴定方法主要有细胞学方法、免疫学方法、分子生物学方法等[5]。20世纪80年代中期,牛Y染色体特异性DNA探针的鉴定,以及随后聚合酶链式反应(PCR)技术的发展,使得胚胎的性别鉴定理论成为现实[6]。近几年的研究表明,牛的雄性和雌性胚胎不仅在染色体补体上有差异,而且在转录活性和表观遗传状态上也有差异。胚胎转录中的两性异形影响碳水化合物和氨基酸代谢,雌性胚胎显示较慢的线粒体代谢[7],这提供了一条通过无创代谢组学进行胚胎性别标记测定的新思路。Hamilton等[8]用RT-PCR或RT-qPCR法性别鉴定的8个Y染色体关联基因中的3个基因(DDX3Y-1、USP9Y-1、ZRSR2Y-1)代表了基于RNA胚胎性别鉴定的良好候选基因,并且可以代替基于DNA的性别鉴定步骤。
1990年,Herr等[9]首次用PCR方法对牛胚胎进行了性别鉴定,并且许多研究也证明了这项技术的潜力。Bredbacka等[10]报道,胚胎性别鉴定(从活检到凝胶电泳结束)用6~7 h完成,而且有一些方法可以将性别鉴定所需的时间减少1~2 h。PCR方法因其灵敏高效、准确率高、所用时间短的特点而优于上述方法,被广泛采用。但是PCR法存在容易被污染的危险,极易导致扩增出异源片段。
本研究利用牛折叠蛋白基因存在X染色体上的特点,设计1组引物及探针专用于鉴别牛的胚胎,然后再利用公牛的特异性基因SRY,选取其序列进行引物及探针的特异性设计,将两组探针组合构建一个复合检测体系,用于鉴定牛早期胚胎的性别,以有效地避免常规PCR所带来的污染,提高检出率及准确率,使检测过程更加简便,结果更加灵敏、可靠。
1 材料与方法
1.1 试验动物
用于生产胚胎的供体牛为12~15月龄的育种值排名前5%的荷斯坦育成牛,受体牛为低产奶牛或西杂黄牛。
1.2 试验材料
1.2.1 胚胎 胚龄为7~7.5 d,发育阶段为紧缩桑椹胚、早期囊胚、囊胚和扩张囊胚,质量为1、2级。
1.2.2 冷冻精液 世界排名前50名,与供体牛近交系数小于6.25%的荷斯坦种公牛冻精。
1.3 主要仪器
倒置显微镜(OLYMPUS)、胚胎分割仪(WETZLAR)、PCR仪、荧光定量PCR仪(7900HT)、荧光定量PCR仪(Q6)、电泳仪、UV显像仪、POLAROID照相系统、胚胎冷冻仪(CL-5500,Australian)。
1.4 主要耗材与溶液
1.4.1 耗材 六孔平皿(PETS公司)、∮60 mm分割平皿(BECTON DICKINSON公司)、显微分割刀(AB Technology,Inc,Pullman WA)、2 μL 取样吸头和200 μL通用吸头(AB Technology,Inc,Pullman WA)、100 μL离心管、96孔板(Corning)。
1.4.2 溶液 PBS溶液(GIBOC)、胚胎保存液(HOLDING,ICP公司)、EG胚胎冷冻液(ICP公司)、YCD-PCR扩增反应试剂盒(美国AB公司)、雌性和雄性扩增对照样品(美国AB公司)、胚胎分割液(SPLITTING,自制)。分割液配方:CaCl2·2H2O 0.05 g·L-1,MgCl2·6H2O 0.04 g·L-1,KCl 0.2 g·L-1,KH2PO40.2 g·L-1,NaCl 8 g·L-1,Na2HPO41.15 g·L-1,EDTA.Na2·2H2O 0.001 5 g·L-1。
1.5 胚胎生产及胚胎取样
1.5.1 胚胎生产 供体牛用CIDR-FSH-PG-GnRH 法超排,用常规非手术法采集胚胎。准备进行性别鉴定的胚胎在人工授精后第7天收集。根据IETS手册,只采用从致密桑椹胚阶段到扩张囊胚阶段的1级 胚胎或在某些情况下的2级胚胎,在取样前透明带完好无损[6],将胚胎洗涤10次。操作室温度保持20~25 ℃,冷冻前胚胎保存在HOLDING液中。
1.5.2 胚胎取样 将胚胎分割仪与倒置显微镜固定在一起,将显微分割刀固定在显微操作仪的操作手上,在∮60 mm培养皿中做一个50 μL的分割液滴,每个胚胎在取样前先在分割液中洗5遍,将洗好的胚胎放入其中。胚胎被放大100倍进行分割取样。在桑椹胚的边缘或囊胚的滋养层切取细胞样品。每个胚胎取样后用移液枪吸取2 μL的回收液,从分割液滴中将样品吸起,推入装有8 μL超纯水的100 μL EP离心管中。样品取走后,用200 μL通用吸头吸取50 μL HOLDING液,从分割液滴中将取样后的胚胎吸起,放入六孔平皿对应的HOLDING液滴中准备移植或冷冻。
1.6 YCD-PCR法扩增目的基因片段
1.6.1 扩增体系及程序 YCD试剂盒含有PCR反应所需的特异性引物、内标物、dNTP、Taq酶等。在每个加有样品的离心管中依次加入8.5 μL YCD,然后将其摆放在PCR反应槽中,变性温度95 ℃,延伸温度72 ℃,退火温度64 ℃,经过30个循环65 min进行DNA扩增。PCR扩增结束后,吸取5 μL溴酚蓝对样品染色并点样,启动电泳仪。样品在130~140 V电压的琼脂糖凝胶板上运行15~20 min。
1.6.2 电泳图像判读标准 如样品出现3条电泳带,即雌雄共有的常染色体基因片段、Y染色体上相应片段和“引物带”的胚胎即雄性胚胎,只出现共有基因片段和“引物带”的胚胎即雌性胚胎。判定结果分为3类:1)鉴定结果明显:将雌或雄结果明显,无任何污染条带,定为性别鉴定有效。2)鉴定结果差:带较暗;带与带之间模糊,外源DNA污染;雌性被雄性污染。3)无反应:只有引物带或无带。
1.7 荧光定量PCR方法扩增目的基因片段
1.7.1 引物及探针合成序列 利用牛折叠蛋白基因存在X染色体上的特点,设计1组引物NB2-F、NB2-R和探针NB2-P,然后再利用公牛的特异性基因SRY,选取其序列进行引物及探针的特异性设计,设计引物BOV97M-F、BOV97M-R和探针BOV97M-P,将两组探针组合构建一个复合性别鉴定体系,见表1。

表1 荧光定量PCR引物序列Table 1 Primer sequence of fluorescent quantitative PCR
1.7.2 荧光定量PCR方法不同的扩增体系 单引物分别扩增体系(荧光单扩):将胚胎样品DNA分成两份,分别利用内标引物和雄性位点引物进行扩增,根据内标和性别位点各自扩增结果合成胚胎性别判定结果;荧光双引物混合扩增体系(荧光双扩):将胚胎样品DNA与内标引物和雄性位点引物混合液同时扩增,根据内标和性别位点扩增情况判定胚胎性别。
1.7.3 荧光定量PCR扩增体系和程序 反应体系:Probe FAST qPCR Kit Master Mix(2×) Universal 5 μL,引物探针混合液(1∶3)Primer and probe mixture 1.2 μL,DNA 6 μL,探针ROX校正染料* Probe ROX calibration dye 0.2 μL,超纯水补至15 μL。反应程序设定:95 ℃预变性3 min;然后95 ℃ 30 s,58 ℃ 40 s,共45个循环;72 ℃10 min延伸后结束。
1.7.4 数据分析和结果判读标准 根据表2中的判读标准,依据内标的扩增曲线和CT值及性别位点的扩增曲线和CT值判读胚胎样本的性别。雌或雄结果明确者为鉴定有效。

表2 荧光定量PCR结果判读标准Table 2 Standard for interpretation of fluorescence quantitative PCR results
1.8 胚胎冷冻及解冻
1.8.1 胚胎冷冻 取样后胚胎在乙二醇(EG)冷冻液中平衡5 min并装入0.25 mL细管后,放于冷冻仪上进行常规冷冻。冷冻程序:-6 ℃平衡5 min,植冰平衡5 min,按0.5 ℃·min-1降温至-35 ℃投入液氮。
1.8.2 胚胎解冻 将雌性胚胎从液氮中取出,直接放入32~35 ℃水浴中10 s,将细管外的水迹拭干,将胚胎直接推入HOLDING液中洗3~4次,采用四段式将胚胎吸入0.25 mL细管内移植。
1.9 受体牛同期发情和移植
用CIDR-PG技术对受体牛进行同期发情处理,选用发情后6.5~8.5 d、黄体合格的受体牛进行移植。胚胎移植后60 d采用直肠检查法对受体牛进行妊娠检查。
1.10 统计分析
采用SPSS 20软件进行χ2检验或单因素方差分析。
2 结 果
2.1 不同方法的胚胎性别鉴定效果分析
本试验以进口YCD试剂盒PCR鉴定方法为对照组,荧光定量PCR的单引物分别扩增方法(荧光单扩,single primer separate amplification,FSPSA)和双引物混合扩增方法(荧光双扩,double primer mixed amplification,FDPMA)分别为试验组,对各组间的性别鉴定效率(efficiency of sex identification)、无反应率(non-reaction rate)、雌雄胚胎百分率(percent of female and male embryos)和比值(ratio of female and male embryos) 进行比较。
如表3所示:1) 荧光单扩组的雌性胚胎百分率极显著高于其他两组(P<0.01),而PCR电泳组和荧光双扩组之间差异不显著。2) 荧光单扩组的雄性胚胎百分率极显著低于荧光双扩组(P<0.01),极显著高于PCR电泳组(P<0.01),而PCR电泳组和荧光双扩组之间差异不显著。3) PCR电泳组、荧光单扩组和荧光双扩组胚胎的雌雄比分别为1∶1.02、1.03∶1和1∶1.03。4) 荧光单扩组的鉴定结果差胚胎的百分率极显著低于其他两组(P<0.01),而荧光双扩组和PCR电泳组之间差异不显著。5) 3组间的性别鉴定无反应率差异极显著,PCR电泳组最高,荧光单扩组最低(P<0.01)。6) 3组间的性别鉴定效率差异极显著,荧光单扩组最高,PCR电泳组最低(P<0.01)。

表3 不同方法的胚胎性别鉴定效果差异性分析Table 3 Analysis on the difference of embryo sex identification results by different methods
2.2 不同鉴定方法对雌性胚胎准确性的影响
本试验以进口YCD试剂盒PCR鉴定方法为对照组,荧光单扩和荧光双扩分别做试验组,对各组间的雌性胚胎母犊率(female calf rate of female embryos,FCRFE)进行比较。
如表4所示,通过对3种方法产母犊准确率的比较,荧光单扩组的产母犊准确率极显著低于荧光双扩组和对照组(P<0.01),荧光双扩组和对照组之间差异不显著(P>0.05)。综合表3、表4分析可知,荧光双扩方法是一种优于PCR电泳和荧光单扩的早期胚胎性别鉴定方法。

表4 不同方法之间雌性胚胎性别鉴定准确性比较Table 4 Comparison of sex identification accuracy for female embryos among different methods
2.3 取样细胞数量对荧光双扩方法性别鉴定效果的影响
为进一步优化荧光双扩鉴定方案,对不同胚胎取样数量的性别鉴定效果进行分析。如表5所示:1)SD组的雌性胚胎百分率显著高于4~6组(P<0.05),其他3组之间差异不显著。2)SD组的雄性胚胎百分率极显著低于4~6和7~10组(P<0.01),与1~3细胞组差异不显著;4~6组极显著高于1~3组(P<0.01),与7~10组之间差异不显著。3)1~3组、4~6组、7~10组和SD组胚胎的雌雄比为1.03∶ 1、1∶1.08、1∶1.08和1.09∶1。4)1~3组和SD组的鉴定结果差率极显著高于4~6组 和7~10组 (P<0.01),而1~3组和SD组之间及4~6组和7~10组之间差异不显著。5)SD组的性别鉴定无反应率极显著高于4~6组和7~10组(P<0.01),与1~3组差异不显著;1~3组显著高于7~10组(P<0.05),4~6组和7~10组之间差异不显著。6)4~6组 和7~10组的性别鉴定效率极显著高于1~3组和SD组(P<0.01),而1~3组和SD组之间及4~6组 和7~10组之间差异不显著。7)扩增CT值为扩增的循环次数,由试验结果可知,随胚胎细胞取样数增加CT值下降,组间差异极显著(P<0.01);SD组极显著高于4~6组和7~10组(P<0.01),而极显著低于1~3组(P<0.01)。
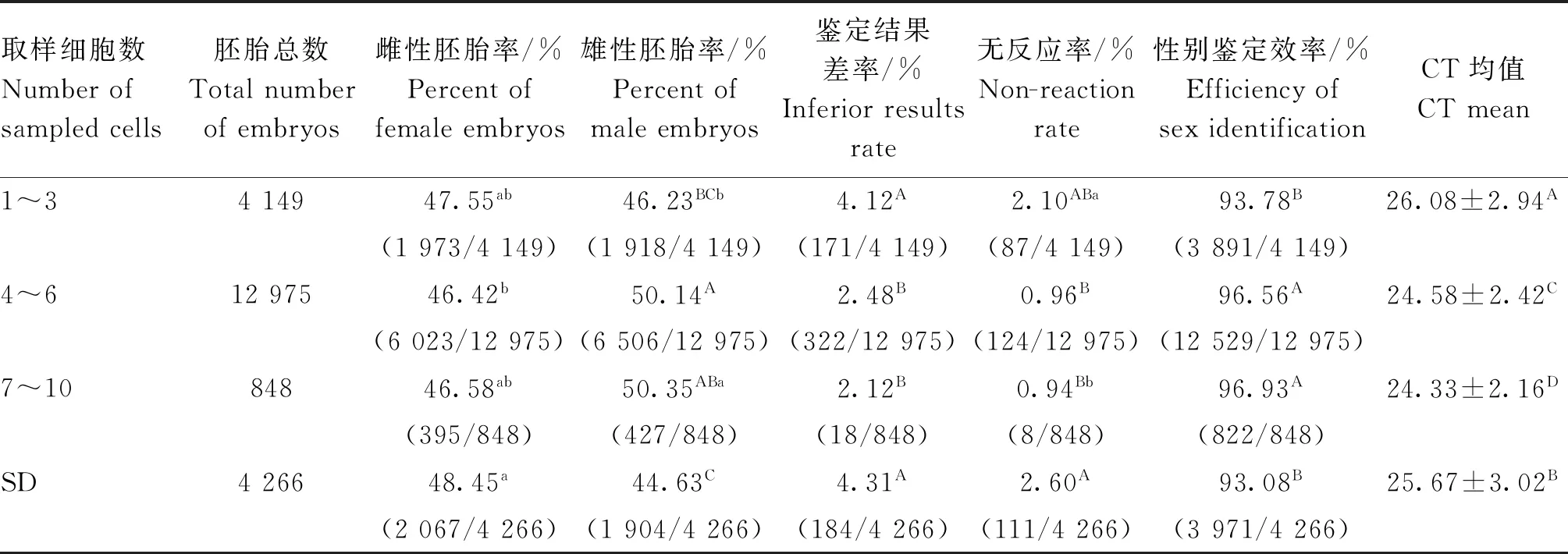
表5 取样细胞数量对荧光双扩方法性别鉴定效果的分析Table 5 Analysis of the effect of the number of cells sampled on the detection of fluorescence multiplex method
2.4 取样细胞数量对胚胎移植妊娠率的影响
为分析取样操作对胚胎移植妊娠率(pregnancy rate of embryo transfer,P/ET)的影响,对分割取样前质量为1级的胚胎进行统计分析。如表6所示,随取样细胞数增加,妊娠率有下降趋势,但统计无显著差异(P>0.05),综合分析表5、表6可知,虽然取样1~3个细胞也能获知胚胎性别,但综合考虑性别鉴定效率和移植妊娠率,最佳取样细胞数量为4~6个。

表6 不同取样细胞数量对胚胎移植妊娠率的影响Table 6 The influence of the number of sampled cells on the pregnant rate of embryo transfer
2.5 试验成本分析比较
为了更加精确地核算胚胎鉴定成本,如表7所示,以鉴定200枚胚胎为例,将PCR电泳法和荧光定量PCR法鉴定成本进行计算,进而分别算出单枚胚胎鉴定费用,结果表明,荧光定量PCR法比PCR电泳法成本降低了46.76%。
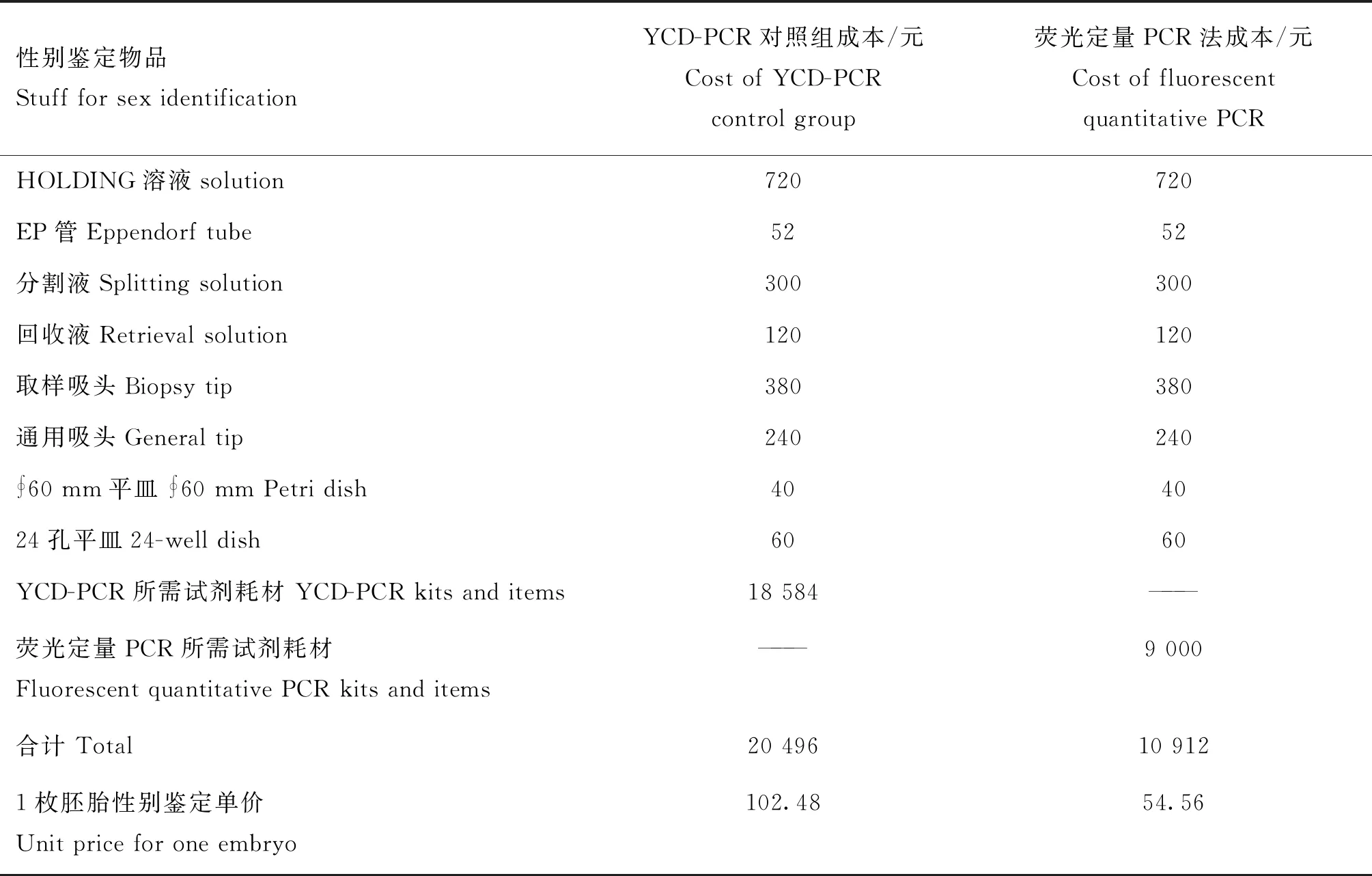
表7 不同性别鉴定方法成本比较(以每批鉴定200枚计算)Table 7 Comparison of the cost using different sex identification methods (at 200 embryos per batch)
3 讨 论
畜牧业的发展促进了性别控制方法在实践中的应用,以提高经济效益,加快动物的育种进程。性控技术结合超数排卵和胚胎移植技术用于奶牛生产中具有重大的实践意义[11]。性别控制可以通过精子分离或早期胚胎性别鉴别来实现[12]。目前,性别分离后的精液每支细管约有90%的X-精子[13],集中用于牛的人工授精和体外受精(IVF)程序,当用于FSH超排处理的供体母牛其体内胚胎生产量低于常规精液[14],用于牛胚胎体外生产其受精卵卵裂率、囊胚发育率以及移植妊娠率显著低于常规精液,从而限制了该技术的进一步推广[15-16]。相反,用PCR法进行胚胎性别鉴定能克服用性控精液生产体内或体外胚胎的一些局限性,是一个可供选择的方法[14]。
PCR方法之所以在牛胚胎性别鉴定中较常用是基于特别序列的扩增,其操作简便,用时较短,但PCR扩增结果受很多因素的影响,需要较多的胚胎细胞才能得到准确的鉴定结果,特别是在胚胎性别鉴定取样细胞数较少的情况下,有时在紫外透射分析仪下根本看不到扩增产物的电泳带[17]。污染也可能来自于由分解DNA的裂解细菌产生的核酸酶。但是,在适当的条件下操作样品,并在每次分析之间仔细冲洗,可以很容易避免这种情况[7]。
1990 年,Sinclair等[18]发现,决定雄性的是Y染色体短臂上的一个微小片段,称为Y染色体性别决定基因—SRY基因,是启动睾丸形成的主基因,即SRY基因是哺乳动物性别决定的开关。如果没有SRY基因的存在,性腺原基发育为卵巢;如果有SRY基因存在,性腺原基则发育为睾丸[19]。研究表明,SOX9基因在哺乳动物生殖活动中发挥着重要的调控作用,与性别分化、精子发生等生殖活动密切相关[20]。此外,DMRT1[21]、SOX9[22-23]、SF1[24]、WT1[25]、LIM1[26]、LHX9[27]、Gadd45G[28]和FOXL2[29]等基因对动物性别的决定和性器官的分化起着重要作用。1995年,Daneau等[30]报道了牛SRY基因的序列,对牛的SRY基因序列进行分析表明,牛SRY基因无内含子,其间是一个可读框(ORF),由687个碱基组成,编码229个氨基酸,启动子序列含有特异的CAAT-box和TATA-box结构。各种哺乳动物的Y染色体上均存在SRY基因,它们具有较高的同源性和高度的保守性[31]。因此,SRY基因可以作为性别鉴定的主要目标基因[32]。
本研究以SRY基因作为性别鉴定目标基因,以进口YCD-PCR试剂盒的性别鉴定结果作为对照组,以荧光双扩和荧光单扩作为试验组,通过对性别鉴定效率、无反应率、雌雄胚胎比、雌性胚胎产犊准确率等指标的综合比较,结果表明,荧光双扩组的雌性胚胎率、雄性胚胎率和雌性胚胎产母犊率均与对照组无显著差异,无反应率极显著低于对照组,而性别鉴定效率极显著高于对照组,其雌雄胚胎比也与对照组相似(1∶1.03和1∶1.02),更接近常规冻精人工授精的母犊公犊比(1∶1.05)[33]。尽管荧光单扩组的雌性胚胎百分率和性别鉴定效率极显著高于其他两组,雄性胚胎率、无反应率极显著低于其他两组,但其雌雄胚胎比值与常规冻精人工授精有较大偏差(1.03∶1vs1∶1.05)[34],产母犊准确率极显著低于荧光双扩组和对照组。以上分析表明,荧光双扩方法是一种更可行的牛胚胎性别鉴定技术。
PCR技术需要对植入前胚胎的卵裂球活检以进行性别鉴定[5]。从牛胚胎中取出一个或多个细胞是用DNA扩增法进行胚胎性别鉴定所必需的。活检会降低胚胎存活率和胚胎移植妊娠率[33]。但是也有文献表明,只要不断加强技术人员的操作水平,就不会对胚胎存活率造成明显影响[35]。
尽管在20世纪80年代后期的第一次研究涉及8~10个细胞,现在大多数用于性别鉴定的样本有4~5个 细胞,足以达到理想的灵敏度[6]。Park等[4]用8、4、2、1个卵裂球进行连续多重PCR胚胎性别鉴定的效率分别为100.0%、96.3%、94.3%和92.1%。Tavares等[14]从1 847个胚胎的活检中获得了95.9%的平均胚胎有效性别确定率,与其他关于家畜胚胎性别鉴定的研究一致。本研究用7~10、4~6、1~3个卵裂球进行荧光双扩PCR胚胎性别鉴定的鉴定效率分别达到96.93%、96.56%、93.78%,与以上研究一致。
PCR法对于应用是有效的,即使活检胚胎经过冷冻保存,其妊娠率也与非活检的胚胎相当[14]。胚胎移植行业最常采用的方法是用乙二醇冷冻牛胚胎,解冻后直接移植[36]。Thibier和Nibart[6]在其移植的833例性别鉴定冷冻胚胎中,60~90 d孕检的移植妊娠率为45.3%。Shea[3]报道,性别鉴定鲜胚的妊娠率(58%~71%)与常规鲜胚相当,而冷冻/解冻后的性别鉴定胚胎妊娠率较低(37%~66%),但足以商业化应用。本研究对5 849枚取样后胚胎进行程序化冷冻,解冻后移植,60 d孕检,取样4~6细胞的胚胎移植妊娠率为49.68%,平均移植妊娠率为48.74%,达到商业化应用水平。
一些研究所用的牛Y染色体特异性DNA探针鉴定成本为13美元[6],Tavares等[14]在2015年用PCR和电泳方法平均成本接近每样本2美元。本研究用进口YCD-PCR试剂盒鉴定1枚胚胎成本约为14.64美元,而荧光双扩方法鉴定成本为7.79美元,鉴定成本降低了46.76%,更加有利于性别鉴定胚胎的推广应用。
4 结 论
本研究建立了一种新型的牛早期胚胎性别鉴定方法,其荧光双引物混合扩增方法产母犊准确率高,鉴定成本低,取样4~6细胞的胚胎移植妊娠率最高,适于商业化应用,是一种更可行的牛胚胎性别鉴定技术,更有利于产业化推广和应用。
