流动分析仪同时快速测定植物全氮、全磷含量的方法改进
2021-05-28李朝英
李朝英,郑 路,2*
(1.中国林业科学研究院热带林业实验中心,广西 凭祥 532600;2.广西友谊关森林生态系统国家定位观测研究站,广西 凭祥 532600)
氮、磷是植物生长所需的大量元素,直接影响植物的生长发育,同时还参与植物体内许多重要化合物的合成与代谢。准确测定植物氮含量和磷含量对于植物营养诊断,合理施肥有着重要意义[1-3]。植物全氮、全磷消解的经典方法是硫酸-高氯酸消解法、硫酸-双氧水消解法等。硫酸-双氧水消解法不使用易爆的高氯酸,一次消解液可同时测定全氮、全磷、全钾含量,操作安全高效,在相关研究中应用较多[4-6]。植物全氮和全磷含量测定的传统方法分别是扩散法、半微量凯式法和钼锑抗比色法等。传统方法操作繁琐,易存在人为误差,检测效率低,难以满足批量样品检测分析的需求。流动分析仪是近年来迅速发展起来的一种新型检测分析仪器,因具有自动化程度高,操作简单,检测准确高效等优点而得到农林业、环境保护等多领域的关注。张英利等[7-8]先后提出了流动分析仪测定硫酸-双氧水消解植物全氮和全磷的方法,加标回收率在98.5%~100.5%之间,相对标准偏差小于2%,精密度与准确性较高。黄莹等[9]使用流动分析仪同时测定硫酸-双氧水消解甘蔗植株的全氮和全磷,回收率在93%~110%之间,相对标准偏差小于2%;贝美容等[10]采用流动分析仪同时测定硫酸-双氧水消解橡胶全氮、全磷、全钾的方法,回收率在99%~102%之间,相对标准偏差小于2%。流动分析仪同时检测全氮、全磷等多个项目的做法与以往的逐项检测相比,明显提高了检测效率,成效显著。但是由于大多数植物全氮、全磷含量较高,定容50 mL消解液的全氮、全磷含量仍可达200、35 mg/L,而流动分析仪测定全氮、全磷含量的量程范围为0~30 mg/L。有研究者在测定植物全氮、全磷含量时,将消解液稀释定容250 mL或将消解液定容50~100 mL后,根据样品全氮、全磷含量的预判情况再次稀释,以降低消解液全氮、全磷含量[6-9]。消解液定容250 mL或多次稀释的操作繁琐,纯水耗用量大,成本增加。消解液定容器皿体积偏大,占用空间大,操作不便。而多次稀释中全氮、全磷含量预判及稀释倍数确定增加检测人员工作量及难度。即使利用流动分析仪检测,一个样品的稀释及定容约需50 s,批量植物消解液的稀释定容也需花费一定量的时间及人工,且易出现人为差错,影响批量样品的高效检测。
流动分析仪测定全氮、全磷的原理分别基于Bertfelot反应和磷钼蓝反应。Bertfelot反应是水杨酸钠、次氯酸与铵根离子在碱性条件下反应生成蓝色络合物,比色测定全氮含量。磷钼蓝反应则是在一定酸度和锑离子存在条件下,磷酸根与钼酸铵形成的锑磷钼混合杂多酸被抗坏血酸还原为磷钼蓝,比色测定全磷含量[4-5]。流动分析仪经设置后,即可自动向全氮、全磷测定的两个通道分别注入相应试剂及消解液,使全氮、全磷显色液酸碱度分别满足相应反应要求,保证准确高效地检测分析。传统方法中,测定全磷的钼锑抗比色法原理与流动分析仪的一致,但测定全氮的扩散法和蒸馏法利用高浓度氢氧化钠碱化消解液,蒸馏出的氨经硼酸吸收,用标准酸滴定得出全氮含量,其检测原理与流动分析仪不同。此外,传统方法均为人工检测,抽样、加试剂、酸碱度调整及检测等均由人工完成。目前,流动分析仪测定全氮、全磷含量方法与传统方法的比较讨论较少,所测结果可比性尚不清楚。
为了准确高效地利用流动分析仪同时快速测定植物全氮、全磷含量,有必要对现有方法进一步优化改进,使方法适用于全氮、全磷含量高低不同的植物样品,减少消解液稀释的人工操作,避免人为差错,提高检测效率及准确性。为此,本实验以硫酸-双氧水消解全氮、全磷含量高低不同的植物,对流动分析仪同时测定植物全氮、全磷含量的方法进行改进,分析讨论改进方法与扩散法、钼锑抗比色法测定结果的相关性与差异性,探讨流动分析仪同时测定植物全氮、全磷含量改进方法的可行性,为实验室准确高效、经济、快捷地检测植物全氮、全磷含量提供可行的参考与指导,从而满足批量植物检测分析的现实需求。
1 材料与方法
1.1 仪器
电子分析天平(万分之一);AA3流动分析仪(配置MT7模块,AACE操作软件);烘箱;石墨炉。
1.2 样品
2018年12月于广西友谊关森林生态系统国家定位观测研究站设置在青山实验场的人工林样地采集多年生降香黄檀(Dalberqia odoriferaT. Chen)叶1份、多年生格木(Erythrophleum fordiiOliv.)叶2份、多年生红椎(Castanopsis hystrixA.DC.)叶和枝各11份,多年生马尾松(Pinus massonianaLamb.)叶24份。共49个样,依次编号1~49。植物烘干后粉碎,过孔径0.5 mm筛的植物颗粒在60℃烘箱烘干至恒重,放于干燥器冷却备用。
1.3 实验方法
1.3.1 植物样品消解
称取0.0500 g样品放入50 mL三角瓶中,加3 mL硫酸,放于石墨加热板消解样品至酱油状,三角瓶取下稍冷,逐滴加入双氧水,至消解液变为澄清状,继续加热30 min,取下冷却。用水将消解液洗入50 mL比色管中,定容,摇匀备用。样2、样3、样14各制备4个平行消解液。以上植物全氮含量在5~40 g/kg之间,消解液中全氮含量5~40 mg/L之间,全磷含量在0.05~6.10 g/kg之间,消解液中全磷含量在0.05~6.10 mg/L之间,空白不加植物样品,同上操作。
1.3.2 流动分析仪法
1.3.2.1 试剂 进样清洗液:25 mL硫酸溶于水,定容至1 L;全磷测定用盐溶液:5 g氯化钠溶解于适量水中,定容至1 L;SDS水:0.5 g十二烷基硫酸钠(SDS)溶解于适量水中,定容至250 mL;钼酸铵溶液:6.2 g钼酸铵,0.17 g酒石酸锑钾,25 mL硫酸溶于水,定容至1 L;抗坏血酸溶液:1.5 g抗坏血酸溶于100 mL水中;全氮测定用缓冲液:35.8 g磷酸氢二钠,19 g氢氧化钠,50 g酒石酸钾钠,1.5 mL Brij35溶解于适量水中,定容至1 L;水杨酸钠溶液:8 g水杨酸钠、0.2 g硝普钠溶解于适量水中,定容至200 mL;次氯酸钠溶液:10%次氯酸钠溶液2 mL,定容至100 mL;水:1.5 mL Brij35溶解,定容至1 L。以上试剂中SDS为电泳级,其他均为分析纯级。
1.3.2.2 仪器条件 流速50个样/h,样品对冲时间2 s,进样时间48 s,清洗时间24 s,仪器默认设置基线和漂移校正,自动基线参比为5%,全氮和全磷两通道的比色滤光片波长均为660 nm。全氮进样选择高浓度进样,泵管管速为0.23 mL/min;全磷进样选择低浓度进样,泵管管速为0.23 mL/min。
1.3.2.3 AA3流动分析仪-MT7模块管路 由图1可见,通道1的10个管路所对应的试剂溶液依次为进样清洗液、空气、SDS水、SDS水、空气、盐溶液、进样管、SDS水、钼酸铵溶液、抗坏血酸溶液。通道2的10个管路所对应的试剂溶液依次为清洗液、空气、缓冲液、进样管、空气、缓冲液、水、水杨酸钠、次氯酸钠、水。
1.3.2.4 标准曲线建立 抽取100 mg/L磷标准液0.00、0.25、0.50、0.75、1.00、1.50 mL分 别 放 于25 mL容量瓶中,同时抽取1000 mg/L氮标准液0.00、0.30、0.40、0.50、0.75、1.00 mL放 入 上 述25 mL容量瓶中,用1.3.1中的消解空白液定容,摇匀,配制磷、氮混标。混标中磷浓度为0、1、2、3、4、6 mg/L,氮 浓度 为0、12、16、20、30、40 mg/L。按流动分析仪上述检测条件进行测定,建立全磷的标准曲线:y=0.9997x+0.0006(r2=0.9999),全氮的标准曲线:y=0.9993x+0.0129(r2=0.9997)。
1.3.3 传统方法
1.3.3.1 试剂 甲基红-溴甲酚绿混合指示剂:称取0.099 g溴甲酚绿、0.066 g甲基红,溶解于100 mL乙醇中;硼酸-指示剂混合溶液:10 g硼酸溶于1 L水中,加入20 mL甲基红-溴甲酚绿混合指示剂,用稀酸或稀碱将溶液pH调节至4.5;0.01 mol/L盐酸溶液:准确抽取8.4 mL浓盐酸,加水定容至100 mL,配制1 mol/L盐酸溶液,抽取1 mol/L盐酸溶液10 mL,定容至1 L,即得0.01 mol/L盐酸溶液;钼锑抗显色剂:153 mL浓硫酸缓慢倒入400 mL水中,搅拌冷却,取10 g钼酸铵溶于300 mL水中,将配制的硫酸溶液缓缓加入配制的钼酸铵溶液中。称取0.5 g酒石酸锑钾溶解于100 mL水中后,将其加入钼酸铵溶液中,定容至1 L,即得钼锑抗贮存液。取100 mL钼锑抗贮存液,加入1.5 g抗坏血酸,搅拌溶解即得钼锑抗显色剂;2 g/L的2,4-二硝基酚:称取2 g的2,4-二硝基酚溶解于100 mL乙醇中;2 mol/L氢氧化钠:称取80 g氢氧化钠溶解于少量水中,定容至1 L;98%浓硫酸;丙三醇。以上试剂均为分析纯级。
1.3.3.2 扩散法 扩散皿内室中加入2.5 mL硼酸-指示剂溶液,在扩散皿沿及皿盖塞均匀涂抹丙三醇,抽取消解液5 mL,加入扩散皿外室一侧,在外室另一侧加入10 mL的10 mol/L氢氧化钠溶液,立即用皿盖塞密封皿口,转动皿盖,排出皿盖塞与皿沿间的空气,以达到良好密封的效果。左右轻旋扩散皿,使外室的消解液与氢氧化钠混合均匀。扩散皿放于40℃恒温箱中保温24 h,取出后,以0.01 mol/L的盐酸溶液滴定至内室指示剂变至紫红色,由滴定体积计算样品氮含量。空白同上操作[11]。
1.3.3.3 钼锑抗比色法 抽取10 mg/L的磷标液0.00、0.25、0.50、1.00、1.50 mL,加1~2滴2,4-二 硝基酚,加2 mol/L氢氧化钠将溶液调至淡黄色,加入2.5 mL钼锑抗显色剂,定容摇匀,放置40 min,于波长700 nm处比色检测,建立磷标准曲线。y=1.9001x-0.00961(r2=0.9991)。抽取5 mL待测液于25 mL比色管,同上操作,于波长700 nm处比色检测。
1.3.4 流动分析仪的精密度与准确性检验
1.3.4.1 重复性实验 测定样2、样3、样14平行消解液的全氮和全磷。测量值xi的算术平均值为样品全氮的估计值,标准偏差(SD)用贝塞尔公式计算,相对标准偏差(RSD %)=标准偏差(SD)/计算结果算术平均值()×100
1.3.4.2 方法回收率实验 植物样2、14分别称0.0500 g,抽取1000 mg/L铵标0.5 mL,100 mg/L磷标0.5 mL,分别加入两个样中,按1.3.1操作重复上述实验3次,计算回收率。即:
回收率(%)=(加标后测定值-本底值)/加标量×100
1.4 数据分析
本实验数据采用Excel 2003软件进行数据统计、绘图,进行t检验-成对双样本均值分析,对传统方法与流动分析仪测定的全氮、全磷含量进行差异显著性分析。利用直线方程进行回归分析,分析传统方法与流动分析仪测定的全氮、全磷含量的相关性及显著性。
2 结果与分析
2.1 传统方法与流动分析仪法所测全氮、全磷的比较
本实验选择49个植物样品的全氮含量在5~40 g/kg,全磷含量在0.05~6.05 g/kg。由表1可见,扩散法与流动分析仪所测氮含量平均值分别为14.09和13.88 g/kg,经t检验,P(T≤t)双尾=0.29,说明以上植物样品使用两种方法所测全氮含量差异不显著。钼锑抗比色法与流动分析仪所测磷含量平均值分别为0.80和0.77 g/kg,经t检验,P(T≤t)双尾=0.18,说明以上植物样品使用两种方法所测全磷含量差异不显著。
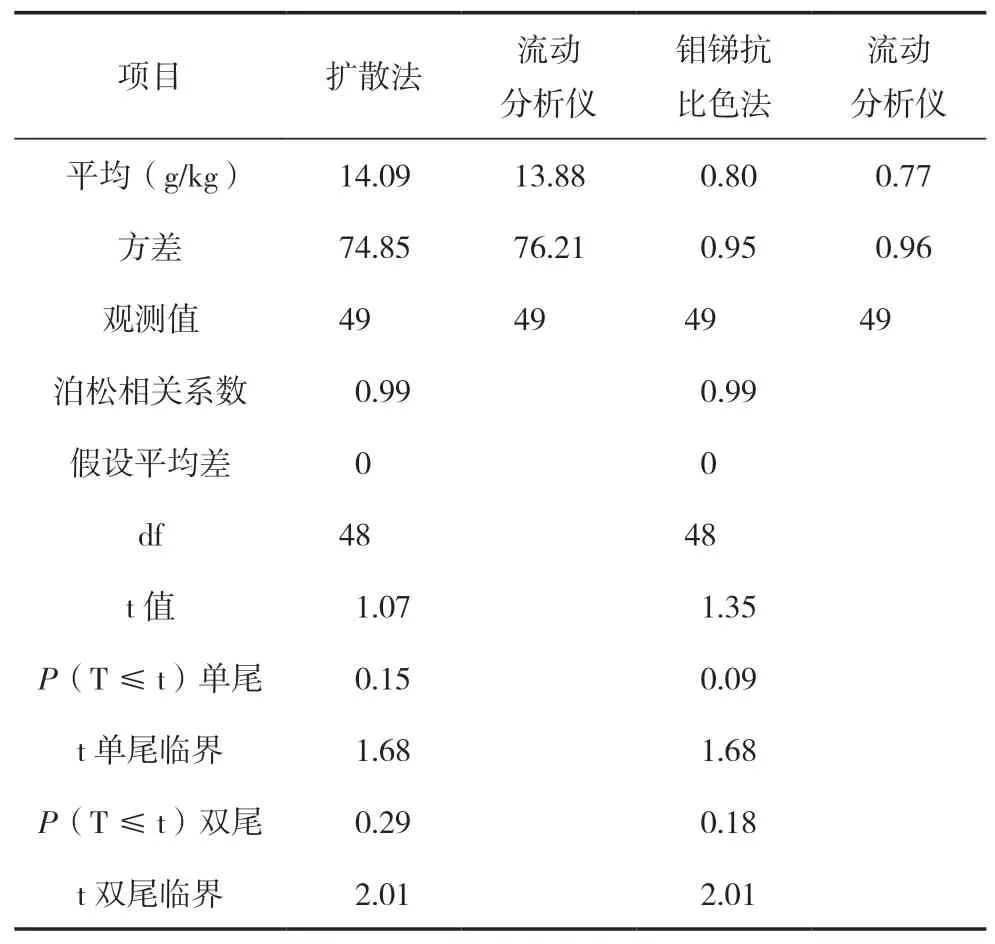
表1 传统方法与流动分析仪测定植物全氮、全磷含量的t检验(成对双样本均值分析)
2.2 传统方法与流动分析仪所测全氮、全磷的相关性
由图2可见,扩散法与流动分析仪测定全氮含量回归方程Y=0.978X+0.502(r2=0.9755),两种方法所测全氮呈极显著性相关(P<0.01)。钼锑抗比色法与流动分析仪测定全磷含量回归方程Y=0.985X+0.035(r2=0.9835),两 种 方 法 所测全磷呈极显著性相关(P<0.01)。两个回归方程的斜率分别为0.978、0.985,均趋近于1,说明流动分析仪与传统方法所测全氮、全磷含量一致。

图2 传统方法与流动分析仪测定植物全氮、全磷含量的相关性
2.3 流动分析仪测定全氮和全磷的准确性与精密度检验
采用标准加入法进行方法回收率检验。2个样品的磷加标量为1 mg/L,氮加标量为10 mg/L,其消解液使用流动分析仪重复测定3次。由表2可见,流动分析仪测定全磷的平均回收率为98.67%~99.11%,全氮的平均回收率为98.23%~100.68%。说明流动分析仪同时测定全氮、全磷的准确性较高。
由表3可得,在相同检测条件下,选择3个植物的全磷含量在0.53~6.01 mg/L之间,全氮含量在11.86~38.21 mg/L之间。流动分析仪同时对以上3个植物的全氮、全磷含量重复测定4次,全磷含量的相对标准偏差为0.65%~5.50%,全氮含量的相对标准偏差为0.99%~3.51%。可见,流动分析仪同时测定全氮、全磷含量的精密度良好,测定结果稳定。

表2 流动分析仪测定植物全氮、全磷的加标回收率实验

表3 流动分析仪测定植物全氮、全磷的重复性实验
3 讨论
本实验植物样品全氮含量在5~40 g/kg之间,全磷含量在0.5~6.05 g/kg之间,全氮和全磷含量高低不一,有一定代表性。本实验提出的流动分析仪同时测定植物全氮、全磷含量方法的精密度及准确性良好,测定结果与传统方法无显著性差异,有良好的相关性,与传统方法所测全氮、全磷含量有一定可比性。本实验对现有检测方法提出改进,进一步减少了人员工作量及试剂用量,操作简捷高效,准确经济。
由于大多数植物全氮、全磷含量较高,流动分析仪测定全氮、全磷含量的量程范围在0~30 mg/L之间。为了使用流动分析仪测定植物全氮、全磷含量,现期研究多是对消解液进行高倍或多次稀释,定容体积多在100 mL以上,以降低待测消解液全氮、全磷含量。但此做法操作繁琐,增加纯水耗用量,费工费时,且因大量的人工操作易产生差错,不利于准确高效地检测分析。本实验不同于上述做法,而是将现有研究中植物常规称量的0.2500 g调减为0.0500 g,消解液一次定容50 mL,全氮高达200 mg/L的豆科等植物消解液氮含量可控制在40 mg/L及其以下,全磷高含量植物的消解液磷含量则降至6 mg/L左右。其次是将现有研究测定全氮含量常用的管速0.32 mL/min进样管更换为管速0.23 mL/min的进样管,消解液进样量减少了30%,测定全氮含量40 mg/L的样品准确稳定,说明仪器量程扩展。张丽萍等[12]使用管速0.23 mL/min的进样管测定植物全氮含量,检测范围扩展在0~50 mg/L之间,与本实验结果一致。本实验消解液全磷含量降至6 mg/L左右,直接以0.23 mL/min进样管测定,与现有研究所述一致。通常情况下,一个消解液的稀释定容包括取放容器和消解液,加水稀释,准确定容及摇匀等一系列操作,全过程约用50 s。300个消解液的一次稀释定容约需4.1 h,二次稀释定容共需用8.2 h。本实验提出的方法为一次稀释定容至50 mL,定容体积小,操作简捷,纯水用量少,消解液稀释定容人工操作明显减少,由此避免了不必要的人工差错,提高了检测分析速度,降低了检测成本。同时本实验方法适用于氮含量和磷含量高低不一的植物样品,确保流动分析仪同时测定植物全氮、全磷含量准确快速。可见,本实验提出的方法具有一定应用优势。
Bertfelot反应的适宜pH为12.8~13.3,磷钼蓝反应的适宜显色酸度为0.35~0.55 mol/L[4,13]。现期利用流动分析仪同时测定全氮、全磷含量的研究中,测定全氮用缓冲液的氢氧化钠浓度为22~32 g/L,测定全磷用钼酸铵溶液中的硫酸体积是总溶液体积的6.6%~7.1%[7,9-10,14]。本实验所用缓冲液中氢氧化钠浓度为19 g/L,每升钼酸铵溶液中硫酸体积是总溶液体积的2.5%。本实验碱化和酸化显色液所用氢氧化钠和硫酸量均少于现期研究。这主要因为本实验植物消解液稀释定容体积小,消解液保持了一定的酸度,测定全氮采用管速0.23 mL/min的进样管,减少进样量,碱化全氮显色液所需的氢氧化钠量随之减少;而消解液本身的酸度使得钼酸铵溶液中硫酸量无需过高即可满足全磷含量检测要求。现有研究对消解液进行高倍或多次稀释,消解液酸度下降较多,进样管管速高,进样量大,碱化全氮显色液所需的氢氧化钠量及酸化全磷显色液所需的硫酸量均多于本实验。Bertfelot反应和磷钼蓝反应的显色酸碱要求截然不同,本实验以较少的酸碱量同时满足了两种反应的显色要求,说明本实验提出的同时测定全氮、全磷含量的方法有利于节约试剂,降低成本,减少污染,且检测准确高效,优于现期研究。
与传统方法相比较,本实验提出的同时测定植物全氮、全磷含量的方法测定100个植物全氮、全磷含量所用试剂量均小于250 mL,传统方法所用高浓度氢氧化钠达到1000 mL,其他试剂用量均在250 mL左右,所以流动分析仪的试剂量明显少于传统方法。此外,传统方法测定植物全氮、全磷含量需要逐项检测,人员工作强度大,完成100个植物全氮、全磷含量至少需要3个工作日,效率低,且人为误差难以避免;流动分析仪同时测定100个植物全氮、全磷含量共需6 h,检测效率是传统方法的4倍,流动分析仪代替人工完成了抽样、比色检测、编辑数据报告等工作,人员工作强度小,检测高效经济。
4 结论
本实验对流动分析仪同时测定植物全氮、全磷含量的方法进行了改进,避免了消解液的大量稀释定容操作,检测简捷高效,经济准确,适用植物样品广泛。流动分析仪测定植物全氮含量的回收率为98.23%~100.68%,相对标准偏差为0.99%~3.51%。测定植物全磷含量的回收率为98.67%~99.11%,相对标准偏差为0.65%~5.50%。该方法精密度及准确性良好,所测全氮、全磷含量与扩散法和钼锑抗比色法无显著性差异,且呈显著性相关。本实验提出的改进方法适用于批量植物全氮、全磷含量的高效检测。
