本氏烟NbHSP90基因的克隆及初步功能分析
2021-05-28杨磊盛慧张金凤田辉张修国孙文秀
杨磊,盛慧,张金凤,田辉,张修国*,孙文秀*
本氏烟基因的克隆及初步功能分析
杨磊1,盛慧2,张金凤2,田辉2,张修国2*,孙文秀1*
1. 长江大学生命科学学院, 湖北 荆州 434025 2. 山东农业大学植物保护学院, 山东 泰安 271018
辣椒疫霉菌()通过与植物互作调节植物的免疫反应,进而引起植物感病。前期实验证明辣椒疫霉效应分子RxLR19781与本氏烟()热激蛋白90(NbHSP90)可以发生相互作用。利用RT-PCR技术从本氏烟中克隆得到基因,通过农杆菌介导的瞬时表达技术,验证在辣椒疫霉侵染本氏烟过程中的作用。研究结果表明:基因的cDNA序列全长1005 bp,编码含334个氨基酸的蛋白质,不含信号肽,无跨膜结构,具有典型的HATPase保守结构域和C端基序MEEVD。瞬时表达结果表明,能显著减弱辣椒疫霉在本氏烟中的定殖。研究结果为进一步阐明辣椒疫霉效应分子RxLR19781靶向本氏烟HSP90促进自身侵染的分子机制提供了依据。
辣椒疫霉菌;本氏烟;基因克隆
疫霉菌属于卵菌,是危害大豆、番茄、辣椒等经济作物的毁灭性病原菌。在侵染寄主植物的过程中,通过分泌效应分子与寄主靶标蛋白互作,进而操控寄主的代谢反应与防御机制,以促进自身的侵染[1]。这些效应分子分为细胞质效应分子和质外体效应分子,其中细胞质效应分子中包含一类具有N端信号肽和RxLR(R:精氨酸; x:任意氨基酸; L:亮氨酸; R:精氨酸)保守基序的RxLR效应分子,可以靶向寄主不同亚细胞位置的正负调控因子,干扰其正常的生理过程,从而有利于病原物的侵染[2]。如辣椒疫霉()的RxLR效应分子PcAvr3a12通过靶向内质网脯氨酰顺反异构酶(PPIase)FKBP15-2,降低其PPIase的活性,从而抑制寄主内质网介导的免疫反应,促进辣椒疫霉的侵染[3]。大豆疫霉()的PsAvh240通过在质膜处阻止天冬氨酸蛋白酶GmAP1分泌到质外体中,导致寄主的抗性减弱[4]。芸薹疫霉()效应分子RxLR3可以与胞间连丝处的胼胝质合成酶CaIS互作来增强细胞间的电导率,减少胼胝质的积累,抑制寄主的防卫反应[5]。
热激蛋白90(Heat shock protein 90, HSP90)是一类在植物中广泛存在且高度保守的分子伴侣,通常以同源二聚体的形式存在[6]。HSP90存在于在植物细胞的细胞核、细胞质、叶绿体、线粒体和内质网,主要由N末端ATP结合结构域、中间域以及具有五肽MEEVD序列的C端二聚结构域3个结构域组成[7,8]。当植物受到自然环境中各种生物或非生物胁迫时,HSP90可以通过参与调节和维持植物细胞内多种蛋白质的构象与功能,从而防止细胞受损并维持植物的正常生长发育[9]。近年来,研究发现小麦或基因的沉默会导致小麦对小麦条锈病的抗性减弱[10]。大豆转基因拟南芥可以减少应对非生物胁迫时受到的细胞损伤,并维持拟南芥的正常生长发育[11]。拟南芥胞质HSP90被报道参与了免疫受体NLR复合物的组装、稳定性控制与激活,还参与调节适当水平的免疫受体蛋白以避免自身免疫[12]。尽管HSP90是植物免疫不可或缺的组成部分,但是目前对疫霉菌靶标植物HSP90的致病机制仍少有报道。
实验室前期利用酵母双杂交、免疫共沉淀和双分子荧光等技术已证明辣椒疫霉效应分子RxLR19781可以与本氏烟热激蛋白90(NbHSP90)发生相互作用。本研究从本氏烟中克隆得到基因,利用生物信息学技术分析其序列特征,并通过农杆菌介导的瞬时表达技术在本氏烟中过表达NbHSP90,再进行致病性接种测定,研究结果为验证NbHSP90的功能以及RxLR19781在辣椒疫霉致病过程的分子机制提供实验依据。
1 材料与方法
1.1 材料与试剂
大肠杆菌感受态DH5α、农杆菌感受态GV3101购自北京全式金生物技术有限公司,植物表达载体pBIN-GFP2由南京农业大学植物保护学院窦道龙教授惠赠。试验菌株辣椒疫霉菌LT1534及空载GFP农杆菌保存于山东农业大学植物保护学院真菌资源与利用研究室,
试验植株本氏烟()种植于本实验室25 ℃恒温温室,交替于光照16 h,黑暗8 h下培养。
1.2 RNA提取与cDNA合成
收取3-4周龄的本氏烟叶片,按照OMEGA公司的Total RNA Kit I试剂盒说明书提取本氏烟的总RNA,紫外分光光度计检测所提总RNA的质量。若样品OD260/OD280值在1.8~2.0之间,则按照南京诺唯赞公司的HiScript®II Q RT SuperMix for qPCR (+gDNA wiper)反转录试剂盒说明书合成样品cDNA。
1.3 基因克隆与载体构建
在本氏烟基因组数据库(https://solgenomics.net/tools/blast/)中BLAST检索的基因序列。根据ClonExpress II One Step Cloning Kit试剂盒说明书设计特异性引物NbHSP90-F(5'-cctccatggggatccggtaccATGGCGGACACAGAAACCTTT-3')/NbHSP90-R(5'-tgtcttcgggacatgcccggg ATCGACTTCTTCCATCTTGCTGC-3'),以本氏烟cDNA为模板,扩增目的基因,利用限制性内切酶I及Ⅰ将目的载体pBIN-GFP2线性化,配制重组反应体系:线性化pBIN-GFP2载体1 μL,基因8 μL,5×CE II Buffer 4 μL,Exnase II 2 μL,ddH2O补足20 μL。37 ℃反应30 min。反应产物转化至大肠杆菌DH5α,阳性克隆测序正确后提取质粒即得重组表达载体 pBINGFP2:。
1.4 生物信息学分析
通过Pfam(http://pfam.sanger.ac.uk/search)和SMART(http://smart.embl-heidelberg.de/)确认蛋白质家族;使用ProtParam (https://web.expasy.org/protparam/)预测蛋白质的基本理化性质;利用SignalP4.0 (http://www.cbs.dtu.dk/services/SignalP-4.0/)预测信号肽;TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)用于预测跨膜结构。
1.6 基因瞬时表达与功能检测
将重组表达载体 pBINGFP2:通过冻融法转入农杆菌GV3101,挑单菌落接种于液体LB培养基(Rif,Kana 50 µg/µL)中,28 ℃振荡培养20 h,离心(3800 rpm,5 min)收集菌体,适量10 mM MgCl2洗涤菌体3次,重悬于缓冲液(10 mM MES, 10 mM MgCl2, and 200 mM AS)并调节OD600值至0.5左右。28 ℃静置培养3~4 h,在至少15片4~6周龄的本氏烟叶片两侧分别接种含pBINGFP2:NbHSP90或pBIN-GFP2的GV3101悬浮液,24 h后接种辣椒疫霉游动孢子,两天后紫外灯下记录叶片症状[13]。
1.7 Western blot分析
选取利用农杆菌分别瞬时表达NbHSP90和GFP的本氏烟叶片提取总蛋白,SDS-PAGE分离总蛋白,再利用湿转法将蛋白转至PVDF膜上,经一抗鼠Anti-GFP(1:3000)和兔抗鼠二抗(1:10000)依次孵育后,ECL显色检测蛋白的表达。具体步骤参考Huang等[14]。
1.8 DNA提取与q-PCR检测
在本氏烟叶片上瞬时表达NbHSP90和GFP后接种辣椒疫霉游动孢子,48 h后分别收取样品,利用CTAB法提取基因组DNA,具体方法参照Li等[15]。用本氏烟基因()和辣椒疫霉基因()设计q-PCR特异性引物(表1),以所提DNA为模板,本氏烟作为持家基因,依据ChamQ SYBR Color qPCR Master Mix (Low ROX Premixed)试剂盒说明书进行q-PCR检测。相对生物量通过来计算,具体操作参考Li等[16,17]
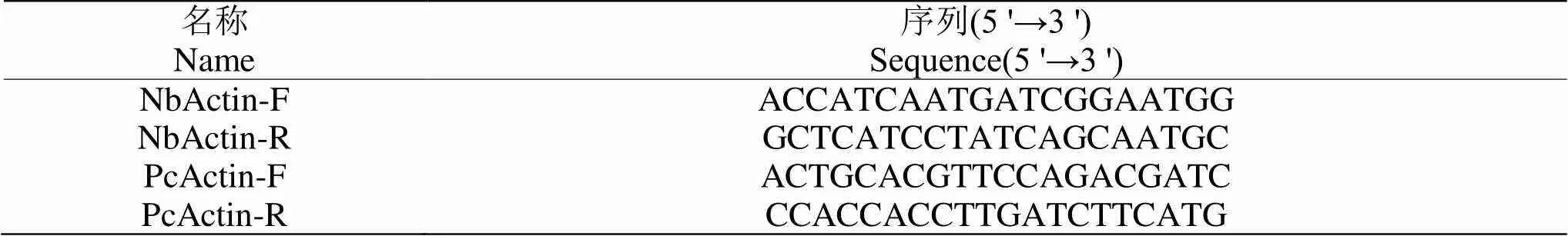
表 1 定量 PCR引物序列
2 结果与分析
2.1 本氏烟NbHSP90基因的克隆与分析
以本氏烟cDNA为模板,使用高保真聚合酶进行PCR扩增,对PCR产物进行凝胶电泳检测,目的条带大小与预期片段大小基本一致。经测序比对,NbHSP90的基因序列与数据库中的序列相符,结果表明,基因的全长cDNA序列为1005 bp,编码334个氨基酸。
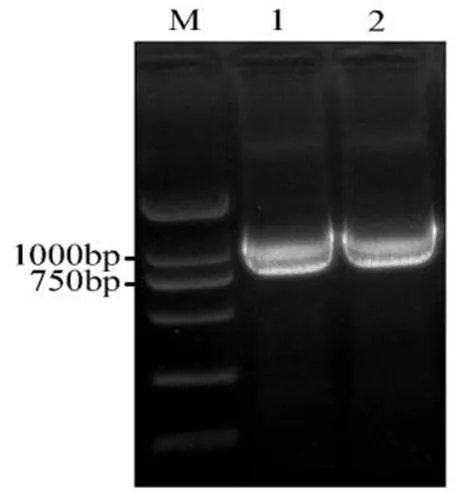
图 1 本氏烟NbHSP90基因的克隆
M: DL2000 Plus DNA Marker; 1, 2:
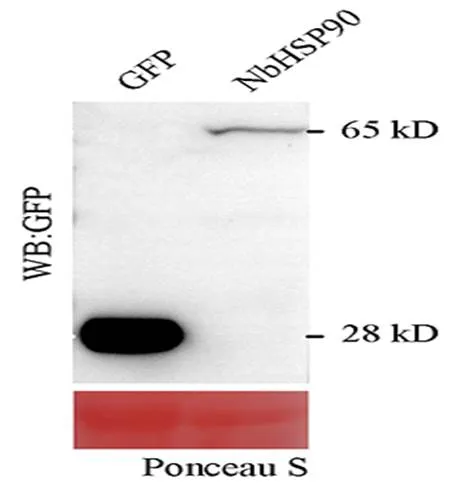
图2 本氏烟中NbHSP90的Western blot检测
通过在线生物信息学软件分析NbHSP90的氨基酸序列特征。由Pfam和SMART分析表明,NbHSP90属于HSP90蛋白家族,具有高度保守的N端ATPase结构域和C端MEEVD五肽序列。ProtParam预测显示,蛋白质的相对分子质量为37.385 kD,理论等电点为4.60。SignalP和TMHMM分析可知,NbHSP90蛋白不含信号肽,无跨膜区。
2.2 本氏烟中NbHSP90的表达检测
为了验证重组表达载体pBINGFP2:是否能在本氏烟中正确表达,通过Western blot技术检测了NbHSP90和GFP的表达情况。如图所示(图2),NbHSP90和GFP的蛋白大小与预期大小一致,结果表明,NbHSP90和GFP均能在本氏烟叶片中正确表达,可以用于下一步实验。
2.3 NbHSP90在辣椒疫霉侵染过程中的功能鉴定
利用农杆菌介导的瞬时表达技术,在本氏烟叶片两侧分别表达NbHSP90和GFP,并接种辣椒疫霉游动孢子,48 h后紫外灯下观察叶片感染情况,记录病斑直径并拍照。结果显示(图3),以GFP作为对照,本氏烟中接种NbHSP90处的病斑大小明显小于对照处,这说明NbHSP90能显著抑制辣椒疫霉的侵染,过表达NbHSP90增强了本氏烟对辣椒疫霉的抗性。
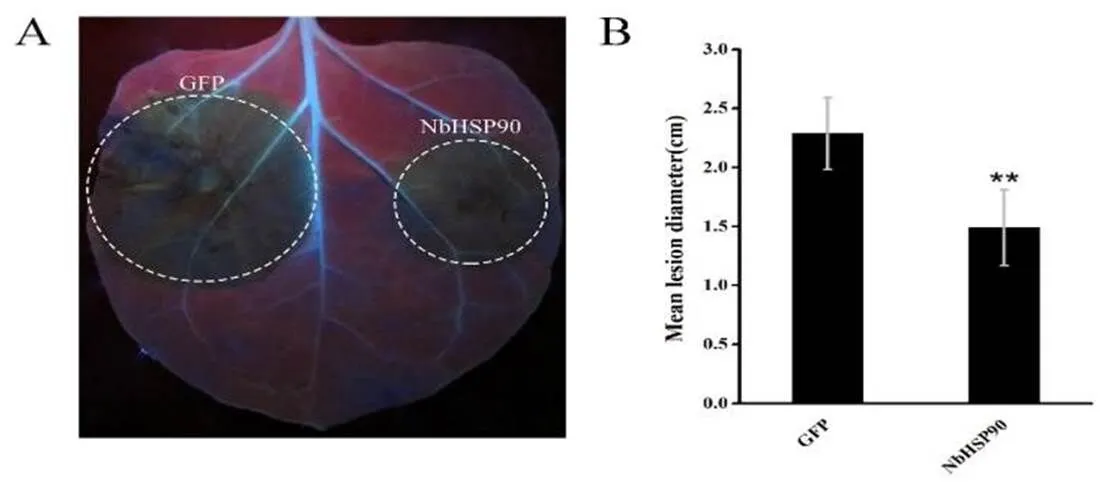
图 3 辣椒疫霉菌侵染过程中NbHSP90的功能分析
A: NbHSP90功能验证; B: 病斑直径统计; 误差线表示SD,<0.01
A: Function analysis of NbHSP90; B: Statistics analysis of lesion diameter; Error bars are SD,<0.01
2.4 辣椒疫霉菌生物量的检测
在感染辣椒疫霉的本氏烟叶片中,分别提取接种NbHSP90和GFP本氏烟叶片的基因组DNA,以接种GFP作为对照,通过q-PCR检测,以辣椒疫霉的基因和本氏烟的基因来定量分析感染植物组织的生物量。

图4 辣椒疫霉菌的定量分析
A: 溶解曲线; B: 辣椒疫霉的相对生物量; 误差线表示SD,<0.01
A: Real-time fluorescence quantitative standard curve; B: Relative biomass of; Error bars are SD,<0.01
结果如图所示(图4),相对于接种GFP处感染的生物量,辣椒疫霉在NbHSP90处的定殖显著减少。这表明NbHSP90在植物应对辣椒疫霉侵染的过程中充当免疫正调控因子。
3 讨 论
HSP90在ATP驱动下与真核细胞不同发育阶段的蛋白协同作用,促进细胞内的信号转导,蛋白质折叠和形态演变。其中能与HSP90发生相互作用的蛋白主要分为三种类型,包括辅助蛋白,调节因子以及底物蛋白[7]。辅助蛋白与调节因子通过调节HSP90与底物蛋白之间的相互作用产生不同的生理活性。近来越来越多的研究表明,HSP90在植物的生长发育,胁迫应答和病虫害免疫中起到关键性作用[8]。因此,深入探讨植物HSP90的功能有助于理解胁迫信号通路,发现关键胁迫相关基因,进一步为植物的遗传育种提供基因资源。
在植物与病原菌的协同进化过程中,HSP90通过介导植物免疫信号转导途径,参与先天免疫受体和蛋白激酶的活化与稳定,因而成为植物免疫的重要组成成分[18]。病原菌为克服宿主的防御反应,分泌大量的效应分子靶向免疫信号通路的正负调节因子,从而营造出有利于自身定殖的细胞内环境。丁香假单胞杆菌()的效应分子HopBF1可以使宿主的HSP90发生磷酸化,导致其N端ATPase活性失活,进而干扰免疫受体NB-LRR活化来抑制植物的免疫反应[19]。但在疫霉属卵菌中,有关效应分子直接靶向寄主HSP90以促进自身侵染的报道相对较少。因此验证NbHSP90在辣椒疫霉致病过程中的作用,有助于阐明辣椒疫霉效应分子RxLR19781靶向本氏烟NbHSP90的致病机制。
在本研究中,成功克隆得到能与辣椒疫霉RxLR19781发生互作的NbHSP90的cDNA序列,并通过生物信息学分析发现,NbHSP90是高度保守的HSP90蛋白家族成员,不含信号肽,无跨膜结构。利用农杆菌介导的瞬时表达技术,在本氏烟中成功瞬时过表达NbHSP90,并接种辣椒疫霉进行致病性分析,结果发现,NbHSP90能显著抑制辣椒疫霉在本氏烟中的定殖,这说明NbHSP90对于防御辣椒疫霉菌至关重要,在植物免疫过程充当正向调控因子。但对于辣椒疫霉效应分子RxLR19781如何靶向植物免疫正调控因子NbHSP90以促进自身侵染的分子机制还需进一步研究。
[1] Chen XR, Zhang Y, Li HY,. The RxLR effector PcAvh1 is required for full virulence of[J]. Mol Plant Microbe Interact, 2019,32(8):986-1000
[2] Naveed ZA, Wei X, Chen J,. The PTI to ETI continuum in-plant interactions [J]. Front Plant Sci, 2020,11:593905
[3] Fan G, Yang Y, Li T,. ARxLR effector targets and inhibits a plant PPIase to suppress endoplasmic reticulum-mediated immunity [J]. Mol Plant, 2018,11(8):1067-1083
[4] Guo B, Wang H, Yang B,.effector PsAvh240 inhibits host aspartic protease secretion to promote infection [J]. Mol Plant, 2019,12(4):552-564
[5] Tomczynska I, Stumpe M, Doan TG,. Aeffector protein promotes symplastic cell-to-cell trafficking by physical interaction with plasmodesmata-localised callose synthases [J]. New Phytol, 2020,227(5):1467-1478
[6] Krishna P, Gloor G. The Hsp90 family of proteins in[J]. Cell Stress Chaperones, 2001, 6(3):238-246
[7] 栗振义,龙瑞才,张铁军,等.植物热激蛋白研究进展[J].生物技术通报,2016,32(2):7-13
[8] Xu ZS, Li ZY, Chen Y,. Heat shock protein 90 in plants: molecular mechanisms and roles in stress responses [J]. Int J Mol Sci, 2012,13(12):15706-15723
[9] Li W, Chen Y, Ye M,. Evolutionary history of the heat shock protein 90 (Hsp90) family of 43 plants and characterization of Hsp90s in[J]. Mol Biol Rep, 2020,47(9):6679-6691
[10] Wang GF, Wei X, Fan R,. Molecular analysis of common wheat genes encoding three types of cytosolic heat shock protein 90 (Hsp90): functional involvement of cytosolic Hsp90s in the control of wheat seedling growth and disease resistance [J]. New Phytol, 2011,191(2):418-431
[11] Xu J, Xue C, Xue D,. Overexpression of, a heat shock protein 90 (Hsp90) gene family cloning from soybean, decrease damage of abiotic stresses in[J]. PLoS One, 2013,8(7):e69810
[12] Huang S, Monaghan J, Zhong X,. HSP90s are required for NLR immune receptor accumulation in[J]. Plant J, 2014,79(3):427-439
[13] He Q, McLellan H, Hughes RK,.effector SFI3 targets potato UBK to suppress early immune transcriptional responses [J]. New Phytol, 2019,222(1):438-454
[14] Huang G, Liu Z, Gu B,. An RxLR effector secreted byis a virulence factor and triggers cell death in various plants [J]. Mol Plant Pathol, 2019,20(3):356-371
[15] Liu L, Wang CL, Peng WY,. Direct DNA extraction method of an obligate parasitic fungus from infected plant tissue [J]. Genet Mol Res, 2015,14(4):18546-18551
[16] Li W, Zhao D, Dong J,.negatively regulates plant resistance topathogens by modulating the biosynthesis of endogenous jasmonic acid and salicylic acid [J]. Mol Plant Pathol, 2020,21(1):95-108
[17] Lu W, Deng F, Jia J,. Thegenenegatively regulates plant resistance toby suppressing PAMP-triggered immunity [J]. Mol Plant Pathol, 2020,21(9):1179-1193
[18] Song T, Ma Z, Shen D,. An oomycete CRN effector reprograms expression of plantgenes by targeting their promoters [J]. PLoS Pathog, 2015,11(12):e1005348
[19] Lopez VA, Park BC, Nowak D,. A bacterial effector mimics a host HSP90 client to undermine immunity [J]. Cell, 2019, 179(1):205-218.e21
Cloning and Primary Functional Analysis ofGene from
YANG Lei1, SHENG Hui2, ZHANG Jin-feng2, TIAN Hui2, ZHANG Xiu-guo2*, SUN Wen-xiu1*
1.434025,2.271018,
pathogen interacts with plant to manipulate plant immune responses and promote infection. Previous experiments demonstrated that the effector RxLR19781 ofcould interact with heat shock protein 90 (NbHSP90) of.was cloned fromby RT-PCR. NbHSP90 of transient expression mediated byonto explore the role of NbHSP90 in the pathogenesis of. The results showed that the full-length cDNA ofwas 1005 bp, encoding a protein with 334 amino acids, no signal peptide, no transmembrane structure, with typical conserved HATPase domain and C-terminal MEEVD motif. The results of transient expression illustrated that NbHSP90 could significantly reduce the colonization ofon. The results provide a basis for further elucidating the molecular mechanism of RxLR 19781 targeting HSP90 to promote infection.
;; gene cloning
R379
A
1000-2324(2021)02-0163-05
10.3969/j.issn.1000-2324.2021.02.001
2021-01-29
2021-02-13
国家大宗蔬菜产业技术体系(CARS-25-03B)
杨磊(1995-),男,在读硕士生,研究方向:细胞生物学. Email:2524422614@qq.com
Author for correspondence. E-mail:zhxg@sdau.edu.cn; wenxiusun@163.com
