酿酒酵母中基于外壳蛋白复合物Ⅱ囊泡的蛋白分泌调控机制的研究进展
2021-05-28董晓敏刘延峰堵国成李江华
董晓敏,刘延峰,刘 龙,堵国成*,李江华
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
在真核细胞中,分泌途径对于蛋白质的分泌以及定位在质膜、高尔基体和溶酶体上的蛋白质的运输是必不可少的。绝大多数蛋白质的分泌依靠的是经典的ER(Endoplasmic Reticulum)-Golgi分泌途径:带有信号肽序列的mRNA在胞质中翻译为多肽;在信号肽的作用下进入内质网进行折叠与修饰;成熟的蛋白被包裹进内质网膜表面生成的COPⅡ囊泡,运输至高尔基体,进一步加工修饰,而后分类进入不同目的地,包括细胞器、质膜或者外排至细胞外。其中COPⅡ囊泡介导内质网到高尔基体蛋白质运输是分泌途径中至关重要的第一步。COPⅡ囊泡形成的组成成分及运输过程受到的调控在不同物种间都非常保守。对酿酒酵母中COPⅡ囊泡运输整个过程中受到的调控机制的研究进展进行综述。
1 COPⅡ囊泡的结构
早在1994年,酿酒酵母中COPⅡ外壳蛋白的核心组分就已经被鉴定完全,其外壳包含5个亚基:Sar1、Sec23/Sec24和Sec13/Sec31。其中Sar1是GTP酶开关蛋白中的一种,当其与GDP结合时处于“关闭”状态,与GTP结合时处于“开启”状态。开启状态的Sar1-GTP结合异二聚体Sec23/Sec24组成涂层的内层,两个亚基Sec13和Sec31组装成的异四聚体组成涂层的外壳。多个外壳蛋白聚合在内质网膜外层时,可将包裹的内质网膜挤压成球形囊泡,并在囊泡中包裹货物蛋白,随后脱离内质网,开始蛋白质的转运。因此,外壳蛋白复合物Ⅱ(COPⅡ)主要执行两个主要功能:将内质网膜变形为球形囊泡,并在囊泡中填充特定的货物,COPⅡ囊泡结构示意图如图1所示。
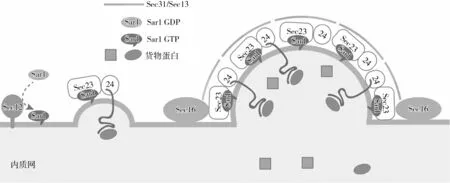
图1 COPⅡ囊泡结构示意图(修改[6])
2 COPⅡ囊泡的形成
COPⅡ囊泡转运货物的整个过程大致分为4个步骤:形成、出芽、束缚和融合,形成和出芽之间没有严格的时间区分。形成过程也可分为3个阶段:(1)组装,5个亚基依次组装到内质网膜上,同时识别成熟且具有特定识别序列的货物蛋白;(2)成熟,组装位点区域的内质网膜开始弯曲;(3)出芽,成熟的囊泡从膜上脱离。
2.1 COPⅡ组装机制
(1)COPⅡ组装顺序。COPⅡ外壳的组装是由膜锚定的鸟嘌呤核苷酸交换因子(Guanine Nucleotide Exchange Factors, GEF)Sec12激活小GTP酶Sar1启动。首先,在Sec12催化作用下,游离在胞质中无活性的Sar1-GDP转为有活性的Sar1-GTP形式,并定位在内质网膜。膜上的Sar1-GTP与Sec23亚基结合,募集Sec23/Sec24异二聚体,形成内层复合物,并通过Sec24捕获内质网腔中的货物蛋白形成“预萌芽复合物”。亚基Sec23通过与Sec31的脯氨酸富集区域相互作用,进一步募集到外涂层复合物Sec13/Sec31四聚体,内层和外层聚合形成笼状结构。
通过分析酿酒酵母中Sar1-Sec12复合物的晶体结构部分地揭示COPⅡ组装的激活机制,即Sec12中的β-螺旋GEF域与其跨膜结构域之间仅有10个氨基酸残基,使得GEF结构域与内质网膜表面的距离较短,且Sec12的表面带正电荷。这些保证了β-螺旋GEF域与内质网表面可以直接相互作用,该作用使得Sar1与Sec12的β-螺旋结合时,Sar1的N端区域也被指向内质网膜。当Sar1进一步与GTP结合时,Sar1蛋白构象发生变化,其N端两亲性α-螺旋暴露出来,以合适的位置插入膜中,同时与Sec12解离。这种机制可以有效地提高Sar1-GTP靶向内质网膜的效率。
(2)COPⅡ组装位点。COPⅡ外壳蛋白的组装发生在称为内质网出口位点(ER Exit Sites,ERES)的膜区域,该区域没有核糖体。酿酒酵母中的ERES几乎遍布整个内质网,小而多,看似随机分布,实际上可能主要集中位于由内质网膜蛋白Rtn1、Rtn2和Yop1诱导的内质网膜高曲率区域。推测可能的机制有两个,一种是COPⅡ衣壳内层预萌复合物Sar1-Sec23/Sec24自身的结构偏好性,可以识别内质网的特定高曲率区域。还有一种可能是内质网膜上的高曲率区域富集的小管结构域更有利于被激活的Sar1的N端两亲性α-螺旋插入膜中。有研究报道与低曲率膜相比,具有高曲率的膜表面Sar1的GTP酶活性较高,而Sar1两亲性α-螺旋通过部分埋在脂质双层面上,取代膜上的脂质头基,引起膜不对称的扩展使得膜弯曲,因此推测Sar1的GTP酶活性和膜曲率之间存在正反馈作用。
2.2 COPⅡ组装受调控机制
在酿酒酵母中,COPⅡ囊泡在生成的过程中处于一种动态亚稳定状态,这是由于COPⅡ外壳的组装受到涂层自身组分和组分之外的蛋白调控因子的多种作用控制。
已知COPⅡ外壳蛋白的组装是由小GTP酶Sar1结合GTP后驱动,而亚基Sec23是Sar1的GTP酶激活蛋白(GTPase-activating protein,GAP),后者会催化Sar1的GTP水解。在外壳早期组装的过程中Sec23与活性形式的Sar1结合时,Sec23的胍盐侧链与磷酸基团接触,从而催化Sar1-GTP水解为无活性形式的Sar1-GDP,导致内层复合物的分解。在外壳蛋白晚期组装的过程中,Sec23受到Sec31的刺激后,GAP活性显著提高并加速GTP的水解。那么在囊泡形成的过程中,细胞自身如何抵抗由于Sar1的GTP水解带来的涂层去稳定作用,存在哪些调控机制可以保证涂层组件的稳定性,并使得COPⅡ涂层在内质网膜上聚合持续一段足够生成囊泡的时间,推测有以下4种原因:
(1)在Sar1-GTP水解后,通过Sec24亚基与跨膜货物蛋白胞质结构域的相互作用,使得Sec23/Sec24仍可以稳定地结合在内质网膜上,该机制延长了衣壳内部涂层保留在膜上的时间。这样的观点也支持了在COPⅡ囊泡从内质网膜剥离之前Sar1可能就从膜上解离的研究,即当COPⅡ衣壳的完整结构在膜上形成后,就不再需要活性形式的Sar1来维持COPⅡ衣壳在膜上的缔合。由于只有与Sec24货物适配器直接或间接结合的蛋白才能起到稳定内部涂层的作用,因此该机制还有利于COPⅡ囊泡有效地分选到正确的货物蛋白。
(2)内层复合物和外层复合物之间的相互作用,如Sec23和Sec31之间的多界面作用有助于涂层结构的稳定性。
(3)锚定在内质膜上的Sec12具有高且稳定的GEF活性,可以不断地催化新Sar1-GTP的生成,并插入内质网膜与新生芽的边界之间,从而增加衣壳的稳定性。
(4)外壳蛋白组分之外的调控因子参与COPⅡ衣壳的组装过程。其中研究最多的是Sec16蛋白。Sec16蛋白是一种大的多结构域蛋白,与COPⅡ衣壳的多个亚基相互作用。当Sec16蛋白结合在内质网膜时,参与调节Sar1的GTP酶活性来介导COPⅡ衣壳的组装。有研究表明这种调节是由于Sec16蛋白的C末端保守区域与Sec23和Sar1的关联作用,间接地阻碍了Sec31针对Sec23的GAP活性能力的激活。已知的是Sec16与Sec23的相互作用不会直接影响Sec23本身的GAP活性,仅仅是干扰了Sec31对Sec23的GAP激活作用。还有研究表明,亚基Sec24与Sec16的缔合产生的复合物也可以间接调控Sec16对GTP水解的负调控作用。因此,Sec16蛋白具有抑制Sar1的GTP水解,从而稳定COPⅡ的涂层结构,对COPⅡ囊泡的周转率起到负调控的作用。此外,在酿酒酵母中,Sec16也被认为具有充当ERES上支架招募COPⅡ外壳蛋白的功能。
2.3 COPⅡ囊泡捕获蛋白质机制
内质网中的成熟蛋白质进入COPⅡ囊泡主要通过两种方式。选择性捕获是其中研究的较为清楚的一种摄取方式,某些成熟的货物蛋白通过直接或间接结合COPⅡ外壳的货运衔接蛋白Sec24亚基,被选择性浓缩进入囊泡,因此货物蛋白在囊泡中的浓度比内质网腔中的高。在酵母中,通过进入COPⅡ囊泡的方式离开内质网的蛋白有近800多种,选择性捕获机制如何实现其对不同种蛋白质的特异性结合呢?已知货物蛋白和Sec24亚基之间的相互作用是由Sec24表面的结合位点介导的,目前研究发现Sec24亚基上至少有4个独立的装载位点,每个装载位点可以识别不同的分拣信号,因此可以识别不同的货物蛋白。酿酒酵母中还存在两个Sec24亚基旁系同源物(Iss1和Lst1),均可以与Sec23形成货物衔接子复合体,且具有不同的货物识别特异性。例如,有研究表明Iss1可能专门用于包装v-SNARE蛋白。在正常生长状态下,Sec24表达量最高,其次是Lst1,表达量最低的是Lss1。而且这3个货物衔接亚基在每个ERES位点的分布不同,当内质网出现未折叠的蛋白质反应(UPR)时,它们的分布又改变为相对均匀的随机分布,该机制表明胞内环境的变化能够控制ERES的装载。除此之外,不同的Sec24同工型还会影响囊泡的结构,有Lst1参与的囊泡尺寸约为87 nm,而普通囊泡尺寸约为60 nm。内质网腔还存在某些不能直接与Sec24相互作用的货物蛋白,需通过与货物受体蛋白的作用间接与Sec24结合,这些货物受体蛋白具有广泛性,促进了蛋白质的分选。综合以上两个因素,COPⅡ囊泡可以实现几百种蛋白质的转运。由于目前货物蛋白的大多数结构信息来自与包含分类信号的合成肽结合的外壳蛋白的共晶体,所以单个Sec24分子一次可以结合多少个不同的分类信号还不清楚。已知的是Sec24识别的分类信号既包括简单的氨基酸基序(如DxE、LxxLE和YxxNPF),也包含折叠的表位。
第二种方法是成熟的蛋白以“整体流”或者“散装物流”的方式非选择性地进入COPⅡ囊泡。与经历选择性浓缩进入囊泡的货物蛋白不同,这些蛋白质在内质网腔中的浓度与囊泡中的浓度相当。该类成熟蛋白质往往与内质网中的分子伴侣以及其他质量控制组件之间无相互作用,且与外壳蛋白也无相互作用。
内质网中的驻留蛋白和未成熟的蛋白质无法被选择性捕获系统识别,因此不会通过选择性摄取方式轻易地离开内质网。同时,这些蛋白通过与固定的内质网结构相互作用,降低其随着整体流扩散到囊泡中的可能性。最新的研究表明,COPⅡ囊泡的存在还有助于内质网驻留蛋白的保存。这些机制保证了内质网出口的高度选择性。
2.4 COPⅡ囊泡的成熟和出芽
在COPⅡ组装的过程中,外壳蛋白装配时形成的笼状结构产生的曲率赋予球形囊泡形成的膜弯曲力。涂层之间自聚合形成低聚物后产生的力足够去克服膜中脂质双层的固有刚性,囊泡形成球形随后COPⅡ囊泡从内质网膜表面剥离。在先前的报道中可知,Sar1的N末端α-螺旋的插入对于囊泡分离非常重要。也有学者指出,COPⅡ囊泡的出芽独立于Sar1的GTP水解活性。因此,到目前为止COPⅡ囊泡出芽的机制仍尚未完全揭示。
最新研究表明在正常生长的酿酒酵母细胞中通过电子显微镜中的COPⅡ囊泡数量较少,并分析是由于在囊泡释放前,以分散的形式存在细胞质中的顺式高尔基体可以通过所谓的“拥抱和亲吻”形式与内质网出口位点接触,两者之间暂时形成功能单元,顺式高尔基体就直接捕获内质网表面的货物。这种方式比COPⅡ囊泡释放到细胞质中后再与高尔基体膜表面接触的方式更安全和有效,但是多数实验表明COPⅡ囊泡出芽后会离开内质网膜,进入下一个运输步骤。
3 COPⅡ囊泡束缚和融合机制
3.1 COPⅡ囊泡束缚
囊泡与靶膜的初始相互作用是由称为系链或者束缚因子介导的。在酿酒酵母中,介导COPⅡ囊泡的束缚因子为定位于高尔基体膜上的多亚基转运蛋白颗粒I(TRAPPI),包含7个亚基(Bet5p、Bet3p、Trs20p、Trs23p、Trs31p、Trs33p和Trs85p)。一方面,TRAPPI充当募集和激活小GTP酶Ypt1的鸟嘌呤核苷酸交换因子(GEF),在高尔基体受体膜表面产生活化的Ypt1-GTP。Ypt1-GTP招募具有螺旋卷曲结构域的Uso1蛋白,Uso1随后可能与供体囊泡上存在的卷曲系留因子接触,在COPⅡ囊泡和高尔基膜之间建立长距离的连接。而且TRAPPI的亚基Bet5、Trs23和Trs31与Ypt1之间的相互作用进一步稳定Ypt1-GTP形式。随后,TRAPPI的亚基Bet3可以直接与COPⅡ衣壳的Sec23亚基结合,将囊泡引导至更靠近膜的近端位置。TRAPPI复合物中包含两个拷贝的Bet3亚基,所以单个的TRAPPI复合物可以同时结合两个COPⅡ囊泡。因此,在束缚因子与Rab GTP酶、外壳蛋白等组分相互作用下,将COPⅡ囊泡准确地系留到高尔基体膜上。囊泡束缚过程示意图如图2所示。
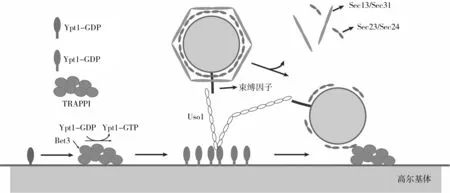
图2 囊泡束缚过程示意图(修改[51])
3.2 受SNARE蛋白介导的膜融合机制
系留的囊泡与顺式高尔基体膜的融合依靠的是可溶的N-乙基马来酰亚胺敏感因子附着蛋白受体蛋白(SNARE)。SNARE是一类Ⅱ型膜蛋白,根据锚定的位置不同,位于转运囊泡上的SNARE称为v-SNARE,是在囊泡形成过程中被选择性移至囊泡膜。位于囊泡特定结合的受体膜上的称为t-SNARE。除了C末端锚定在膜上外,SNARE还包括一段约50~70个氨基酸的α-螺旋基序。根据基序中心结构的不同,又将SNARE分为两类,其中基序中心是精氨酸残基的为R-SNARE,是谷氨酰胺残基的为Q-SNARE。按照序列保守性,Q-SNARE进一步细分为Qa、Qb和Qc-SNARE。膜之间的融合一般需要4个同源的SNARE蛋白,且在囊泡膜上的v-SNARE为R-SNARE,受体膜上的t-SNARE则通常是由一条重链和两条轻链的Qa、Qb和Qc-SNARE组成。当囊泡系留在靶膜后,v-SNARE和t-SNARE即可通过电荷互补作用结合成稳定的α-螺旋结构,形成SNARE复合体。SNARE复合体在组装的过程中通过释放能量去克服由于膜之间对立的磷脂头基团产生的阻碍,因此可以直接驱动囊泡膜与供体膜融合。在酵母中,COPⅡ囊泡在与顺面高尔基体膜表面融合时,Sec22充当R-SNARE,Sed5p充当Qa-SNARE,Bos1p充当Qb-SNARE,Bet1p充当Qc-SNARE。膜的特异性融合除了基于这4个SNARE蛋白的同源性外,还依赖于Sec1/Munt18-1(SM)系列结合蛋白的调节。Sly1是SM的家族成员之一,直接结合Sed5并增加SNARE复合物的保真度,是COPⅡ囊泡与高尔基体膜融合所必需的蛋白。膜融合后,完成蛋白从内质网到高尔基体的转运,随后SNARE复合物被Sec18p分解。
4 总结
近些年来通过系列深入研究,科学家们已部分揭示了COPⅡ囊泡组装的基本步骤及运输过程受到的调控,但仍存在很多不完全清晰的机制,例如囊泡从内质网膜上分离的确切时间点还不清楚;外壳复合物的多个亚基存在磷酸化修饰,这些修饰对囊泡的调控机理了解不完整;对COPⅡ囊泡的装载物以及贩运通量受到的动态调节还需进行深入研究。因此,未来还需要结合无细胞实验、活细胞监测等技术以进一步明确整个囊泡运输机制。
