CdCl2对MDCK细胞的毒性作用
2021-05-27陆玉建张弘扬朱婷婷邹星月
陆玉建, 张弘扬, 朱婷婷, 郭 好, 邹星月, 杨 莹
(1.滨州学院生物与环境工程学院;2.山东省黄河三角洲野生植物资源开发利用工程技术研究中心;3.山东省黄河三角洲生态脆弱带工程技术研究中心,山东 滨州 256603)
镉(Cd)是一种广泛存在于生产生活中的重金属,其化合物对哺乳动物的许多组织和器官有较强的毒性作用,可影响细胞增殖,诱导细胞凋亡甚至癌变[1].例如,氯化镉(CdCl2)可导致鸡肝细胞CaM基因表达量降低,钙稳态发生紊乱,进而诱发细胞凋亡[2].这是由于Cd能够诱导机体产生过量的活性氧(reactive oxygen species, ROS),从而诱发氧化应激损伤[3-4].研究证实,Cd对条斑星鲽(Veraspermoseri)卵巢细胞具有显著的毒性作用,能引起细胞内超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活性降低和丙二醛(malondialdehyde, MDA)含量增高,这种氧化应激作用诱导细胞凋亡[5];Cd暴露会导致大鼠成骨细胞及细胞核形态改变,线粒体损伤,出现典型的凋亡特征[6];Cd容易引起小鼠生殖细胞凋亡及DNA损伤[7].大量的数据表明,Cd可以与DNA形成加合物,损伤DNA分子,引发细胞中ROS含量升高,进而启动与线粒体相关的细胞凋亡信号通路[8];此外,ROS能通过c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)信号通路降低Bcl-2/Bax值,激活caspase-3和caspase-7表达,促进细胞凋亡[9-10].犬肾上皮(Madin-Daby canine kidney, MDCK)是由Madin和Darby从犬肾脏组织分离培养建立的细胞系,通常该细胞呈上皮样,以贴壁方式生长,可连续传代培养[11].MDCK细胞系可广泛用于多种病毒的扩增和纯化,尤其对流感病毒的感染具有效率高、增殖快、不易产生变异的优点[12],是目前公认的最适合流感疫苗生产的细胞系之一[13-14].国外的研究表明,CdCl2能促进MDCK细胞中流感病毒的增殖[15],但目前我国尚未见相关报道.本试验用不同浓度的CdCl2处理MDCK细胞,利用毒理学和细胞生物学方法研究CdCl2对MDCK细胞的毒性作用,以期为进一步了解Cd的作用机制提供依据,也为揭示Cd污染和流感病毒流行之间的关系提供线索.
1 材料与方法
1.1 材料
MDCK细胞(上皮型,贴壁生长),由山东绿都生物科技有限公司提供.DMEM(Dulbecco′s modified eagle medium)高糖培养基,购自赛默飞世尔科技有限公司,附加10%胎牛血清(北京索莱宝科技有限公司).CdCl2为Sigma公司产品,称取其粉末加入适量的超纯水,配制浓度为0.1 mol·L-1储存液,过滤后4 ℃保存备用.蛋白提取试剂盒购自北京索莱宝科技有限公司.MTT细胞增殖-毒性检测试剂盒购自南京建成生物工程研究所有限公司.
1.2 方法
1.2.1 MDCK细胞经CdCl2处理后的形态学观察 根据文献[16]进行试验,稍作改动.MDCK细胞以1×105个·mL-1接种于24孔板,置于37 ℃、5% CO2细胞培养箱培养24 h后,依次加入终浓度为15、25、50、75、100 μmol·L-1的CdCl2,设置对照孔(无CdCl2),分别处理24、48、72和96 h后观察细胞形态变化.每种处理并列设3个孔,相同的试验重复3次.
1.2.2 MDCK细胞存活率检测 利用MTT法检测细胞存活和生长情况,具体操作详见MTT细胞增殖-毒性检测试剂盒说明书.MDCK细胞以1×105个·mL-1接种于96孔板,置于37 ℃、5% CO2细胞培养箱培养24 h后,分别加入终浓度为15、25、50、75、100 μmol·L-1的CdCl2,设置对照孔(无CdCl2).每种浓度并列设3个孔,将96孔板在CO2培养箱(37 ℃)中孵育24 h后取出,将MTT用稀释液稀释5倍,每孔加50 μL, 37 ℃孵育4 h,使MTT还原为甲臜.弃上清,每孔加150 μL二甲基亚砜,摇匀使甲臜溶解.用全自动酶标仪(Thermo ScientificTMMultiskanTMFC)在570 nm波长处检测每孔的光密度.相同的试验重复3次.
细胞存活率/%=(加药细胞D570 nm值/对照细胞D570 nm值)×100
1.2.3 MDCK细胞总蛋白质的提取及其含量测定 参照蛋白提取试剂盒说明书进行总蛋白质的提取.MDCK细胞以1×105个·mL-1接种于24孔板,置于37 ℃、5% CO2细胞培养箱中培养24 h,加入终浓度为15、25、50、75、100 μmol·L-1的CdCl2,设置对照孔(无CdCl2),每种浓度并列设3个孔.分别培养24、48、72和96 h后弃细胞培养液,PBS冲洗,每孔加50~100 μL RIPA蛋白裂解液,吹打细胞.将裂解后的细胞吸入EP管内,10 000~14 000g离心3~5 min,取上清,上清液即为全细胞蛋白质.
蛋白质含量测定:取标准蛋白(1 g·L-1)50 μL、待测样品50 μL,另取蒸馏水50 μL,分别加入G-250 3 mL混匀,静置10 min,于波长595 nm处,1 cm光径,空白管(蒸馏水)调零,测量光密度,根据下列公式计算蛋白质含量[17].相同的试验重复3次.
蛋白质含量=(测定管D595 nm值/标准管D595 nm值)×标准管浓度(1 g·L-1)
1.2.4 总蛋白SDS-PAGE检测与硝酸银染色 根据文献[18]进行测定,稍作改动.将提取的蛋白质和等体积的上样缓冲液混匀,沸水浴5 min,离心后冷却备用.制备聚丙烯酰胺凝胶,其中分离胶浓度为10%(质量体积比),浓缩胶浓度为5%(质量体积比).上样后进行电泳,浓缩胶电压设定为80 V,进入分离胶后调到120 V.电泳结束后进行硝酸银染色:用无离子水漂洗凝胶5 min,固定液固定30 min,敏化液处理30 min,无离子水漂洗3次,加入硝酸银溶液染色20 min,显色处理2~10 min,观察到清晰的条带后,立即用停显液处理10 min,终止显色.利用凝胶成像仪(SYSTEM GelDoc XR+IMAGELA Bio-Rad)观察、拍照.
1.2.5 数据处理 利用Excel 2007和SPSS 17软件处理数据.通过Duncan′s多重比较进行多组样本间的差异显著性分析.
2 结果与分析
2.1 CdCl2浓度对MDCK细胞生长状态的影响
对照细胞培养48 h内生长正常(图1A、2A),贴壁状况良好;之后,随着培养基营养的消耗,对照细胞开始聚团(图3A);培养96 h后,对照细胞大量聚团,有少量细胞出现脱落(图4A).15和25 μmol·L-1CdCl2处理24 h后MDCK细胞生长基本正常(图1B-C);48~72 h部分细胞脱落(图2B-C、3B-C);96 h后细胞脱落程度加重(图4B),且25 μmol·L-1CdCl2处理的大量细胞变圆脱落,漂浮于培养基中(图4C).50 μmol·L-1CdCl2处理24 h后部分细胞开始变圆脱落,细胞密度有所降低(图1D);48 h后细胞进一步脱落(图2D);72~96 h大量细胞变圆脱落,贴壁细胞少,细胞生长明显受到抑制(图3D、4D).75和100 μmol·L-1CdCl2处理48 h内已有大量细胞脱落,漂浮于培养基中(图1E-F、2E-F);72 h后细胞已完全脱落,并且逐渐碎片化(图3E-F、4E-F).
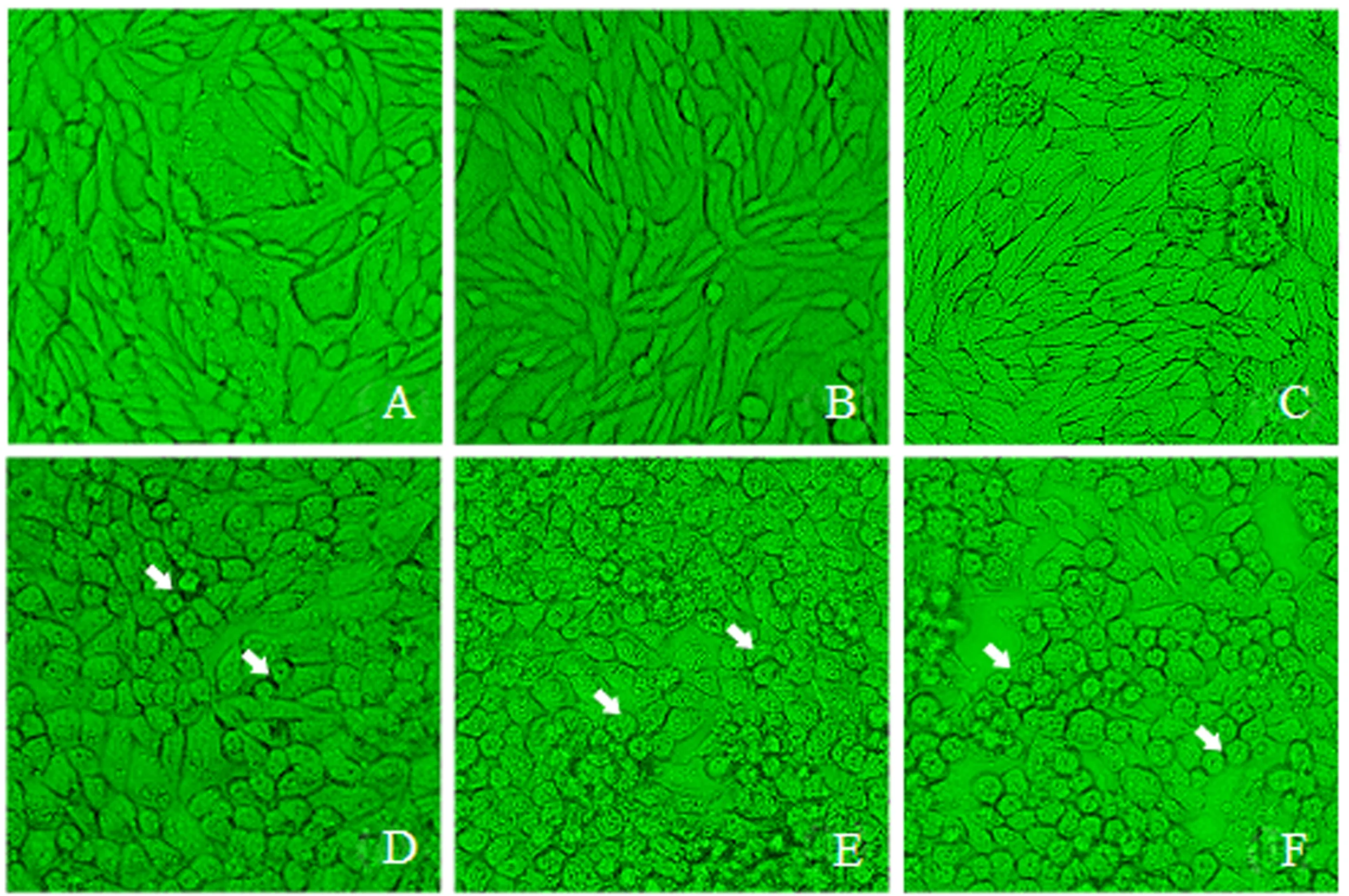
A-F:培养基中CdCl2的浓度分别为0、15、25、50、75和100 μmol·L-1(箭头指示部分变圆脱落的细胞).图1 MDCK细胞经不同浓度CdCl2处理24 h后的生长状态(40×)Fig.1 Growth states of MDCK cells treated with different concentrations of CdCl2 after 24 h(40×)
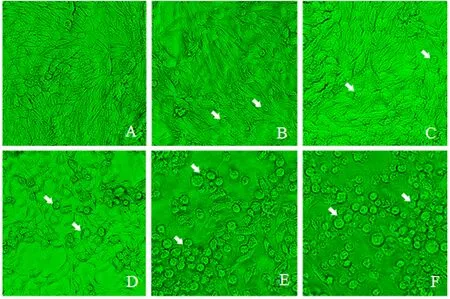
A-F:培养基中CdCl2的浓度分别为0、15、25、50、75和100 μmol·L-1(箭头指示部分变圆脱落的细胞).图2 MDCK细胞经不同浓度CdCl2处理48 h后的生长状态(40×)Fig.2 Growth states of MDCK cells treated with different concentrations of CdCl2 after 48 h(40×)
2.2 CdCl2浓度对MDCK细胞存活率的影响
MDCK细胞经15 μmol·L-1CdCl2处理24 h后的存活率接近100%;随着CdCl2浓度的不断增大,细胞存活率逐渐降低,当CdCl2浓度达到75和100 μmol·L-1时,细胞存活率小于20%(图5).

A-F:培养基中CdCl2的浓度分别为0、15、25、50、75和100 μmol·L-1(箭头指示部分变圆脱落的细胞).图3 MDCK细胞经不同浓度CdCl2处理72 h后的生长状态(40×)Fig.3 Growth states of MDCK cells treated with different concentrations of CdCl2 after 72 h(40×)

A-F:培养基中CdCl2的浓度分别为0、15、25、50、75和100 μmol·L-1(箭头指示部分变圆脱落的细胞).图4 MDCK细胞经不同浓度CdCl2处理96 h后的生长状态(40×)Fig.4 Growth states of MDCK cells treated with different concentrations of CdCl2 after 96 h(40×)
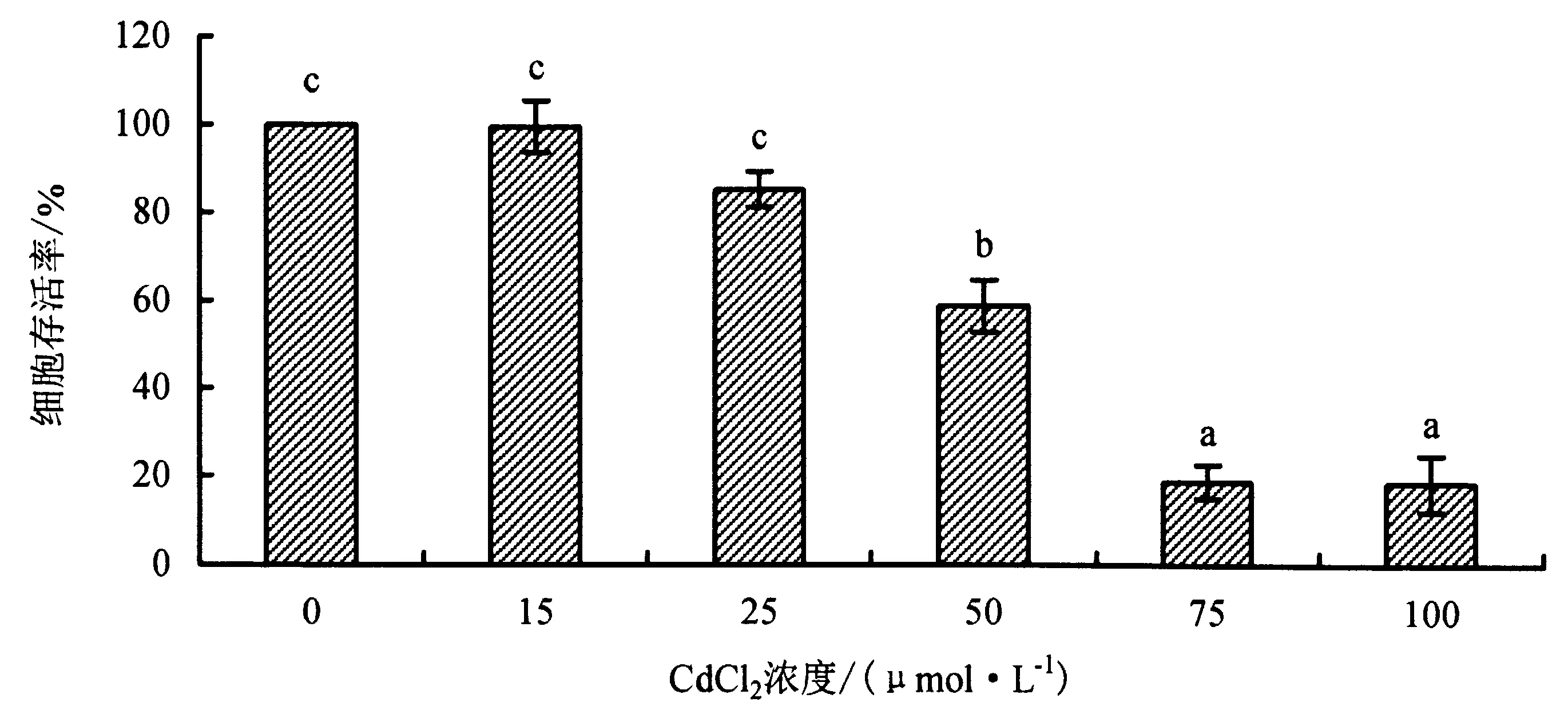
柱上不同小写字母表示在0.05水平上差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05).图5 MDCK细胞经不同浓度CdCl2处理24 h后的存活率Fig.5 Survival rates of MDCK cells treated with different concentrations of CdCl2 after 24 h
2.3 CdCl2浓度对MDCK细胞蛋白质合成的影响
利用SDS-PAGE检测处理细胞的蛋白质含量.图6显示,与对照相比,15和25 μmol·L-1CdCl2处理24 h后细胞的蛋白质含量变化不明显;随着CdCl2浓度的升高,蛋白质含量逐渐减少,当CdCl2浓度达到100 μmol·L-1时,蛋白质含量明显降低.培养48 h后,对照细胞及15和25 μmol·L-1CdCl2处理细胞的蛋白质含量都有所下降,50~100 μmol·L-1CdCl2处理细胞的蛋白质含量则显著降低.随着处理时间的延长和CdCl2浓度的增大,细胞蛋白质含量下降幅度更加明显.
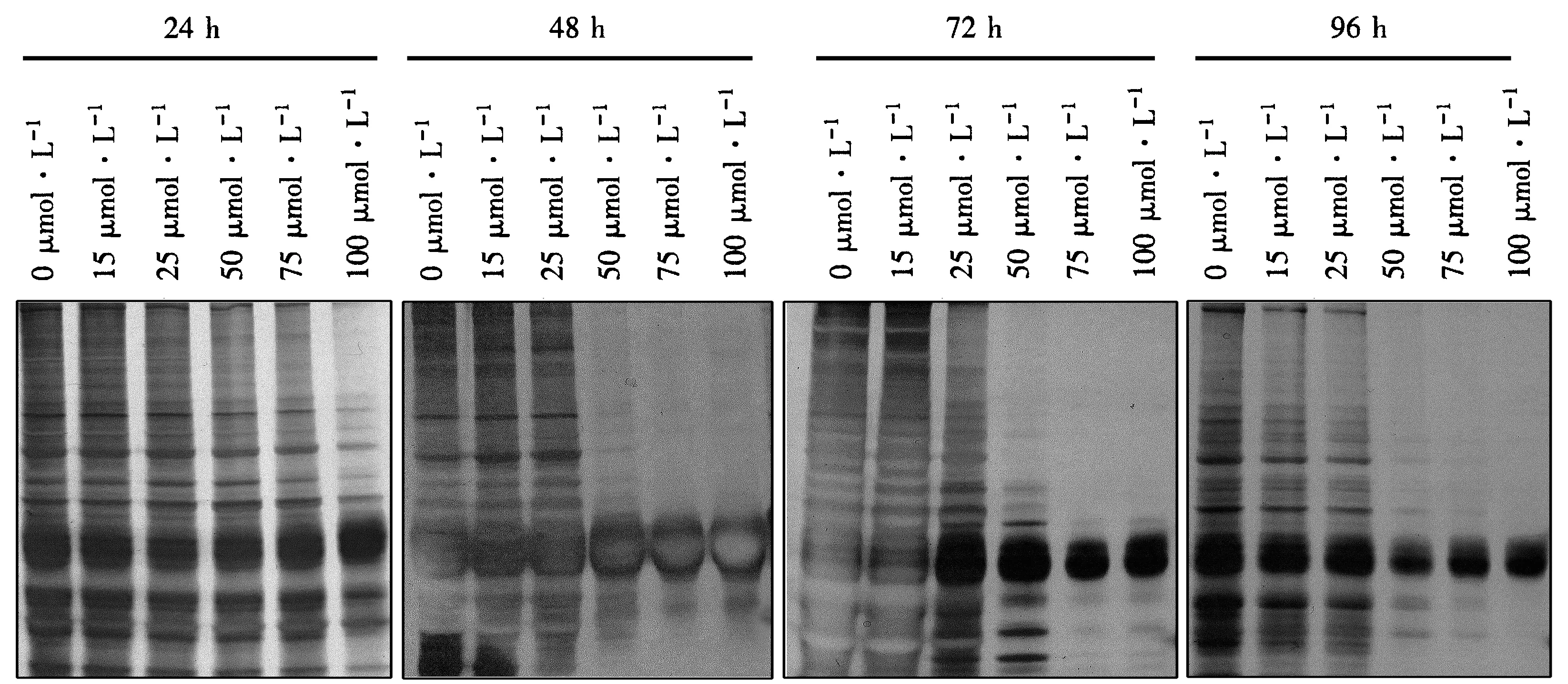
图6 不同浓度CdCl2处理后细胞蛋白质含量的变化Fig.6 Changes in cellular protein contents after treated with different concentrations of CdCl2
表1也显示,对照细胞和CdCl2处理细胞的蛋白质含量都随培养时间的延长而降低;CdCl2处理时间相同时,蛋白质含量随CdCl2浓度的增大而降低.15 μmol·L-1CdCl2处理24和48 h后细胞的蛋白质含量与对照差异不显著(P>0.05),其他浓度处理的细胞蛋白质含量与对照相比差异均达显著水平(P<0.05).这表明CdCl2对MDCK细胞蛋白质的合成具有抑制作用.
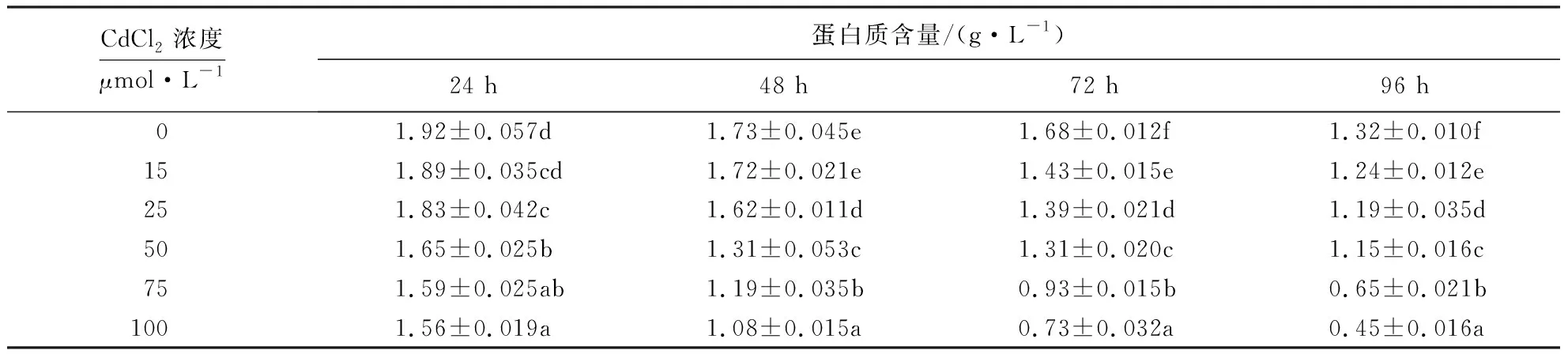
表1 CdCl2浓度对细胞蛋白质合成的影响1)Table 1 Effects of CdCl2 concentrations on cellular protein synthesis
3 讨论与结论
外源性因子对细胞的潜在毒性作用可通过观察体外培养细胞受损的性质与程度进行判断,如细胞形态的改变、贴壁状况、生长速度、退化程度及完整性等[19].有研究表明,CdCl2不仅对成纤维细胞具有一定的毒性作用,而且这种作用存在剂量和时间依赖性[3].本试验结果也显示,CdCl2处理浓度越大、时间越长,MDCK细胞凋亡和脱落现象越严重,表明CdCl2对MDCK细胞的毒性作用具有明显的时间和剂量效应.已有研究表明,随着CdCl2浓度升高,机体会产生过量的ROS,SOD、GSH-Px、谷胱甘肽还原酶(glutathione reductase, GR)、谷胱甘肽-S-转移酶(glutathione-S-transferases, GST)等多种抗氧化酶类活性降低,MDA含量上升,导致细胞内氧化还原平衡失调,诱发氧化应激损伤,线粒体结构与功能被破坏,细胞色素C(cytochrome C, CytC)大量释放,激活Caspase-9,形成凋亡复合体,进一步激活下游的Caspases,启动线粒体途径的细胞凋亡程序[4,20-21].由此可以推测,随着CdCl2浓度的增大和处理时间的延长,MDCK细胞内活性氧大量积蓄,抗氧化酶类活性降低,导致细胞抗氧化能力下降,氧化应激作用增强,进而引起细胞凋亡.通过SDS-PAGE检测和蛋白质含量测定得出,MDCK细胞蛋白质含量的变化同样呈现明显的剂量和时间依赖性.可能的原因:随着CdCl2浓度的增大、时间的延长,细胞生长受到的影响越来越明显,蛋白质合成受到的抑制作用越来越强烈;同时,细胞存活率不断下降,细胞数量逐渐减少,蛋白质含量随之降低.有研究证实,CdCl2作用的MDCK细胞以剂量依赖方式增加流感病毒的复制,这表明Cd污染物可能加速流感病毒的传播[15].但CdCl2促进MDCK细胞中流感病毒复制的机制尚不明确.此外,细胞凋亡的机制复杂,CdCl2引起MDCK细胞凋亡的具体途径是什么?CdCl2促进流感病毒的增殖与MDCK细胞凋亡之间是否存在必然的联系?要解决这些问题,未来还要开展大量的研究.
