铅、镉复合胁迫对紫金牛生理特性的影响
2021-05-26刘倩钰邓甜甜何金金廖飞勇
刘倩钰, 邓甜甜, 何金金, 廖飞勇
(中南林业科技大学风景园林学院,湖南 长沙 410004)
重金属污染治理一直是国内外环境保护的难点及研究热点.我国湖南的镉、汞、铅和铬排放量位居全国首位,且我国的铅、镉污染值最高分别达到1 143和228 mg·kg-1[1-2].《土壤环境质量建设用地土壤污染风险管控标准(试行)》[3]规定,土壤中铅含量大于400 mg·kg-1、镉含量大于20 mg·kg-1时需要进行土壤污染风险筛查,铅含量大于800 mg·kg-1、镉含量大于47 mg·kg-1时则应采取土壤污染风险管控或修复措施.现实环境中,重金属污染往往是多种重金属的复合影响,其毒害机制更为复杂[4].有关植物对铅、镉复合污染土壤的修复研究已有不少,主要集中在农作物、经济作物等草本植物方面[5-6],而关于铅、镉复合污染对木本植物影响的报道较少.木本植物观赏价值高、生长迅速且生物量大,有利于实现污染土壤资源化,其吸收积累的重金属短期内不会重新释放到环境中[7];同时,利用生态位不同的植物优化重金属污染地区的植物配置,相对于超积累型草本植物群落来说具有更好的生态效益和景观效果.因此,木本植物修复重金属污染土壤成为潜在的研究热点[8-10].
紫金牛(Ardisiajaponica)为紫金牛科(Myrsinaceae)紫金牛属(Ardisia)常绿小灌木,具有较强的耐荫性与生态适应性.其全株均可入药,植株低矮,枝叶常青,果实鲜艳且挂果持久,适宜于林下栽植或室内盆栽,观赏性及药用价值极佳,应用前景广阔[11].目前,紫金牛的相关研究主要集中在其化学成分及药理方面,也有部分关于其对光照[12-13]、水分[14-15]等生理反应的研究.王佳星等[16-17]研究发现,紫金牛在铅含量为800 mg·kg-1的土壤中长势较好,胁迫60 d后,紫金牛的叶绿素(chlorophyll, Chl)含量、PSⅡ最大原初光化学量子效率(Fv/Fm)和光化学猝灭系数(photochemical quenching coefficient, qP)高于对照,植株对于光能的利用能力得到提升,而在铅含量为1 800 mg·kg-1的土壤中生长受到抑制,但不至死亡;在镉含量达到200 mg·kg-1的土壤中仍能生长,胁迫60 d后紫金牛的叶绿素荧光参数和可溶性糖(soluble sugar, SS)含量低于对照,但可溶性蛋白(soluble protein, SP)和丙二醛(malondialdehyde, MDA)含量高于对照.有关重金属复合污染对紫金牛的影响尚未见报道.本试验研究铅、镉复合胁迫对紫金牛生长及生理特性的影响,并结合主成分分析筛选紫金牛对铅、镉复合胁迫响应的评价指标,以期为紫金牛在铅、镉污染地区土地绿化、环境质量提升和土壤改良方面的应用提供参考.
1 材料与方法
1.1 材料
以3 a生紫金牛实生苗为试验材料,种植于湖南长沙中南林业科技大学校园内,于2019年6月下旬移栽至直径120 mm、高105 mm的塑料花盆中.栽培基质由黄土、营养土、椰糠以体积比1∶1∶1混合而成,黄土取自中南林业科技大学校园内,其中铅含量为10 mg·kg-1[18]、镉含量为0.67 mg·kg-1[19],与胁迫添加的量相比,可忽略不计.每盆装干土0.4 kg,苗木1株,下垫托盘,自然光照下常规管理.移植60 d后选取长势基本一致的植株进行试验.
1.2 胁迫处理

表1 铅、镉复合胁迫试验设计Table 1 Design of Pb-Cd combined stress experiment
采用完全随机试验设计,参考《土壤环境质量建设用地土壤污染风险管控标准(试行)》[3]及预试验结果,设置6个铅、镉污染胁迫水平(表1).以乙酸铅[Pb(CH3COO)2·3H2O]、硫酸镉(3CdSO4·8H2O)配制不同浓度的Pb2+、Cd2+溶液施入土壤,每个处理3个重复,每个重复3盆植株.处理时将托盘内渗漏的液体及时倒回花盆,防止重金属离子流失.每隔15 d测定各项指标,60 d后结束试验.
1.3 指标测定方法
用烘干称重法测定植物组织含水量[16];采用分光光度法测定Chl含量[20];采用LI-6400XTR便携式光合作用测定系统(LI-COR公司,美国)测定荧光参数[21];SS含量的测定采用蒽酮比色法,MDA含量的测定采用硫代巴比妥酸法,SP含量的测定采用考马斯亮蓝法[22].
1.4 数据处理
用Microsoft Excel和SPSS 25.0软件处理数据,采用单因素方差分析(one-way ANOVA)和Duncan′s法检验各处理组之间差异的显著性水平(α=0.05);将原始数据进行标准化(Z-score法)处理,并进行Pearson相关性分析和主成分分析(principal component analysis, PCA).
2 结果与分析
2.1 铅、镉复合胁迫对紫金牛Chl含量的影响
Chl含量影响植物对光能的吸收及转化能力.表2表明,胁迫处理前,各组紫金牛Chl含量差异不大;15 d后,各处理组Chl含量相较于对照组均有不同程度的上升;30 d后,各处理组Chl含量呈下降趋势,C3P3组下降至对照组的69.4%;45 d后各处理组Chl含量略有回升,其中,C1P1组略高于对照组;60 d后,C1P1组Chl含量升至对照组的1.22倍,C3P3组Chl含量则下降至对照组的72.5%.
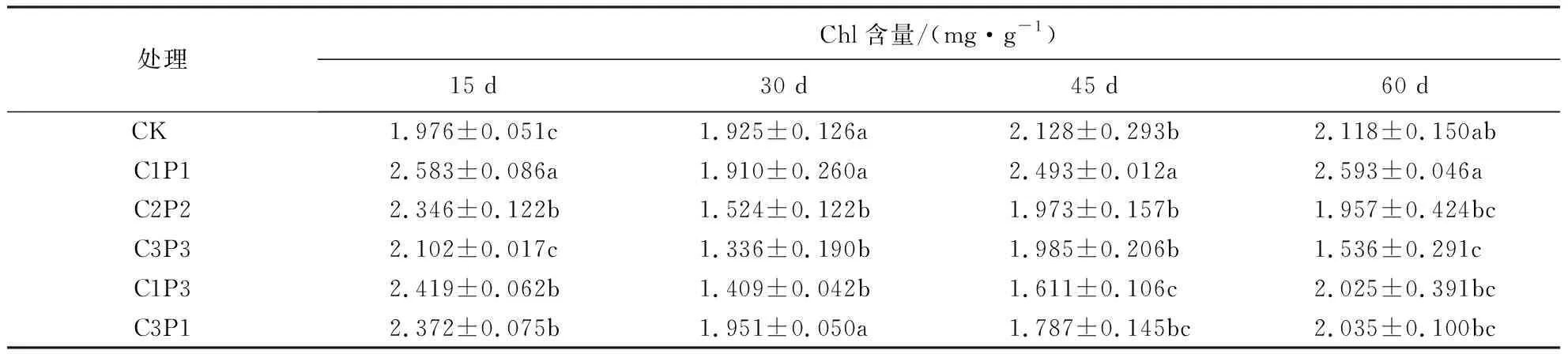
表2 铅、镉复合胁迫对紫金牛Chl含量的影响1)Table 2 Effect of Pb-Cd combined stress on chlorophyll content of A.japonica
2.2 铅、镉复合胁迫对紫金牛荧光参数的影响
2.2.1 对Fo的影响Fo表示暗下最小初始荧光.表3表明,各处理组的Fo在胁迫期间整体呈先上升后下降的趋势.胁迫15 d后,各处理组Fo与对照组相比均较高,且差异显著;随着胁迫时间的延长,各处理组Fo略微下降,处理60 d后,C1P1、C2P2组Fo显著低于对照组,说明轻度或中度的铅、镉复合胁迫在一定程度上促进了紫金牛的光合作用,而C3P3、C1P3组Fo分别达到对照组的1.02、1.12倍,电子传递受阻.

表3 铅、镉复合胁迫对紫金牛Fo的影响1)Table 3 Effect of Pb-Cd combined stress on Fo of A.japonica
2.2.2 对Fv/Fm的影响Fv/Fm的正常范围为0.75~0.85.表4表明,处理前各组Fv/Fm为0.754~0.796,在正常范围内.铅、镉复合胁迫期间,各处理组Fv/Fm整体呈先降低后升高的趋势.处理15 d后,除C3P1外,其余各处理组Fv/Fm均低于正常水平;处理30 d后,各处理组Fv/Fm恢复至正常水平且均高于对照组;处理60 d后,C1P1、C2P2、C3P1组Fv/Fm分别比对照组升高了2.08%、1.82%、1.17%,而C3P3和C1P3组的Fv/Fm则分别比对照组下降了1.69%和3.13%.

表4 铅、镉复合胁迫对紫金牛Fv/Fm的影响1)Table 4 Effect of Pb-Cd combined stress on Fv/Fm of A.japonica
2.2.3 对qP的影响 表5表明,处理15 d后, C1P1组qP为对照组的1.09倍,其余各组qP明显低于对照组;胁迫至60 d后,C1P1和C2P2组qP高于对照组,分别为对照组的1.08和1.21倍,其余各组qP均低于对照组,其中,C1P3组qP最低,为对照组的92.1%.这说明轻度和中度的铅、镉复合胁迫能促进紫金牛对光能的利用.

表5 铅、镉复合胁迫对紫金牛qP的影响1)Table 5 Effect of Pb-Cd combined stress on qP of A.japonica
2.2.4 对ETR的影响 ETR表示光合电子传递效率(photosynthetic electron transport rate).表6表明,处理15 d后,除C1P3组外,其余各处理组的ETR值较对照组均有所下降,其中,C3P3组ETR值最低,为对照组的90.8%;处理45 d后,除C1P1组外,其余各处理组ETR值均低于对照组;处理60 d后,各处理组ETR值分别下降至对照组的91.0%、73.6%、70.1%、90.5%、92.3%.

表6 铅、镉复合胁迫对紫金牛ETR的影响1)Table 6 Effect of Pb-Cd combined stress on ETR of A.japonica
2.3 铅、镉复合胁迫对紫金牛植物组织含水量的影响
表7表明,胁迫处理期间,各处理组的植物组织含水量始终低于对照组.处理30 d后,各处理组植物组织含水量略微回升,接近对照,差异均不显著;处理60 d后,C1P1、C3P1组组的植物组织含水量与对照组差异不显著,而C2P2、C3P3、C1P3组与对照组差异显著.

表7 铅、镉复合胁迫对紫金牛植物组织含水量的影响1)Table 7 Effect of Pb-Cd combined stress on water content of A.japonica tissue
2.4 铅、镉复合胁迫对紫金牛SS含量的影响
表8表明,处理15d后,各处理组SS含量呈不同程度的下降;处理30 d后,C1P1、C3P1组的SS含量有所回升,达到胁迫周期内的最高值;处理60 d后,各处理组SS含量均下降,其中C1P3组SS含量最低,仅为对照组的40.45%,说明重度铅胁迫对紫金牛SS合成的抑制作用更强.
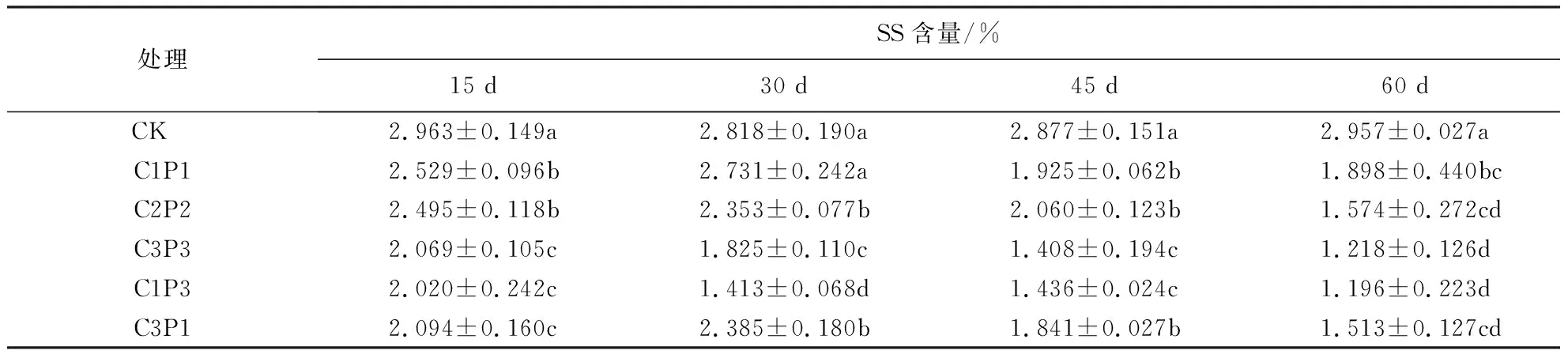
表8 铅、镉复合胁迫对紫金牛SS含量的影响1)Table 8 Effect of Pb-Cd combined stress on soluble sugar content of A.japonica
2.5 铅、镉复合胁迫对紫金牛SP含量的影响
表9表明,随着胁迫时间的延长,各处理组的SP含量整体呈先上升后下降的趋势.胁迫15 d后,各处理组的SP含量均高于对照组,其中,C3P1组显著高于对照组;胁迫30 d后,各处理组SP含量均下降,其中,C2P2、C3P3组SP含量最低;胁迫60 d后,C1P1、C2P2、C3P3组与对照组相比,SP含量分别下降了9.74%、9.31%、14.27%,而C1P3和C3P1组则有小幅的回升,为对照组的1.22和1.26倍.

表9 铅、镉复合胁迫对紫金牛SP含量的影响1)Table 9 Effect of Pb-Cd combined stress on soluble protein content of A.japonica
2.6 铅、镉复合胁迫对紫金牛MDA含量的影响
表10表明,胁迫期间各处理组MDA含量均高于对照组.其中,C1P1、C2P2、C3P1组MDA含量整体呈先升高后降低趋势,处理30 d后MDA含量达到胁迫期间的最高值;而C3P3和C1P3组MDA含量呈持续上升趋势,处理60 d后,其MDA含量分别达到对照组的1.52和1.40倍.
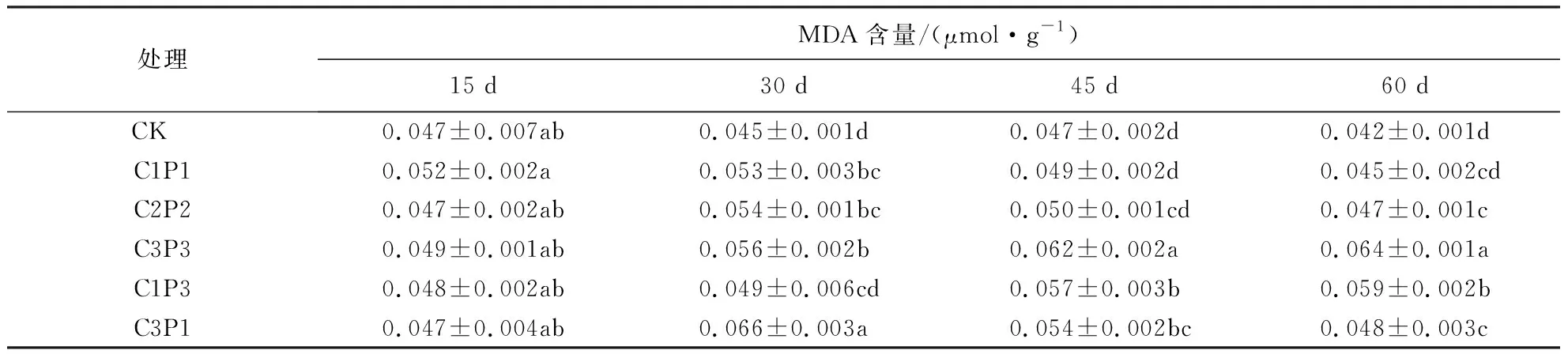
表10 铅、镉复合胁迫对紫金牛MDA含量的影响1)Table 10 Effect of Pb-Cd combined stress on MDA content of A.japonica
2.7 紫金牛对铅、镉复合胁迫生理响应的综合分析
2.7.1 相关性分析 表11表明,Chl含量与Fv/Fm呈极显著正相关,Fo与qP呈显著负相关;植物组织含水量与SS含量呈显著正相关,与MDA含量呈极显著负相关.
2.7.2 主成分分析 如表12所示,紫金牛的前两个主成分的累计贡献率达83.862%.第1主成分贡献率为54.074%,指标包括MDA含量、植物组织含水量、Chl含量、SS含量和Fv/Fm,主要反映铅、镉复合胁迫对细胞膜透性、光能捕获及传递、渗透调节物质的影响;第2主成分贡献率为29.788%,指标包括qP、SP含量、Fo和ETR,反映铅、镉复合胁迫对光能的传递及转换和渗透调节物质的影响.综上所述,MDA含量、植物组织含水量、Chl含量、SS含量和荧光参数Fv/Fm、qP载荷量较大,是最能反映紫金牛对铅、镉复合胁迫生理响应的鉴定指标.
根据2个主成分系数,得到y1、y2的线性组合:
y1=0.408x1-0.202x2+0.396x3+0.114x4+0.329x5+0.408x6+0.396x7-0.024x8-0.437x9
y2=0.068x1+0.505x2+0.081x3-0.538x4+0.418x5+0.012x6+0.007x7+0.514x8+0.068x9
分别以两个主成分的贡献率为权重,构建主成分综合模型表达式:
Z=0.540 7y1+0.297 9y2
把不同铅、镉复合胁迫处理下的两个主成分值代入上式,求出不同处理下各指标的综合得分.除CK(1.746)外,C1P1(0.829)、C3P1(0.357)处理时主成分综合得分较高,说明轻度铅、镉或轻度铅、重度镉复合胁迫对紫金牛各项指标的影响较小;C1P3(-0.205)、C2P2(-0.784)的主成分综合得分次之,说明铅、镉复合胁迫浓度升高,对紫金牛各项指标的抑制作用加强;综合得分最低的是C3P3(-1.944),说明重度铅、镉复合胁迫严重抑制了紫金牛的生长.

表11 铅、镉复合胁迫下紫金牛的各指标相关性分析1)Table 11 Correlation analysis of the indexes of A.japonica under Pb-Cd combined stress
3 讨论

表12 铅、镉复合胁迫下紫金牛各指标主成分分析Table 12 Principal component analysis of the indexes of A.japonica under Pb-Cd combined stress
Chl含量的高低可以影响植物对光能的捕获能力,并能反映植物受重金属胁迫的毒害程度[23].紫金牛在铅、镉复合胁迫下,体内的Chl含量整体呈先上升后下降再上升的趋势,说明短期内的铅、镉复合胁迫能刺激紫金牛合成Chl;胁迫60 d后,轻度铅、镉复合胁迫下紫金牛的Chl含量高于对照组,而重度铅、镉复合胁迫下Chl含量显著低于对照组,这与李全超等[24]对多花水仙(Narcissustazetta)的研究结果一致.这说明轻度铅、镉复合胁迫对Chl合成有促进作用,而重度铅、镉复合胁迫打破了紫金牛的生理平衡,Chl合成酶活性受到抑制而分解加快,不利于光能的捕获[25].有研究表明,Fo、Fv/Fm、qP、ETR均与植物对重金属污染的耐性有关[26-27].胁迫60 d后,轻度及中度铅、镉复合胁迫下,紫金牛Fo均显著低于对照组,qP则显著高于对照组,说明轻度及中度铅、镉复合胁迫能刺激传递电子增多,植株通过增加热耗散来进行自我保护,促进光合作用.重度铅、镉复合胁迫下,紫金牛Fo显著上升,可能是由于重金属离子破坏了PSⅡ反应中心,导致电子传递受阻,光能的转化及传递受到抑制[28-29].而重度铅、镉复合胁迫下,紫金牛的Fv/Fm、qP和ETR整体上呈下降趋势,在胁迫60 d后降至最低,说明重度铅、镉复合胁迫降低了PSⅡ反应中心光化学转换效率,这与张方静等[30]对月季(Rosachinensis)及赖金莉等[31]对鼓节竹(Bambusatuldoides‘Swolleninternode’)的研究结果一致.
处理60 d后,轻度铅、镉复合胁迫及轻度铅、重度镉复合胁迫下,紫金牛的植物组织含水量虽有下降,但与对照组差异不显著;重度铅、轻度镉复合胁迫下,紫金牛的植物组织含水量下降显著,与赖小连等[32]对黄檀(Dalbergiahupeana)幼苗的研究结果一致.这说明重度铅、轻度镉复合胁迫会导致植物细胞吸水困难,引起渗透胁迫和水分亏缺.有研究表明,植物在重金属胁迫环境中,细胞会通过积累SS、SP等渗透调节物质调节细胞内的渗透势,增强自身的抗逆性[33-34].在铅、镉复合胁迫初期,紫金牛的SP含量上升,SS含量在轻度铅、镉复合胁迫和轻度铅、重度镉复合胁迫下先下降后稍有回升,但均随着胁迫时间的延长而逐渐降低.这说明胁迫短期内紫金牛能通过SS和SP的积累调节细胞的渗透势,但因胁迫时间过长而超过植物本身承受能力后,SS和SP的积累趋于减慢和停止[30].在轻度及中度铅、镉复合胁迫下,紫金牛的MDA含量呈先上升后下降的趋势;重度铅、镉复合胁迫下,MDA含量持续上升.这说明当植物受到重金属胁迫后,MDA大量生成,植物细胞受过氧化损伤加剧,后期重金属胁迫刺激植物体内的保护酶系统清除活性氧自由基,使MDA浓度下降,而随着胁迫浓度持续升高,植物受到的胁迫加剧,超过了保护酶系统清除限度,导致MDA含量持续上升[35-36].
对各项指标的综合分析表明,铅、镉复合胁迫与紫金牛的生理指标MDA含量、植物组织含水量、Chl含量、SS含量及荧光参数Fv/Fm和qP之间具有较强的相关性,这些指标可以较好地评价紫金牛对铅、镉复合胁迫的响应规律.
综上所述,轻度Pb(800 mg·kg-1)和轻度Cd(100 mg·kg-1)复合胁迫60 d后促进了植物生长;轻度Pb(800 mg·kg-1)和重度Cd(500 mg·kg-1)复合胁迫下植物生长良好;中度Pb(2 000 mg·kg-1)和中度Cd(200 mg·kg-1)复合胁迫与重度Pb(3 000 mg·kg-1)和轻度Cd(100 mg·kg-1)复合胁迫下紫金牛生长受到影响;重度Pb(3 000 mg·kg-1)和重度Cd(500 mg·kg-1)复合胁迫下紫金牛生长受到明显抑制,30 d后植株个体出现死亡.可见,紫金牛在Pb浓度<800 mg·kg-1且Cd浓度<500 mg·kg-1的胁迫环境下表现较强的耐受能力,可用于该浓度铅、镉复合污染土壤的修复,改善环境质量.
