响应面法优化恩替卡韦微球的制备及体外释药
2021-05-27李志明王爱萍孟庆国梁荣财
钟 薇,苏 颖,李志明,王爱萍, 2,孟庆国,梁荣财, 2
(1.烟台大学药学院,烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心,分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005;2.山东绿叶制药有限公司长效和靶向制剂国家重点实验室,山东 烟台 264003)
全世界曾经感染过乙肝病毒的人高达13亿人,其中约2.57亿人发展为慢性乙型肝炎[1-2]。恩替卡韦作为治疗慢性乙肝的一线用药,具有很好的抗病毒治疗效果以及较低的耐药率,但其不能直接消灭乙肝病毒,只能抑制乙肝病毒DNA复制[3],因此,患者需长期用药来控制疾病发展。另外,恩替卡韦需要每日空腹服药,这会引起胃肠道副反应,导致患者依从性差,常有患者自行停药的情况发生,这可能会导致乙肝病毒反跳,进一步加重肝脏损害[4],造成病情恶化。因此,将恩替卡韦开发成长效缓释制剂很有意义。
微球是目前研究较多的药物控释系统,与口服剂型相比,其优势明显,如减少给药次数、提高患者依从性、延长药物作用时间、提高药效等[5-7]。聚乳酸-羟基乙酸共聚物(PLGA)是微球给药系统中最常用的生物可降解材料,由于其具有良好的生物相容性、可调节的机械性能以及良好的成膜性[8],使这种聚合物适用于药物控释系统。
在本研究中,以PLGA为微球载体材料,采用S/O/W乳化-溶剂挥发法制备恩替卡韦PLGA微球,采用Box-Behnken响应面法对工艺参数进行优化,筛选出最优处方;对微球的载药量、包封率、粒径以及其表面形貌进行评价,并考察其体外释放行为。
1 实验部分
1.1 仪器与试剂
恩替卡韦一水合物(济南宏方德医药科技有限公司);PLGA(8515 DLG 5A,Lakeshore公司);二氯甲烷(国药集团化学试剂有限公司,分析纯);甲醇(德国Merck公司,色谱纯); PVA(德国EMD公司);吐温80(南京威尔化工有限公司);磷酸盐缓冲液(PBS, 福州迈新生物技术开发有限公司)。
1.2 恩替卡韦微球的制备
将PLGA溶于10 mL二氯甲烷中,搅拌使其溶解,形成油相(O),加入恩替卡韦原料药,形成S/O悬浮液, 6000 r/min均质20 s使其充分混匀后,缓慢加入到PVA水溶液中, 1000 r/min高速剪切3 min形成软球,转移至机械搅拌器内继续以300r/min的速度搅拌5 h以固化微球,将所得溶液以100目+1200目过滤收集微球,并用去离子水冲洗3遍,放入冷冻干燥机中冻干即得恩替卡韦微球。
1.3 Box-Behnken响应面法优化微球制备
在本课题组之前实验的基础上,采用三因素三水平优化处方。将PLGA质量浓度、PVA体积分数、水油比作为自变量,将载药量、包封率、粒径作为响应。每个自变量选取三个水平,编码为-1(低)、0(中)、+1(高),如表1所示。

表1 响应面法的自变量选取及其水平
1.4 高效液相色谱法条件
使用Agilent C18分析柱(4.6 mm×25 cm,5 μm),流动相A(甲醇)∶流动相B(水)=20∶80,流速为1 mL·min-1,进样体积为20 μL,柱温为40 ℃,紫外检测波长为254 nm。恩替卡韦的保留时间为5 min,记录其峰面积。
1.5 微球载药量及包封率的测定
精密称取恩替卡韦微球10 mg,置于50 mL离心管中,加入2 mL二氯甲烷,超声使其溶解,加入30 mL流动相,以3600 r/min的速度离心10 min,吸取上清液,按“1.4”项下高效液相色谱法进行微球载药量的测定。微球的载药量和包封率分别以下式计算:
载药量=微球中恩替卡韦的质量/微球总质量×100%,
包封率=实际载药量/理论载药量×100%.
Model Builder在建设用地报批线状地物面积自动扣除中的应用 张海龙,赵耀龙,叶 璐(3-8)
1.6 微球表面形态及粒径的测定
使用扫描电子显微镜观察微球的表面形貌。将微球固定于导电胶上,喷金后放入扫描电子显微镜中观察。
使用马尔文3000粒度分析仪测定粒径。以0.1%吐温20溶液为分散介质,加入微球后使其分散混匀。平行测定3次,取其平均值作为测量结果。
1.7 微球体外释放的测定
将10 mg恩替卡韦微球置于15 mL离心管中,加入10 mL PBS缓冲液(pH值7.4,10 mmol/L)。将离心管放入37 ℃恒温水浴振荡器中,以50 r/min的速度震荡。分别在30 min、1 h、3 h、6 h、10 h、1 d、2 d、3 d、4 d、6 d、8 d、10 d、13 d、15 d、17 d、20 d、23 d、27 d、31 d、34 d、38 d、41 d、45 d、50 d、55 d、59 d取出离心管,以3600 r/min的速度离心10 min,取出9 mL上清液,同时补入等量的新鲜释放介质。按“1.4”项下高效液相色谱法测定上清液中的药物含量,计算其释放度。以累计释放百分比对其时间作图,得到药物的累计释放曲线。
1.8 微球的释放动力学研究
分别使用零级、一级、Higuchi方程和Korsmeyer-Peppas方程对释药曲线进行拟合,以确定恩替卡韦微球的释药机理。
2 实验结果与讨论
2.1 微球处方优化及结果
采用三因素三水平Box-Behnken设计对处方参数进行优化,17次实验结果如表2所示。使用Design-Expert软件对实验数据进行拟合,其多项式模型如下所示:
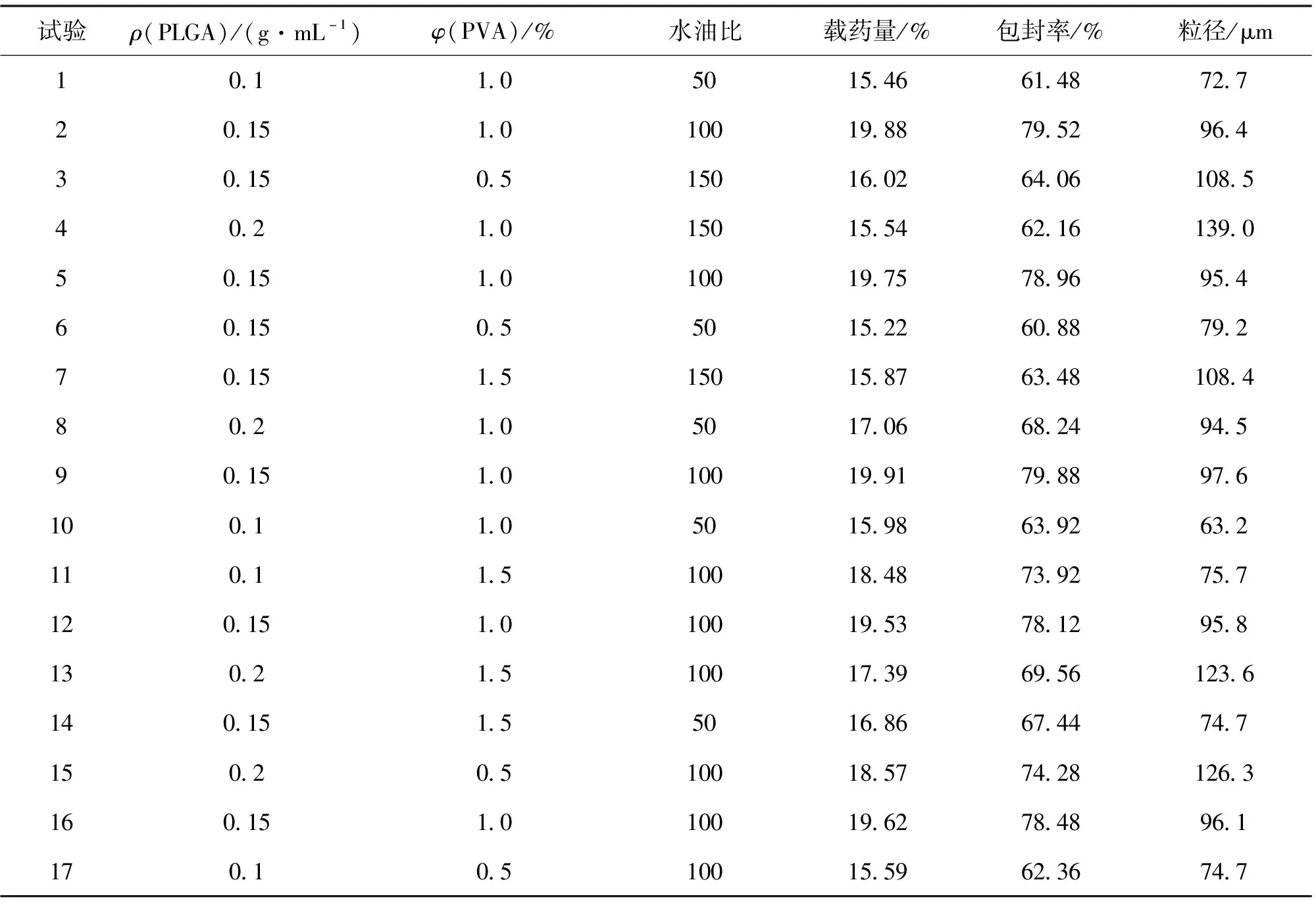
表2 Box-Behnken设计及其结果
(1)载药量模型Y1:
Y1=19.74+0.38A+0.40B-0.28C-1.02AB-0.25AC-0.45BC-1.11A2-1.12B2-2.62C2。
(2)包封率模型Y2:
Y2=78.99+1.52A+1.60B-1.12C-4.07AB-1.00AC-1.79BC-4.45A2-4.52B2-10.51C2。
(3)粒径模型Y3:
Y3=96.26+24.64A-0.79B+14.63C-0.93AB+8.75AC+1.1BC+1.73A2+2.08B2-5.64C2。
采用方差分析检验模型是否具有统计学意义,在0.05显著性水平下进行检验,其结果如表3所示。F值越大,P值越小,说明该模型越具有统计学意义。从表3可知,Y1、Y2、Y3的F值均较大,P值均小于0.000 1,说明该模型极具有统计学意义。模型失拟项的P值均大于0.05(分别为0.054 6、0.074 6、0.065 6),表明失拟项不显著,由此证明该模型可信度较高。Y1、Y2、Y3的R2值均大于0.8(分别为0.988 3、0.987 9、0.998 0),说明实验结果与预测结果之间有良好的相关性。综上所述,该模型精密度和可靠性较高。
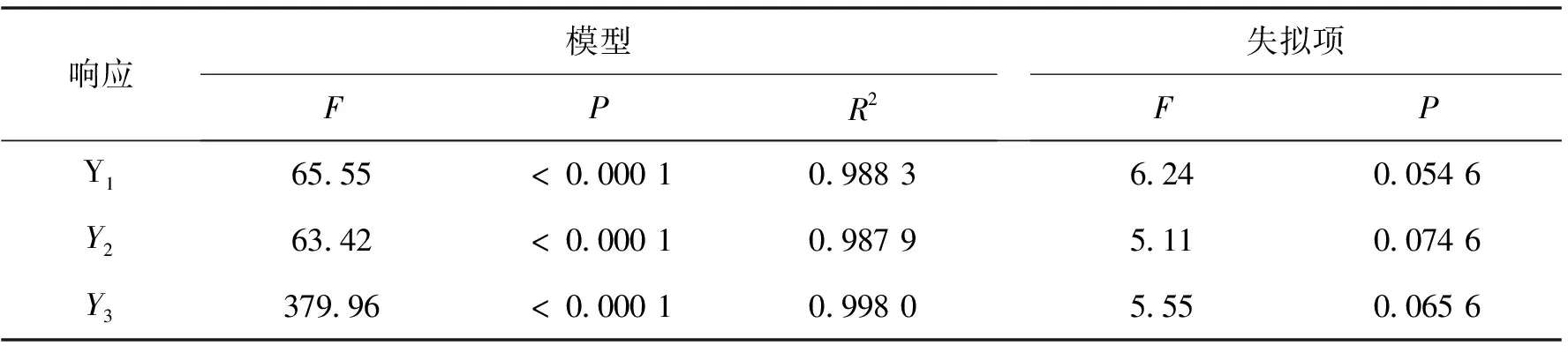
表3 Box-Behnken设计的方差分析
图1为载药量模型的三维响应曲面图。由图1可知,载药量随着ρ(PLGA)和φ(PVA)的升高而增加。这可能是因为当ρ(PLGA)增加时,有机相的粘度也增加,较高的有机相粘度会使PLGA液滴快速凝固,从而减少药物向水相中渗漏[9-10]。PVA作为O/W的乳化剂,浓度的增加确保了更稳定的乳化体系生成,减少药物的损失。
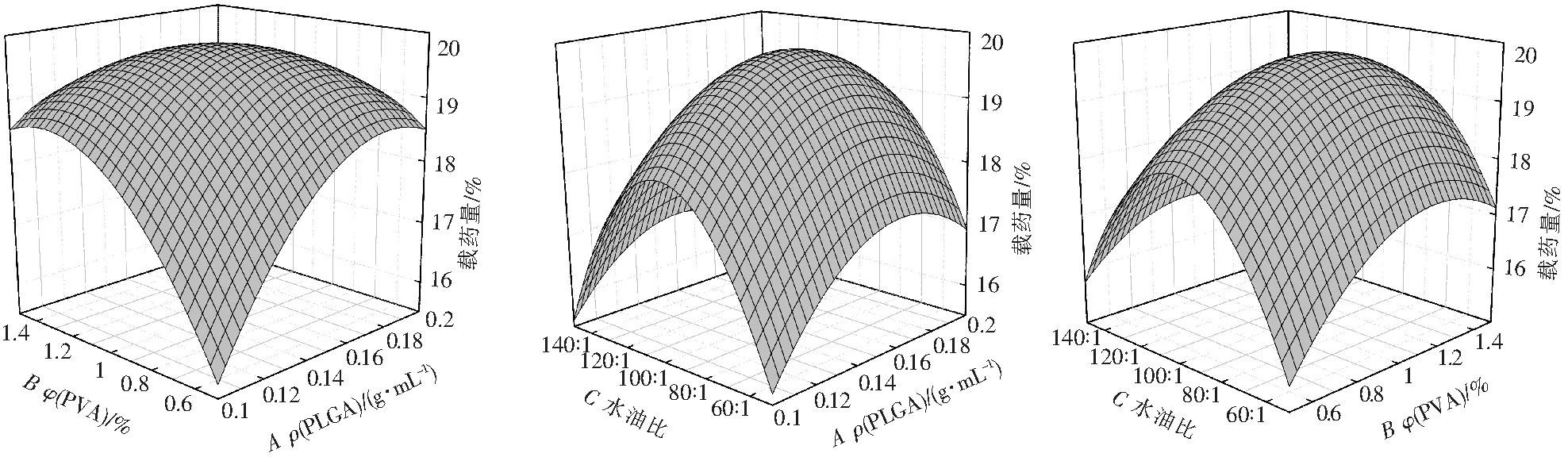
图1 载药量模型的三维响应面图
图2为包封率模型的三维响应曲面图。由图2可知,其变化趋势与载药量模型基本一致。因为包封率的测定是以实际载药量与理论载药量的比值确定的,而在17次实验中理论载药量均不变。
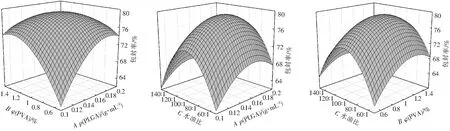
图2 包封率模型的三维响应面图
图3为粒径模型的三维响应曲面图,由图3可知,微球的粒径随着ρ(PLGA)和水油比的增加而增大。当ρ(PLGA)较高时,形成初乳所需的能量大。这意味着当均质速度相同时,ρ(PLGA)高的处方将产生更大的粒径[11]。此外,由于ρ(PLGA)的增加,在乳化和微粒形成的过程中可能会发生碰撞,导致液滴聚集,粒径增大[12]。由于油相体积不变,当水油比增加时,溶液的整体体积增加,在均质速率不变的情况下,剪切效率下降,从而产生较大粒径的微球。
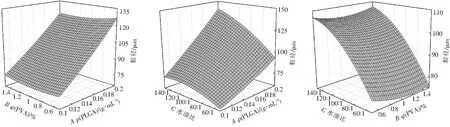
图3 粒径模型的三维响应面图
载药量、包封率、粒径是微球评价的重要指标,从响应面分析结果来看,伴随着微球载药量的提高,粒径也相应的增大,以至于不能满足注射要求。因此,选择最大载药量和包封率、最小的粒径作为优化指标,得到的最优制备处方为:PLGA质量浓度(A)为0.13 g·mL-1,PVA体积分数(B)为1.2%,水油比(C)为91∶1,载药量为19.56%,包封率为78.28%,粒径为85.3 μm。
制备了3批以最优条件为处方的平行样品,其结果如表4所示。由表4可以看出,验证实验结果与其预测值非常接近,误差较小,由此证明了该模型的准确性,说明可以利用此模型进行恩替卡韦微球的优化。
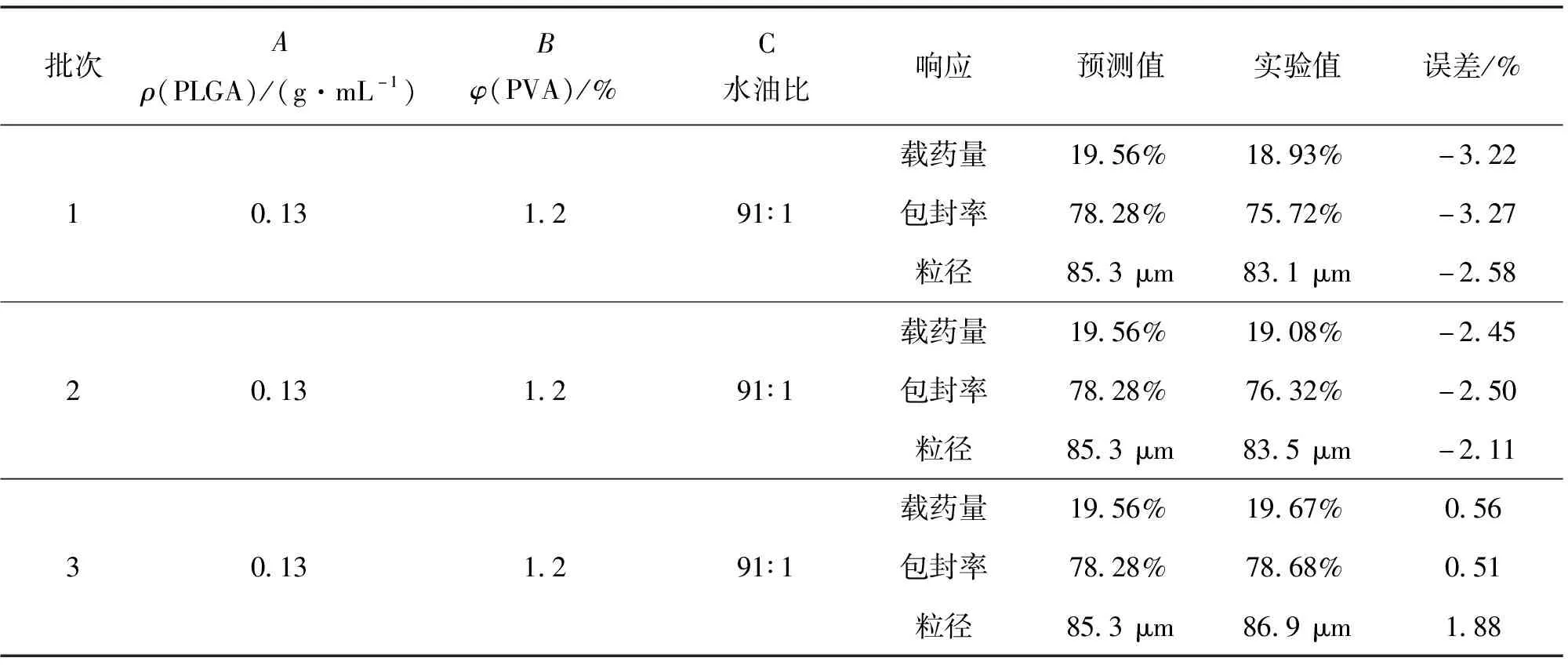
表4 模型的实验值与预测值的比较
2.2 微球的表面形态
使用扫描电子显微镜对优化后的恩替卡韦微球的表面形态进行了观察,其表面形态如图4所示。恩替卡韦微球呈球形,结构致密无孔,表面附着的微晶粒子可能是在制备过程中没有被包载的原料药,球体表面呈光滑态。

图4 恩替卡韦微球的表面形态
2.3 微球的体外释放
恩替卡韦微球在PBS缓冲液中的释放情况如图5所示。恩替卡韦微球的释放呈双相,先是一段快速释放时期,在13 d后进入缓慢释放阶段,一直持续到第59天,释放结束。第一阶段的快速释放可能是因为制备过程中溶剂对流导致微球表面附近药物浓度增加[13]。第二阶段的释放较第一阶段相对缓慢,因为这一阶段的释放主要是由PLGA降解所控制的。随着时间的延长,PLGA逐渐水解为低聚物或单体产物,微球表面和内部形成孔道,这为微球内部的药物通过扩散和侵蚀释放提供了条件[8]。
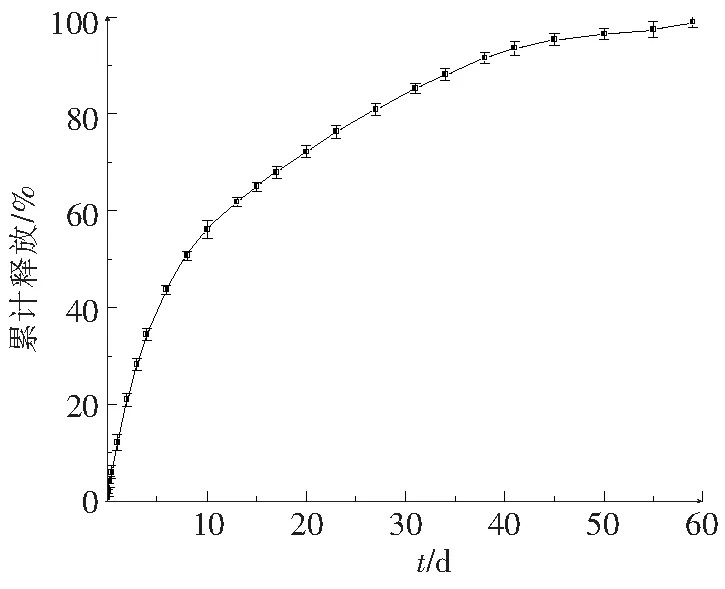
图5 恩替卡韦微球在37 ℃ PBS缓冲液中的释放情况
2.4 微球的释放动力学研究
为了研究恩替卡韦微球的释药机理,分别采用零级动力学方程、一级动力学方程、Higuchi模型以及Korsmeyer-Peppas模型对释药曲线进行拟合,其结果如表5所示。R2越接近于1,说明该模型能更好地拟合微球的释放行为。一级动力学方程、Higuchi模型以及Korsmeyer-Peppas模型均能较好地拟合释放曲线,但相比而言,一级动力学方程更适合解释恩替卡韦微球的释药机理(R2=0.990 1)。说明恩替卡韦在微球中的转运速率是有限的且呈浓度依赖性[14-15]。

表5 恩替卡韦微球的释放动力学参数
3 结 论
本研究成功制备了恩替卡韦微球,并对其制备工艺参数进行了优化。最终得到的最优处方为:PLGA质量浓度为0.13 g·mL-1,PVA体积分数为1.2%,水油比为91∶1。对该实验条件进行验证,制备的3批微球载药量为(19.23±0.32)%,包封率为(76.91±1.28)%,平均粒径为84.5 μm。在最佳条件下制备的微球的实验值与预测值基本接近,说明响应面法可用于优化恩替卡韦微球的制备条件。扫描电子显微镜显示微球呈球形,结构致密,表面光滑。恩替卡韦微球释放一直持续到第59天,表明该微球具有很好的缓释效果。
