慢性光损伤皮肤细胞中可调控cathepsin D的LncRNAs筛查及靶向位点结合研究
2021-05-27徐维春侯文意赖维郑跃
徐维春, 侯文意, 赖维, 郑跃
1.中山大学附属第三医院粤东医院,广东 梅州 514700;2.中山大学附属第三医院皮肤科,广东 广州 510620
皮肤光老化(慢性光损伤)是由于长期暴露于紫外线辐射所引起的皮肤损害,不仅影响容貌,还可造成皮肤完整性及免疫系统的损害,引发光线性肉芽肿等多种光相关疾病,甚至可导致基底细胞癌、鳞状细胞癌和恶性黑素瘤等皮肤肿瘤[1],但具体机制目前未明。有研究发现组织蛋白酶D(cathepsin D)在慢性光损伤皮肤中的表达减少[2],cathepsin D凝胶可以增加角质层中组织蛋白酶D的含量,修复重复光损伤皮肤的表皮屏障[3],但在皮肤慢性光损伤过程中,cathepsin D上游非编码RNA(non-coding RNA, ncRNA)调控机制,以及如何能更稳定、高效、特异地调控cathepsin D来防止皮肤慢性光损伤的发生,目前仍不清楚。本研究筛查慢性光损伤皮肤细胞中对cathepsin D具有调控作用的长链非编码RNA(long non-coding RNA, LncRNAs),并探讨其在皮肤光老化机制中的作用,为进一步揭示皮肤光老化中非编码RNA的网络作用机制提供基础。
1 材料与方法
1.1 材料
1.1.1 皮肤成纤维细胞 来自中山大学附属第三医院泌尿外科3例儿童(5~7岁)包皮环切术后包皮组织。本研究通过中山大学附属第三医院医学伦理委员会批准(批准号[2016]2- 44),患儿家属均签署知情同意书。
1.1.2 试剂和仪器 DMEM高糖培养基、胰蛋白酶、胎牛血清、磷酸盐缓冲液(PBS)、青-链霉素(美国Gibco公司),细胞衰老半乳糖苷酶(SA-β-Gal)试剂盒(美国Cell signaling technology公司),细胞凋亡试剂盒(南京凯基生物科技发展有限公司),RNA逆转录试剂盒(日本TaKaRa公司),RNA检测试剂盒(美国Agilent Technologies公司),核酸纯化试剂盒(北京艾德科技有限公司),二代测序 RNA 文库制备试剂盒(美国Beckman Coulter公司)。UVA紫外线照射仪(Sigma SS-03A,灯管为Philips UVATLl0RS,波长320~400 nm)、UVA照射计(上海希格玛高科技有限公司),NanoPhotometer®分光光度计(美国IMPLEN公司),荧光定量仪 Qubit®3.0 Flurometer。
1.2 方法
1.2.1 原代皮肤成纤维细胞培养 取儿童包皮,参照文献[4]分离培养皮肤成纤维细胞,培养至第3代冻存,取细胞复苏后10代以内的细胞行后续实验。
1.2.2 建立皮肤成纤维细胞慢性光损伤模型 细胞分为UVA照射组(连续)和空白对照组(不照射),将3~6代成纤维细胞按1×106/皿接种于直径6 cm的细胞培养皿,待细胞长到70%融合时,弃培养液,PBS洗涤2次后,加2 mL PBS。参照文献[4-6],将UVA照射组细胞置于UVA辐照仪下,细胞距离光源15 cm,平均照射功率为12.7 mW/cm2,设置单次照射时间为780 s,照射剂量为9.9 J/cm2,照射结束后PBS洗涤1次,加入2 mL的DMEM培养基,每24 h照射1次,连续照射14 d。空白对照组细胞加入PBS后置于超净台避光,在DMEM培养基中培养14 d。
1.2.3 β-半乳糖苷酶染色检测细胞老化率 末次UVA照射后48 h去除DMEM培养基,PBS洗涤1次,按照试剂盒说明书检测细胞老化。显微镜下观察结果,老化细胞胞质被染成蓝色,每皿至少计数500个细胞,计算阳性细胞所占百分比。实验重复3次,取均值。
1.2.4 流式细胞仪检测细胞凋亡率 末次UVA照射后,用胰蛋白酶消化细胞,调整细胞为1×106/mL。每组取1 mL细胞,预冷PBS洗涤3次后细胞重悬于200 μL结合缓冲液。加入10 μL膜联蛋白V异硫氰酸荧光素及10 μL碘化丙锭,4 ℃反应30 min。加入300 μL结合缓冲液,流式细胞仪检测细胞凋亡率(早期凋亡率+晚期凋亡率)。实验重复3次,取均值。
1.2.5 表达基因谱建库 对UVA照射组和空白对照组细胞,分别使用RNA逆转录试剂盒,将全部基因完整转录为总RNA,使用分光光度计检测样品的纯度和粗浓度,随后荧光定量检测RNA样品准确浓度,RNA检测试剂盒检测RNA样品完整性。上述检测合格后,对照组及UVA照射组使用DNase Ⅰ处理,去除rRNA以富集mRNA和non-coding RNA,富集的mRNA和non-coding RNA随机打断成短片段(200~500 bp), 以打断后的短片段为模板,用六碱基随机引物合成cDNA第一链,在合成cDNA第二链时,用dUTP替代dTTP, 然后合成的cDNA经过末端修复、加A、加测序接头后,加入UNG(Uracil-N-Glycosylase) 降解第二链,通过琼脂糖凝胶电泳进行片段大小选择后进行PCR扩增,最后建好的测序文库用Illumina 测序平台进行测序。
1.2.6 差异表达LncRNA检测 参照Audic S.等[7]基于测序的差异基因检测方法检测差异表达的LncRNA基因。将得到的P值进行多重假设检验校正,通过控制 FDR 来决定P值的阈值。
1.2.7 LncRNA功能注释分析 采用Gene Ontology(GO) database (http:∥www.geneontology.org)数据库对差异表达的LncRNA进行注释分析,提取可调控cathpeisn D的LncRNA。
1.2.8 LncRNA-miRNA调控检测 用miRanda (http:∥www.microrna.org/)和TargetScan (http:∥www.targetscan.org/)生物学软件对慢性紫外线损伤细胞miR4298进行表达验证,并对LncRNAs可靶向作用的miRNA预测分析。
1.3 统计学方法
采用SPSS 22.0软件,UVA照射组与空白对照组间细胞活性、细胞老化率、凋亡率比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 皮肤成纤维细胞慢性光损伤模型的建立
UVA照射组细胞体积变大,细胞内颗粒增多,出现慢性光损伤表型(图1)。CCK8检测结果显示UVA照射组细胞活性[(60.02±5.13)%]明显低于对照组[(89.06±4.21)%],t=2.31,P<0.05。 β半乳糖苷酶染色结果显示,UVA照射组细胞老化率[(85.24±4.21)%]高于对照组[(8.16±1.62)%],t=3.22,P<0.05,见图2。流式细胞仪检测细胞凋亡率结果显示,UVA照射组细胞凋亡率[(26.04±7.42)%]高于对照组[(11.31±4.95)%],t=3.54,P<0.05,见图3。

图1 UVA照射组细胞(1A)与对照组细胞(1B)相比,体积变大,细胞内颗粒增多,胞质蓝染,出现慢性光损伤表型Fig.1 Compared with the control group (1B), UVA group (1A) cells had larger volume, more intracellular granules, blue staining of cytoplasm, and chronic light damage phenotype.

图2 UVA照射组细胞(2A)较对照组细胞(2B)β-半乳糖苷酶染色阳性率增高Fig.2 The positive rate of β-galactosidase staining in UVA group (2A) was higher than that in control group (2B).

图3 流式细胞检测示UVA照射组(3A)细胞凋亡率较对照组细胞(3B)增高Fig.3 Flow cytometry showed that the apoptosis rate of UVA group (3A) was higher than that of control group (3B).
2.2 可调控cathepsin D的差异表达LncRNAs
应用高通量测序技术筛选慢性光损伤成纤维细胞与相应对照组之间差异表达的LncRNA,进而筛查出可调控cathepsin D且存在差异表达的LncRNA共有25个,其中表达差异较明显的是Lnc-CTSD、Lnc-TNNI1和Lnc-RP11-706015.1.1-3,详见表1。
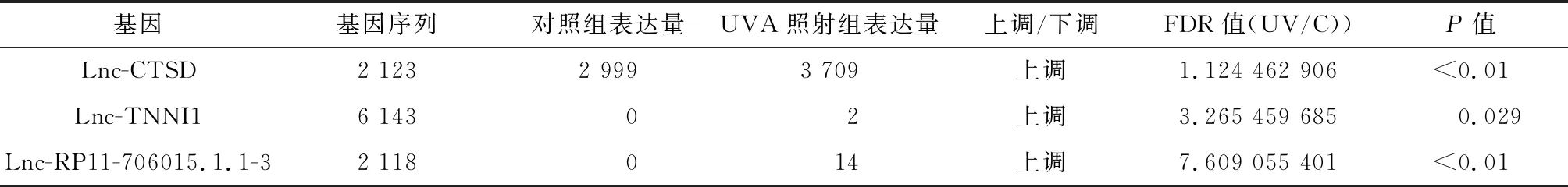
表1 可调控cathepsin D的差异表达LncRNAsTab.1 LncRNAs of differential expression of regulated cathepsin D
2.3 LncRNAs通过靶向结合miR4298发挥调控作用
通过miRanda和TargetScan分析发现在慢性紫外线损伤细胞中, LncRNA-CTSD、Lnc-TNNI以及Lnc-RP11均通过与miR4298靶向结合发挥下游调控作用(表2)。

表2 慢性紫外线皮肤损伤细胞hsa-miR- 4298海绵吸附的LncRNAsTab.2 LncRNAs of adsorption of cells hsa-miR- 4298 sponges from chronic ultraviolet skin injury
3 讨论
近年来,借助转化医学手段,非编码RNA,包括LncRNA以及miRNA,作为一种新兴的治疗技术已迈进临床试验阶段。利用miRNA、LncRNA及circRNA等非编码RNA来调控cathepsins基因的表达,是目前最热门和最有应用前景的技术,已被广泛应用于基因功能调控和疾病干预等方面的研究,有些甚至已被利用开发出治疗药物。2014年,Grammatikakis等[8]指出,LncRNAs表达变化是细胞衰老分子标志的里程碑。郑跃等[9]前期研究发现在皮肤光老化成纤维细胞中,有2 261个LncRNA有差异表达,并建立了光老化相关 LncRNA差异表达库等。
cathepsin D是一种与表皮分化有关的蛋白质,在反复紫外线照射后皮肤损伤和皮肤屏障变化中起重要作用。cathepsins是溶酶体内最重要的蛋白水解酶家族之一,研究证实家族中的cathepsin D在溶酶体内含量最丰富(溶酶体内浓度高达1 mM),cathepsin B 和cathepsin L酶原转化为活性酶均有赖于cathepsin D催化,因此,cathepsin D 被称为溶酶体“管家酶”。近年来的多项研究都已经证明了cathepsin D家族在各器官系统细胞的自噬及水解过程中的重要作用。2015年Ma等[10]发现cathepsin D直接参与并调控细胞自噬,进而调控AGEs在溶酶体内的降解,且AGEs 在溶酶体酸性环境中变性后更易与蛋白水解酶的肽键结合被降解[4]。本研究发现光老化细胞中Lnc-CTSD、Lnc-TNNI和Lnc-RP11表达上调,其表达基因与cathepsin D基因编码序列非常接近,提示Lnc-CTSD、Lnc-TNNI和Lnc-RP11可能是UVA损伤皮肤组织蛋白酶表达变化的上游调节因子。
miR4298是一种人源microRNA,其已经用于开发临床疾病治疗评估及预后试剂盒[5-6]。刘玉芳等[11]前期在进行光老化LncRNAs调控cathepsins研究时还发现,光老化特异性LncRNAs需要与microRNA结合,发挥下游效应,并发现靶向结合的microRNA-hsa-miR- 4298。hsa-miR- 4298是一种人源microRNA,已经被用于开发临床疾病治疗评估及预后试剂盒。An等[5]研究发现肿瘤组织中表达的hsa-miR- 4298是胃癌预后的标志。Chen等[6]研究发现,乳腺癌组织中表达的hsa-miR- 4298是肿瘤治疗耐药性及预后的标志之一。本研究通过信息学筛查,发现可调控cathepsin D的Lnc-CTSD、Lnc-TNNI和Lnc-RP11具有一个共同的靶向结合miroRNA:hsa-miR- 4298。提示hsa-miR- 4298可能通过结合Lnc-CTSD、Lnc-TNNI和Lnc-RP11调控cathepsin D参与皮肤慢性光损伤发生,但具体调控机制仍需进一步研究。
综上所述,本研究发现,反复UVA照射可上调皮肤成纤维细胞中cathepsin D的调控LncRNAs,Lnc-CTSD、Lnc-TNNI1和Lnc-RP11-706015.1.1-3均通过与miR4298靶向结合发挥作用,可能通过microRNA-LncRNA-cathepsin D机制参与皮肤光老化发生。相信随着 LncRNA、microRNA、cathepsin D与光老化机制的阐明,可更好地为研发更新、更稳定、靶向性更强的皮肤光老化及日光相关性皮肤病(包括皮肤肿瘤)相关的分子标记物靶点提供依据,并能据此开发小分子药物用于光老化及相关皮肤病的预防和治疗,为其诊断和治疗提供新契机。
