广东省甘蔗褐斑病菌(Cercospora longipes)的生物学特性
2021-05-26高小宁孙辉李婷齐永文
高小宁 孙辉 李婷 齐永文

摘要:以广东省甘蔗褐斑病菌(Cercospora longipes)CL12分离株为对象,研究了温度、pH值、培养基种类、不同碳源和氮源对菌株菌丝生长和分生孢子萌发的影响,为进一步研究甘蔗尾孢引起的褐斑病的发生规律和防治药剂筛选奠定基础。结果表明,CL12分离株的菌丝在供试的10种培养基上都可以生长,但表现出较大差异;其中PDA和PSA培养基有利于菌丝生长,而MS和N6培养基不适合该菌生长。以Czapek培养基作为基础,果糖作为碳源、牛肉膏和酵母粉作为氮源最适宜病菌的菌丝生长。菌丝生长的温度范围为5~35 ℃,最适温度为25 ℃;菌丝生长最适pH值为5,在pH值为4.0~10.0均可生长;分生孢子萌发的温度范围为15~35 ℃,pH值为4.0~10.0,最适萌发条件为 25 ℃,pH值为6.0。
关键词:甘蔗;甘蔗尾孢菌;培养特性;孢子萌发;碳源;氮源
中图分类号:S435.661 文献标志码: A
文章编号:1002-1302(2021)07-0115-04
收稿日期:2020-07-15
基金项目:广东省科学院研究所绩效考核引导专项(编号:2020GDASYL-20200302005);广东省甘蔗剑麻产业技术体系创新团队项目(编号:2019KJ104-05);广东省重点领域研发计划(编号:2019B020238001)
作者简介:高小宁(1978—),女,陕西岐山人,博士,副教授,从事甘蔗病害研究。Tel:(020)34397561;E-mail:gxn336@126.com。
通信作者:齐永文,博士,研究员,从事甘蔗遗传育种研究。Tel:(020)84178036;E-mail:yongwen2001@163.com。
甘蔗(Saccharum spp.)是我国最重要的糖料作物,而病害是影响甘蔗生产的重要因素。目前世界上已经报道的甘蔗病害达130种,我国记录的甘蔗侵染性病害已超过50种[1],其中由真菌引起的褐锈病(brown rust)、梢腐病(pokkah boeng)、褐条病(brown stripe)、褐斑病(brown spot)等叶部病害在我国蔗区发生普遍,对甘蔗生产造成了严重威胁。由甘蔗尾孢(Cercospora longipes E. E. Butler)引起的甘蔗褐斑病[2]于1906年首次在印度发现,目前在世界甘蔗产区广泛分布。褐斑病主要危害甘蔗叶片,发病初期受害叶片呈黄色小斑点,随后扩大形成具有黄色晕圈的长梭形红褐色病斑,田间湿度较大时,叶片背面产生灰色霉层,严重发病可导致叶片提前枯死,呈现“火烧”状,从而给甘蔗生产造成严重损失[3]。褐斑病作为甘蔗的主要叶部病害之一,前期研究人员对该病害在我国不同蔗区的分布和危害情况进行了大量的调查分析,发现该病害在我国蔗区广西、云南、广东、贵州、海南等地广泛分布,常年危害,对甘蔗正常生长产生了一定的影响[4-8],并评价了几种化学药剂对该病害的防治效果,发现苯甲·嘧菌酯对甘蔗褐斑病表现出良好的防效[5]。然而,已有研究中缺少对其病原菌生物学特性的相关报道。
了解病菌的生物学特性是深入理解病害发生规律的基础,进而为病害的有效防控提供理论依据。在前期研究中,笔者从广东省翁源县采集甘蔗褐斑病病样并对其病菌进行分离鉴定和致病性测定,获得1株甘蔗尾孢(C. longipes)分离株CL12。因此,本研究以分离株CL12为对象,研究温度、pH值以及营养条件对其菌丝生长和分生孢子萌发的影响,以期为进一步研究病害发生流行规律,制定防治技术方案奠定基础。
1 材料与方法
1.1 试验材料
供试菌株:甘蔗尾孢(C. longipes)CL12分离株,按常规方法在马铃薯葡萄糖琼脂培养基(PDA)平板上繁殖、保存备用。菌株CL12生物学特性测定试验于2019年在广东省科学院生物工程研究所进行。
供试培养基及其配方:PDA(200 g/L马铃薯、20 g/L 葡萄糖、15 g/L琼脂粉)、PSA(200 g/L马铃薯、20 g/L蔗糖、15 g/L琼脂粉)、MEA(30 g/L麥芽浸粉、3.0 g/L大豆蛋白胨、15 g/L琼脂粉)、CAM(2.0 g/L玉米浸粉、15 g/L琼脂粉)、Czapek(3 g/L NaNO3、1 g/L KH2PO4、0.5 g/L MgSO4·7H2O、0.5 g/L KCl、0.01 g/L FeSO4、30 g/L蔗糖、15 g/L琼脂粉)、LBA(10 g/L NaCl、10 g/L蛋白胨、5 g/L酵母粉、15 g/L琼脂粉)、YPD(20 g/L葡萄糖、20 g/L 蛋白胨、10 g/L酵母粉、15 g/L琼脂粉)、N6[2 830 mg/L KNO3、463 mg/L (NH4)2SO4、166 mg/L CaCl2·2H2O、185 mg/L MgSO4·7H2O、400 mg/L KH2PO4、27.8 mg/L FeSO4·7H2O、4.4 mg/L MnSO4·4H2O、1.6 mg/L ZnSO4·7H2O、0.8 mg/L H2BO3、1.6 mg/L KI、2 mg/L甘氨酸、0.5 mg/L烟酸]、MS[1 900 mg/L KNO3、1 650 mg/L (NH4)2SO4、170 mg/L KH2PO4、370 mg/L MgSO4·7H2O、440 mg/L CaCl2·2H2O、0.83 mg/L KI、6.2 mg/L H2BO3、22.3 mg/L MnSO4·4H2O、8.6 mg/L ZnSO4·7H2O、0.25 mg/L Na2MoO4·2H2O、0.25 mg/L CuSO4·5H2O、0.025 mg/L CoCl2·6H2O、37.25 mg/L Na2EDTA、27.85 mg/L FeSO4·7H2O、100 mg/L肌醇、2 mg/L甘氨酸、0.5 mg/L 烟酸、0.5 mg/L盐酸吡哆醇、0.1 mg/L盐酸硫胺素、30 g/L蔗糖、15 g/L琼脂粉]、WA(15 g/L琼脂)。上述培养中的N6和MS购自Sigma公司,其他培养基均按照配方进行配制;配制好的培养基于灭菌锅中121 ℃湿热高压灭菌20 min后备用。
1.2 营养条件对菌丝生长的影响
1.2.1 不同培养基对菌丝生长的影响 在培养 20 d 的分离株CL12菌落边缘,用灭菌打孔器取直径5 mm的菌饼,分别转接于PDA、PSA、MEA、CAM、Czapek、LBA、YPD、N6、MS和WA等10种不同培养基制成的平板中央。将培养皿置于25 ℃培养箱中恒温避光培养,每处理3次重复。采用“十”字交叉法每7 d测量菌落直径,观察并记录菌落形态[9]。
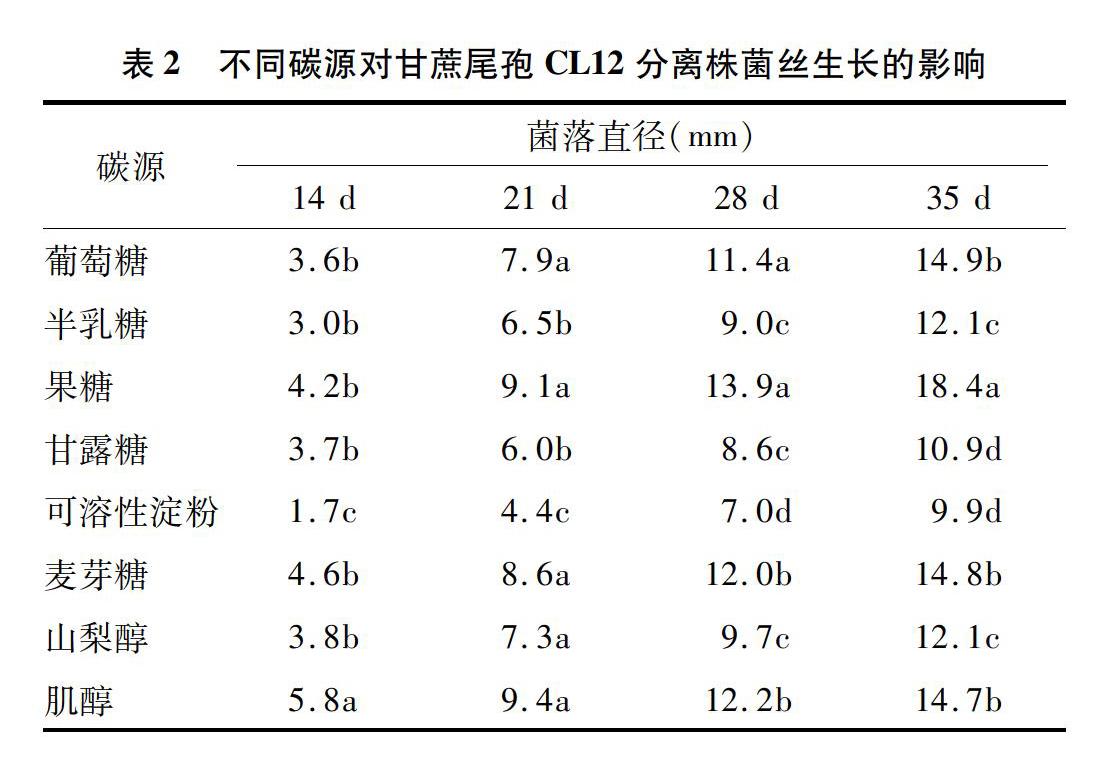
1.2.2 不同碳源对菌丝生长的影响 以Czapek培养基作为基础,分别以等量的葡萄糖、半乳糖、果糖、甘露糖、可溶性淀粉、麦芽糖、山梨醇和肌醇替代其中的蔗糖,制成不同碳源培养基。按照“121”节所描述的方法进行病菌的接种、培养、观察菌落生长情况并测量菌落直径。每处理重复3次。
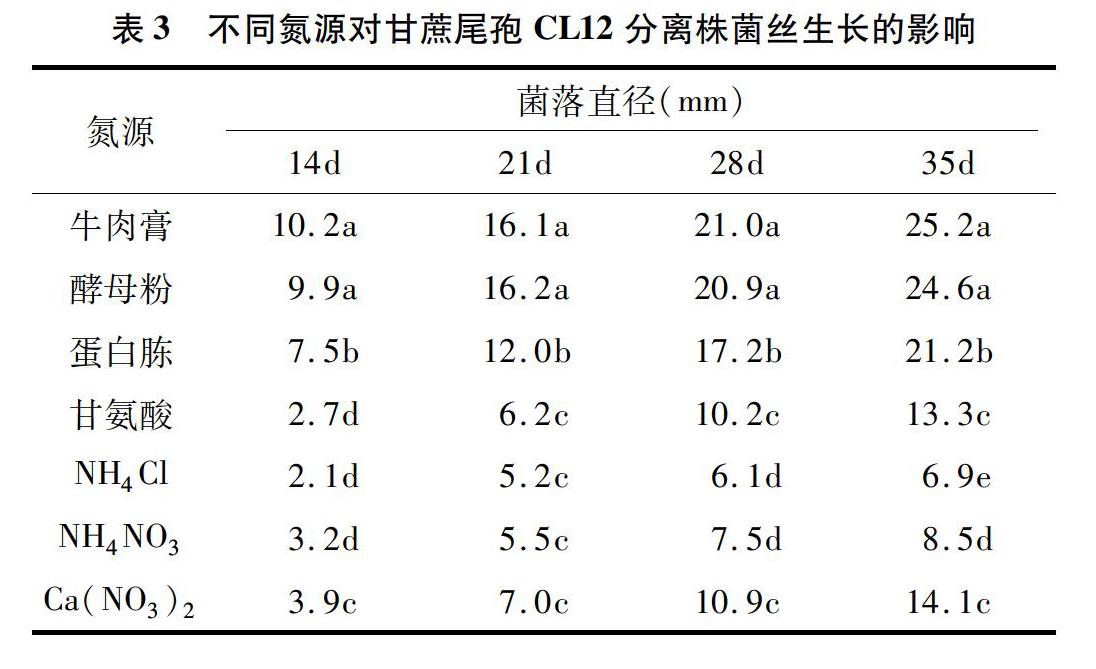
1.2.3 不同氮源对菌丝生长的影响 以Czapek培养基作为基础,分别以等量的牛肉膏、酵母膏、蛋白胨、甘氨酸、NH4Cl、NH4NO3和Ca(NO3)2替代其中NaNO3,制成不同氮源培养基。按照“1.2.1”节所描述的方法进行病菌的接种、培养、观察菌落生长情况并测量菌落直径。每处理重复3次。
1.3 培养条件对菌丝生长的影响
1.3.1 温度对菌丝生长的影响 以PDA作为培养基,将接菌的培养皿分别置于5、10、15、20、25、30、35、40 ℃下培养。按照“1.2.1”节所描述的方法进行病菌的接种、培养、观察菌落生长情况并测量菌落直径。每处理重复3次。
1.3.2 pH值对菌丝生长的影响 用0.1 mol/L HCl和0.1 mol/L NaOH,将PDA培养基的pH值调制成4、5、6、7、8、9、10。按照“1.2.1”节所描述的方法进行病菌的接种、培養、观察菌落生长情况并测量菌落直径。每处理重复3次。
1.4 培养条件对分生孢子萌发的影响
1.4.1 温度对分生孢子萌发的影响 用玉米叶粉碳酸钙琼脂培养基(MLPCA)培养分生孢子,用无菌水配制为每视野(10×40)20~30个分生孢子的悬浮液,采用凹孔载玻片法进行孢子萌发试验[9]。将装有分生孢子悬浮液的凹玻片分别置于5、10、15、20、25、30、35、40 ℃下,于3、6 h镜检分生孢子萌发情况,计算萌发率。每处理重复3次。
1.4.2 pH值对分生孢子萌发的影响 用0.1 mol/L HCl和0.1 mol/L NaOH,将无菌水配制成pH值为4、5、6、7、8、9、10共7个梯度的溶液。按照“1.4.1”节的方法进行分生孢子萌发试验。每处理重复3次。
2 结果与分析
2.1 营养条件对甘蔗尾孢CL12分离株菌丝生长的影响
2.1.1 不同培养基对菌丝生长的影响 由表1可知,甘蔗尾孢菌在供试的10种培养基上均可生长,但生长情况差异较大。从菌落形态和生长速度来看,PDA、PSA、YPD较适宜于甘蔗尾孢的菌丝生长,其次为CAM和MEA;在WA上菌丝极为稀疏,而MS和N6培养基不适合甘蔗尾孢的菌丝生长。
2.1.2 不同碳源对菌丝生长的影响 由表2可知,分离株CL12能够利用多种单糖、多糖和可溶性淀粉作为碳源,不同碳源对其菌丝生长有一定影响。在供试的8种碳源中, 果糖是甘蔗尾孢菌的最佳碳源,葡萄糖、麦芽糖和肌醇次之,其对可溶性淀粉的利用较差。
2.1.3 不同氮源对甘蔗尾孢菌菌丝生长的影响 甘蔗尾孢菌菌丝在不同氮源培养基中的生长情况(表3)表明,分离株CL12能够不同程度地利用无机氮源和有氮源,但不同氮源对病菌菌丝生长影响显著。供试菌株最适氮源为牛肉膏和酵母粉,其次为蛋白胨,对NH4Cl和NH4NO3的利用较差。
2.2 培养条件对甘蔗尾孢CL12分离株菌丝生长的影响
2.2.1 温度对菌丝生长的影响 不同温度对甘蔗尾孢CL12分离株菌丝生长的测试结果(图1)表明,该分离株在5~35 ℃温度范围内均可生长,高于 35 ℃ 不能生长,最适生长温度为25 ℃。
2.2.2 pH值对菌丝生长的影响 分离株CL12在4.0~10的7个pH值梯度条件下均可生长,对pH值表现出较广的适应范围,其中在pH值为5的条件下菌落直径最大,表明该分离株比较适合偏酸的生长环境(图2)。
2.3 培养条件对甘蔗尾孢CL12分离株分生孢子萌发的影响
2.3.1 温度对分生孢子萌发的影响 甘蔗尾孢CL12分离株的分生孢子萌发率在不同温度下存在较大差异(图3)。该菌株分生孢子在15~35 ℃温度范围内均可萌发,最适萌发温度为25 ℃,高于 35 ℃ 或低于10 ℃均不能萌发。
2.3.2 pH值对菌丝生长的影响 甘蔗尾孢分离株CL12的分生孢子在pH值4~10的7个梯度条件下均可正常萌发(图4),表现出较广pH值适应性;其中pH值在5~9的范围内,分生孢子萌发率均高于85%。
3 结论与讨论
尾孢菌类真菌是无性型真菌丝孢菌纲,丝孢目,由Fresenius在1863年建立[10]。尾孢菌属(Cercospora Fresen.)是重要的植物病原菌,可危害植物的不同部位,形成明显的坏死斑[11]。该类真菌能够侵染多种农作物和经济作物,致使受害植物出现叶片枯黄,提前落叶、落花、落果,严重影响作物生长,造成一定的经济损失[12]。由玉蜀黍尾孢菌(C. zeae-maydis Tehon et Daniels)引起的玉米灰斑病在我国广泛分布,已经成为玉米生产种的重要问题[13];甜菜尾孢菌(C. beticola)引起的褐斑病是甜菜生产中的重要叶部病害,在全世界严重发生[14]。由甘蔗尾孢菌(C. longipes)引起的甘蔗褐斑病在我国蔗区均有分布,是经常发生且造成危害的主要叶部病害之一。
然而,尾孢菌在人工培养基上生长缓慢,导致对甘蔗褐斑病的研究仅停留在对病害的田间调查,缺少对其病菌的生物学特性的研究,从而限制了对该病害侵染过程和发病规律的认识。因此,本试验通过对甘蔗尾孢CL12分离株的培养形状、温度、pH值的适应性以及不同营养利用情况的研究,明确其基本生物学特性。研究结果表明,CL12分离株对温度有较广的适应性,5~35 ℃均可生长,但其20~25 ℃ 的最适生长温度相同,这与甘蔗生长及其褐斑病发生区域的气候条件相一致。但与刘可杰等报道的玉米尾孢病菌在10~30 ℃范围内均可生长[15],略有不同。同时,研究发现该病菌对不同营养的利用差异显著。CL12分离株在PDA、PSA、YPD等培养基上生长良好,菌落生长速度较快,菌丝致密;在WA培养基上虽然菌落扩展速度最快,但菌丝非常稀疏,其生长特性与已经报道的玉米灰斑病菌基本一致[15]。同时,研究发现果糖、牛肉膏和酵母粉是甘蔗尾孢CL2分离株最适合的碳源、氮源;而对于玉米尾孢病菌,可溶性淀粉和麦芽糖是其最佳碳源,说明不同的尾孢菌的营养利用情况有较大差异。本试验通过对甘蔗褐斑病菌生物学特性的研究,基本明确了甘蔗尾孢菌适宜的培养条件和营养条件。然而,由于本试验只针对从广东省分离获得的1株甘蔗尾孢菌的培养特性进行分析,那么病菌群体的不同菌株间、不同地区的菌株间是否存在差异,还须进一步研究。
参考文献:
[1]鲁国东,黎常窗,潘崇忠,等. 中国甘蔗病害名录[J]. 甘蔗,1997,4(4):19-23.
[2]郭英兰,刘锡琎. 中国真菌志(第二十四卷:尾孢属) [M]. 北京:科学出版社,2005.
[3]李增平,张树珍. 海南甘蔗病虫害诊断图谱[M]. 北京:中国农业出版社,2014:18-19.
[4]韦金菊,邓展云,黄诚华,等. 广西甘蔗主要真菌病害调查初报[J]. 南方农业学报,2012,43(9):1316-1319.
[5]龙友华,刘洋洋,吴小毛,等. 贵州甘蔗真菌病害初步调查及褐斑病防治药剂筛选[J]. 植物保护,2015,41(4):186-190.
[6]尹 炯,李文凤,罗志明,等. 云南甘蔗病虫害发生危害新特点及防控对策[J]. 中国农学通报,2018,34(32):119-124.
[7]熊国如,李增平,赵婷婷,等. 海南蔗区甘蔗病害种类及发生情况[J]. 热带作物学报,2010,31(9):1588-1595.
[8]黄鸿能. 广东蔗区甘蔗病害种类和分布的调查及其主要病害的防治[J]. 甘蔗糖业,1987(5):50-52.
[9]方中达. 植病研究方法[M]. 3版.北京:中国农业出版社,1998:140-154.
[10]Chupp C. A monograph of the fungus genus Cercospora[M]. New York:Ithaca,1954:1-667.
[11]Agrios G N. Plant Pathology[M]. 5th ed. New York:Elsevier Academic Press,2005:385-614.
[12]谢学文,赵 倩,郭英兰. 尾孢菌属和假尾孢菌属新纪录种[J]. 菌物学报,2017,36(8):1164-1167.
[13]刘庆奎,秦子惠,张小利,等. 中国玉米灰斑病病原菌的鉴定及其基本特征研究[J]. 中国农业科学,2013,46(19):4044-4057.
[14]邹锋康,丁广洲,贾海伦,等. 甜菜褐斑病及种质资源抗性研究进展[J]. 中国糖料,2019,41(4):63-69.
[15]劉可杰,徐 婧,胡 兰,等. 引起玉米灰斑病的2种尾孢菌生物学特性比较[J]. 沈阳农业大学学报,2016,47(3):342-346.
