蛋白激酶C 在机械牵张致肺上皮细胞损伤中的作用*
2021-05-25刘孟洁谷长平王月兰
刘孟洁,谷长平,王月兰
急性肺损伤(acute lung injury,ALI)、急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS) 是由各种非心源性原因导致的肺毛细血管内皮和肺泡上皮细胞损伤,血管通透性增高的临床综合征,表现为急性、进行性加重的呼吸困难,难治性低氧血症和肺水肿[1]。 ALI 和ARDS 是一个动态变化的复杂的临床综合征,是严重损伤引起机体全身免疫炎症反应失控过程中的不同阶段。
机械通气诱发肺损伤(ventilation induced lung injury,VILI) 的基本机制为肺组织过度牵拉的机械因素和机械力学诱导的肺脏局部细胞因子和炎症介质的释放[2],肺泡膜的完整性破坏及通透性增加是根本原因。 细胞连接蛋白是维持黏膜上皮机械屏障和通透性的重要结构,主要包括Zo-1、Claudin 和Occludin 蛋 白 等[3],其 中occludin 是 最 早 被 发 现 的组成紧密连接(tight junction,TJ)最主要的成分。 蛋白激酶C(PKC)是一种磷脂依赖的丝/苏氨酸激酶,有研究表明在occludin 蛋白功能的调节中,丝/苏氨酸的磷酸化状态较为重要。
1 材料与方法
1.1 标本采集 小鼠肺上皮细胞MLE-12(上海中国科学院细胞库),Flexcell 细胞应力加载系统FX-5000TM 及BioFLEX○R双向应力细胞培养板(Flexcell公司, 美国), 兔抗大鼠Occludin 多克隆抗体、DMEM/F12 胎牛血清(Invitrogen 公司,美国),蛋白激酶C(PKC)抑制剂BisindolylmaleimideⅠ(批号:133052-90-1,Cayman 公司,美国),二甲基亚砜(批号:0231,Amresco 公司,美国),二氧化碳培养箱,超净工作台,Tanon-4500SF 全自动数码凝胶化学发光图像分析系统由山东省千佛山医院实验研究中心提供。
MLE-12 细胞生长于含10%胎牛血清的DMEM/F12 完全培养基中,在37 ℃、5%CO2的条件下培养,传代至稳定。 牵张前将MLE-12 细胞以1×105个/cm2的密度接种到Bio FLEX 弹性膜细胞培养板静置培养24~48 h, 再使用无血清培养基饥饿处理2 h。 机械牵张组采用Flexcell 5000TM 牵张细胞,参照文献[4]的方法,将Bio FLEX 培养板放入牵张仪,压紧保证其密闭,分别施加不同牵张力使弹性膜拉伸8%和20%,牵张频率0.5 Hz,牵张时间分别为0 h、1 h、2 h、4 h; 之后再将MLE-12 细胞随机分为3 组:牵张组(C 组)、二甲基亚砜对照组(D 组)和PKC 抑制剂BIM 组(B 组),牵张前1 h;D 组和B组分别加入二甲基亚砜)30 μl/ml 和PKC 抑制剂BisindolylmaleimideⅠ5 μmol/L(用二甲基亚砜溶解)处理细胞,采用20%的强度牵张4 h,频率0.5 Hz。牵张完成后将培养板置于显微镜下观察拍照。 之后取出Bio FLEX 培养板,PBS 冲洗,胰酶消化后离心取沉淀, 加充分裂解后,12000×g 离心5 min 取上清,采用BCA 蛋白浓度测定试剂盒对肺组织上清定量,加样于10%SDS-PAGE 进行电泳(80 V,30 min;120 V,60 min),湿转至PVDF 膜(280 mA,60 min),5%的脱脂奶粉37 ℃封闭60 min,分别加入Occludin多克隆抗体(1∶250)和内参GAPDH 一抗(1∶3000),4 ℃孵育过夜, 洗膜后加入辣根酶标记的二抗 (1∶5000)37 ℃杂交60 min,洗膜后用ECL 化学发光法检测阳性信号,Tanon-4500SF 全自动数码凝胶化学发光图像分析系统观察,用软件对图像条带进行灰度扫描,计算积分吸光度值。 以积分吸光度值反映肺组织occludin 蛋白的表达水平。
1.2 统计学分析 采用SPSS22.0 统计学软件进行数据处理,计量资料以(±s)表示,组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结 果
2.1 小鼠肺上皮细胞不同牵张时间点occludin 蛋白的表达 机械牵张导致小鼠肺上皮细胞表面的细胞连接蛋白occludin 的表达减少,呈时间和强度依赖性。 在机械牵张不同时间0 h、1 h、2 h、4 h,牵张强度8%occludin 蛋白表达为0.934±0.011、0.711±0.063、0.644±0.037、0.539±0.016, 牵张强度20%occludin 蛋白表达为0.913±0.008、0.692±0.048、0.571±0.039、0.307±0.066;可见,随着时间的延长,occludin 蛋白表达逐渐减少,20%的牵张强度牵张4 h 时occludin 蛋白减少最明显。
2.2 3 组MLE-12 细胞不同时点0ccludin 蛋白表达比较 3 组细胞随机械牵张时间的延长,occludin蛋白表达逐渐下调(P<0.05);与C 组比较,D 组各时点occludin 蛋白表达差异无统计学意义 (P>0.05),B 组机械牵张2 h、4 h 时occludin 蛋白表达上调(P<0.05),见表1。
2.3 20%牵张强度牵张4 h 后小鼠肺上皮MLE-12 细胞的形态改变 牵张前对照组的细胞形态正常, 成椭圆形贴壁生长, 细胞连接较紧密, 而以20%的牵张强度牵张4 h 后(C 组、D 组)观察发现细胞形态不规则,呈分支状、杆状,细胞有较多脱落,贴壁不紧,细胞间连接不够紧密,此时的肺损伤也最严重, 使用BIM 处理后细胞损伤减轻(B组),见图1。
表1 3 组MLE-12 细胞不同时点occludin 蛋白表达比较(n=3,±s)

表1 3 组MLE-12 细胞不同时点occludin 蛋白表达比较(n=3,±s)
注:与0 h 比较,*P<0.05;与1 h 比较,#P<0.05;与2 h 比较,△P<0.05;与C 组比较,▲P<0.05。
?
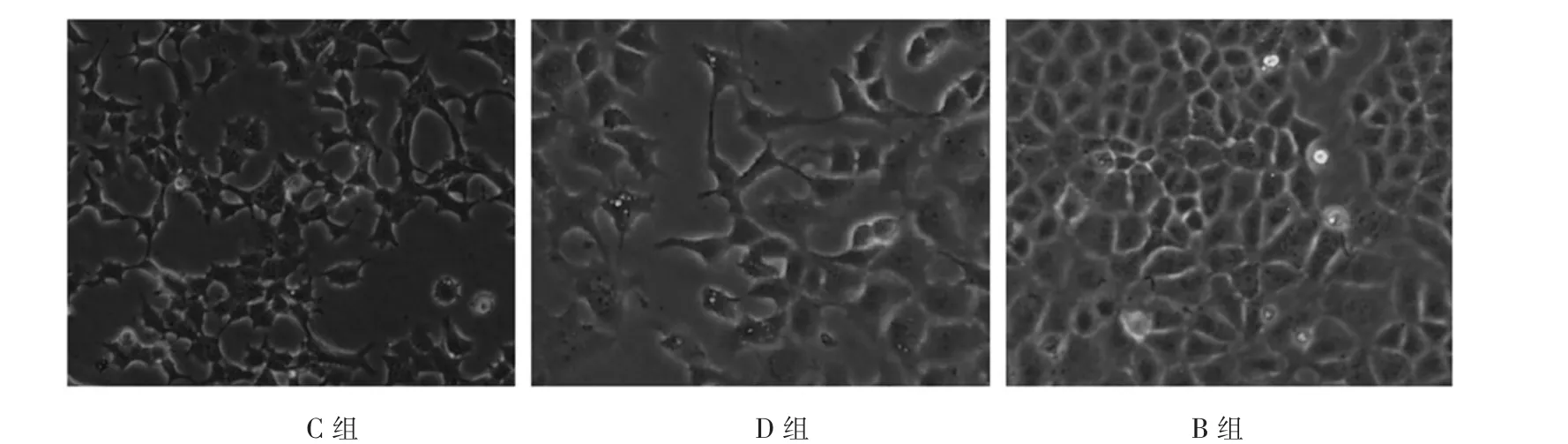
图1 3 组周期性牵张4 h 后小鼠肺上皮MLE-12 细胞的形态改变(光镜,×400)
3 讨 论
机械通气诱发肺损伤(ventilation induced lung injury,VILI) 是指应用呼吸机过程中由于机械通气诸多因素和肺部原发病共同作用导致的肺组织损伤。 以往对机械通气的研究主要集中在吸入高浓度氧气的毒性效应上。 但是近期的实验研究显示,高容量和高压力机械通气亦可造成肺损伤,导致非损伤肺区发生高通透性肺水肿而已损伤肺区的水肿加重[5]。 肺泡膜的完整性破坏及通透性的增加是各种原因导致的急性肺损伤肺水肿形成的根本原因。机械通气诱发肺损伤在临床上表现为进行性呼吸窘迫和顽固性低氧血症, 进而诱发多器官功能障碍,导致患者死亡。VILI 的发病机制错综复杂,至今没有统一定论,而笔者在之前的动物实验研究中探讨了VILI 的发病机制[6],因此该实验通过对小鼠肺上皮细胞(MLE-12 细胞)进行机械牵张模拟临床呼吸机进行机械通气,研究机械牵张过程中细胞连接蛋白occludin 的表达变化, 从而明确occludin 蛋白及蛋白激酶C(PKC)在机械通气诱发肺损伤中的作用。
Occludin 是第一个被发现的定位于紧密连接的跨膜蛋白,而紧密连接位于上皮细胞顶端相邻细胞间,在维护上皮细胞两侧物质的差异和保持细胞极性以及结构的稳定上起着重要作用[3]。 Occludin蛋白作为紧密连接蛋白的重要组成成分,在维持肺泡黏膜上皮机械屏障的完整性与细胞通透性方面起着重要作用[7]。该研究结果表明,机械牵张小鼠肺上皮MLE-12 细胞,occludin 蛋白的表达减少呈时间和强度依赖性, 分别使用8%和20%的牵张强度对MLE-12 细胞进行周期性牵张,occludin 蛋白有不同程度的表达减少,20%的牵张强度occludin 蛋白明显减少;且随着牵张时间的延长表达减少更明显,20%牵张4 h 组occludin 蛋白减少程度最明显,且肺损伤表现更严重。 显微镜下发现MLE-12 细胞水肿,形态不规则,呈分支状、杆状,细胞有较多脱落,贴壁不紧,细胞间连接不够紧密,间隙增加。
有研究表明黏附连接蛋白p120 的减少也会导致肺水肿肺损伤的加重,其机制可能是机械通气过程中激活了蛋白激酶Src[9],而之前的研究发现PKC可能通过下调occludin 的表达而参与机械通气相关性肺损伤的发生[10,11],因此笔者使用PKC 抑制剂BIM 预处理牵张的细胞,以研究在周期性牵张过程中PKC 对occludin 蛋白的影响以及occludin 蛋白的表达改变对肺损伤的影响。蛋白激酶C 是一族依赖于Ca2+、磷脂或二酰甘油刺激而激活,催化丝/苏氨酸残基磷酸化的蛋白激酶, 广泛分布于多种组织、器官和细胞,BIM 是一种高选择性、膜通透的、可逆的PKC 抑制剂[12]。 实验发现与正常对照组比较,20%的强度周期性牵张MLE-12 细胞4 h 后,occludin 蛋白表达明显减少, 而BIM 预处理阻断PKC 后,occludin 蛋白表达上调,肺损伤减轻,提示周期性机械牵张激活PKC 下调occludin 的表达,从而使肺泡之间的致密连接受损,引起肺泡膜的完整性破坏和通透性的增加,导致急性肺水肿,表明由于蛋白激酶的激活导致的occludin 的表达下调了参与大鼠机械通气肺损伤的病理生理过程。
综上所述, 机械牵张可下调小鼠肺上皮细胞occludin 蛋白表达, 呈时间依赖性及强度依赖性,PKC 抑制剂减轻occludin 的下调从而缓解肺损伤,因此认为蛋白激酶C 可能参与机械通气诱发肺损伤的发生。
