带叶兜兰根内与根区土壤的真菌群落组成分析
2021-05-25王晓国李秀玲周主贵
王晓国,李秀玲,董 艳,周主贵*
(1.广西农业科学院微生物研究所,广西 南宁 530007;2.广西农业科学院花卉研究所,广西 南宁 530007;3.广西农业科学院生物技术研究所,广西 南宁 530007)
【研究意义】兜兰属是兰科植物中最具特色的一个类群,广布于东南亚、南洋群岛及太平洋西南大洋洲岛屿国家[1-3]。我国西南地区及华南部分地区是兜兰主要分布区之一[4-5],近年来其生境已遭受严重破坏,极大地影响带叶兜兰的种群恢复和扩展[6]。土壤真菌可通过多种方式进入兰科植物根系,土壤真菌群落结构在一定程度上会影响兰科植物根内真菌群落结构。至今关于兰科植物中根区土壤和根内真菌群落结构的相关性仍不明确[7]。因此,分析带叶兜兰根内和根区土壤真菌群落组成及其相关关系,对带叶兜兰的保育和种群恢复具有重要意义。【前人研究进展】土壤中的部分真菌可与兰科植物根形成菌根以维持互利共生关系,土壤中菌根真菌的丰度越大,与生长在该地的兰科植物形成共生关系的菌根真菌越多,就越有利于兰科植物生长[8]。McCormick等[9]发现,有地生兰种子萌发的地方,其特异共生真菌丰度一般较高,且越靠近成熟兰科植物则真菌的丰度就越高。根系中发现的部分菌根真菌在土壤中也有广泛分布[10-11],对土壤中菌根真菌进行检测,可判断该地点是否适合相应兰科植物生长[11]。但兰科植物根内的菌根真菌群落结构与土壤中的菌根真菌群落结构显著不同,菌根真菌在根内的丰度最大,根内的菌根真菌中只有少数在土壤中出现[12-13],兰科植物根内的真菌群落与土壤的真菌群落在一定程度上相互独立[14],菌根真菌在土壤中的分布与兰科植物无明显关系[13]。【本研究切入点】目前,针对广西带叶兜兰分布区内兜兰根内与根区土壤真菌群落组成的研究鲜见报道。【拟解决的关键问题】对带叶兜兰根内和根区土壤的真菌群落组成进行初步分析,探究带叶兜兰根内与根区土壤真菌群落结构的差异,为深入研究兰科植物菌根与土壤环境的关系及带叶兜兰的保育和种群恢复提供理论依据。
1 材料与方法
1.1 试验材料
供试带叶兜兰根样品和根区土壤样品2018年12月采自广西农业科学院花卉研究所兰科植物资源圃中收集的野生兜兰材料,共取5盆带叶兜兰根样品和土壤样品,根样品标记为P01、P02、P03、P04和P05,根区土壤样品标记为S01、S02、S03、S04和S05。每盆收集5条长约5.0 cm的根段和盆内5.0~15.0 cm土层的土壤,根段和土壤分别混合为一个处理。样品收集后迅速带回实验室用液氮速冻并置于-80 ℃冰箱短期保存后用于提取总DNA。
1.2 试验方法
1.2.1 带叶兜兰根系和根区土壤总DNA提取 参照王晓国等[20]的方法进行根系表面处理。根段表面消毒后,参照植物DNA提取试剂盒说明提取根样品的总DNA,参照土壤DNA提取试剂盒说明提取根区土壤总DNA。所提取DNA的完整性以1 %琼脂糖凝胶电泳进行检测,同时采用Nanodrop紫外分光光度计(USA)对DNA进行定量。
1.2.2 样品真菌基因组ITS扩增及测序 以50.0~100.0 ng DNA为模板,PCR扩增跨越真菌18S rDNA高变区V3和V4区域的500碱基,采用包含5′-GGCAAGTCTGGTGCC-3′序列的上游引物和包含5′-ACGGTATCTRATCRTC-3′序列的下游引物扩增部分V3区和全长V4区;采用包含5′-CGWTAACGAACGAG-3′序列的上游引物和包含5′-AICCATTCAATCGG-3′序列的下游引物扩增全长V7和V8区;通过PCR向18S rDNA的PCR产物末端加上带有Index的接头,以便进行NGS测序。扩增体系25.0 μl:5.0 μl 5×reaction Buffer,5.0 μl 5×GC Buffer,2.0 μl dNTP(2.5 mmol/L),1.0 μl上游引物(10.0 μmol/L),1.0 μl下游引物(10.0 μmol/L),2.0 μl DNA模板,8.75 μl ddH2O,0.25 μl Q5 DNA Polymerase。扩增程序:98 ℃ 2.0 min;98 ℃ 15.0 s,55 ℃ 30.0 s,进行25~27个循环;72 ℃ 30.0 s,72 ℃ 5.0 min,最后于10 ℃保温。PCR扩增产物通过2 %琼脂糖凝胶电泳进行检测与纯化,并采用AXYGEN公司的凝胶回收试剂盒对目标片段进行切胶回收。将PCR扩增回收产物进行荧光定量(荧光试剂为Quant-iT PicoGreen dsDNA Assay Kit,定量仪器为Microplate reader(FLx800、BioTek和Vermont,USA))。根据荧光定量结果,按照每个样品的测序量需求,对各样品按相应比例进行混合。
DNA文库混合后,按Illumina MiSeq(Illumina、San Diego和CA,USA)仪器使用说明进行2×300/250双端测序(PE),通过MiSeq工具中的MiSeq control software(MCS)进行图像分析和碱基识别,最后在Illumina basespace云端计算平台进行初始分类分析。
1.2.3 序列分析、OUT分类及系统发育分析 采用QIIME软件通过USEARCH(v5.2.236)检查并剔除嵌合体序列,得到主要分布在200~300 bp长度的序列用于OTU分析。将丰度值低于全体样品测序总量0.001 %的OTUs去除,使用VSEARCH1.9.6进行序列聚类(序列相似性设为97 %),比对的ITS rRNA参考数据库为UNITE ITS database(https://unite.ut.ee/)。然后用RDP classifier贝叶斯算法对OTUs的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样品的真菌群落组成。基于OTU分析结果,采用对样品序列进行随机抽样的方法分别计算Shannon和Chao1等α多样性指数,并绘制稀释曲线。通过Unweighted unifrac分析比较样品间的微生物群落是否存在显著差异,基于Unweighted unifrac样品间距离矩阵用于PCoA(principal co-ordinates analysis)可视化图展示β多样性。通过层次聚类(Hierarchical cluatering)中的非加权组平均法构建UPGMA(Unweighted pair group method with arithmetic mean)系统发育进化树。
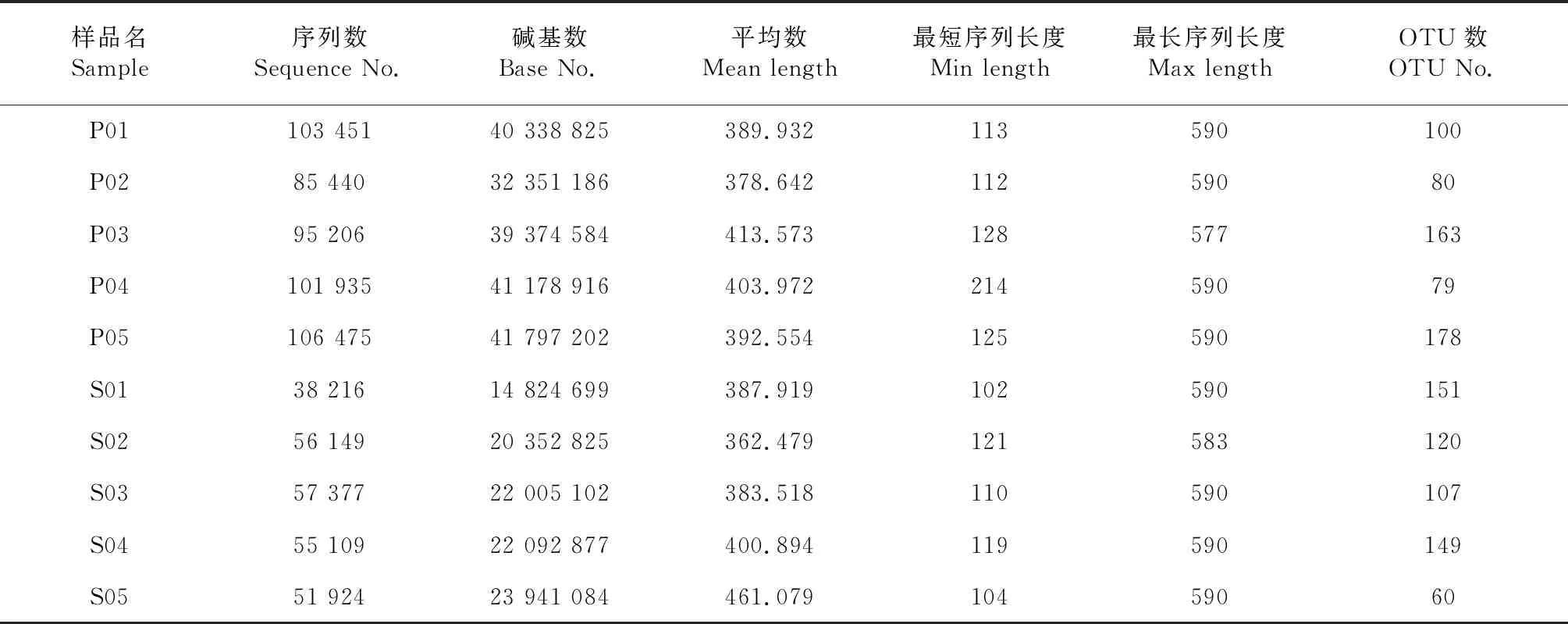
表1 各样品真菌的测序数据信息统计
2 结果与分析
2.1 带叶兜兰各样品真菌的OUT水平分析
对带叶兜兰根样品和根区土壤样品的真菌进行测序,样品最短平均长度为362 bp,最长平均长度为413 bp,共测得原始序列751 282条(其中根样品492 507条,根区土壤样品258 775条),过滤去掉低质量序列并均一化后,获得有效序列310 660条,在97 %相似度下将其聚类为用于物种分类的OTUs,统计得到所有样品在不同OTUs中的丰度信息284个(表1)。其中根样品P05的OTUs数最多,土壤样品S05的OTUs数最少。
从图1可看出,带叶兜兰根样品和根区土壤样品的稀释曲线基本趋于平缓,说明这些样品中基本覆盖了绝大多数真菌,其真菌群落具有多样性,所测得的序列基本可反映真实环境中的真菌群落结构。但稀释曲线未达到完全饱和,仍有部分真菌种类未被发现。
2.2 各带叶兜兰样品中真菌群落的关联性分析
从OUTs分布来看,所有根样品的OTUs有216个,特有的OTUs有57个;所有根区土壤样品的OUTs有229个,特有的OTUs有70个;根样品和根区土壤样品共有的OTUs有159个(图2-A);在所有样品中,S04的OTUs数最多,有19个,其次是S01,有15个,P01、P04、S03和S05的OTUs数最少,均为1个;所有样品共有的OUTs有3个,分别为OTU133、OUT56和OTU225(图2-B)。说明带叶兜兰根样品和根区土壤样品的真菌群落组成在个体间存在一定差异。从属的分布来看,根样品共有96个属,12个特有属;根区土壤样品共有96个属,12个特有属;根样品和根区土壤样品共有属为84个(图2-C);在所有样品中,P03和S04各有2个特有属,而P01、P04、S02和S05没有特有属;所有样品共有属为5个,分别为篮状菌属(Talaromyces)、盘菌属(Leotiomycetes)、镰刀菌属(Fusarium)、Boeremia和Heteromita(图2-D)。综上所述,带叶兜兰的根内真菌群落组成与根区土壤有一定程度的相似性,但群落组成随着植株个体不同存在差异。
2.3 各带叶兜兰样品真菌群落的多样性及结构差异分析
不同样品间的Shannon指数存在一定差异,但总体上趋于一致,说明带叶兜兰根样品和根区土壤样品的真菌群落分化程度较低(表2);从群落丰度Chao 1指数来看,根区土壤样品低于根样品,说明带叶兜兰根内的真菌群落分化程度较高。
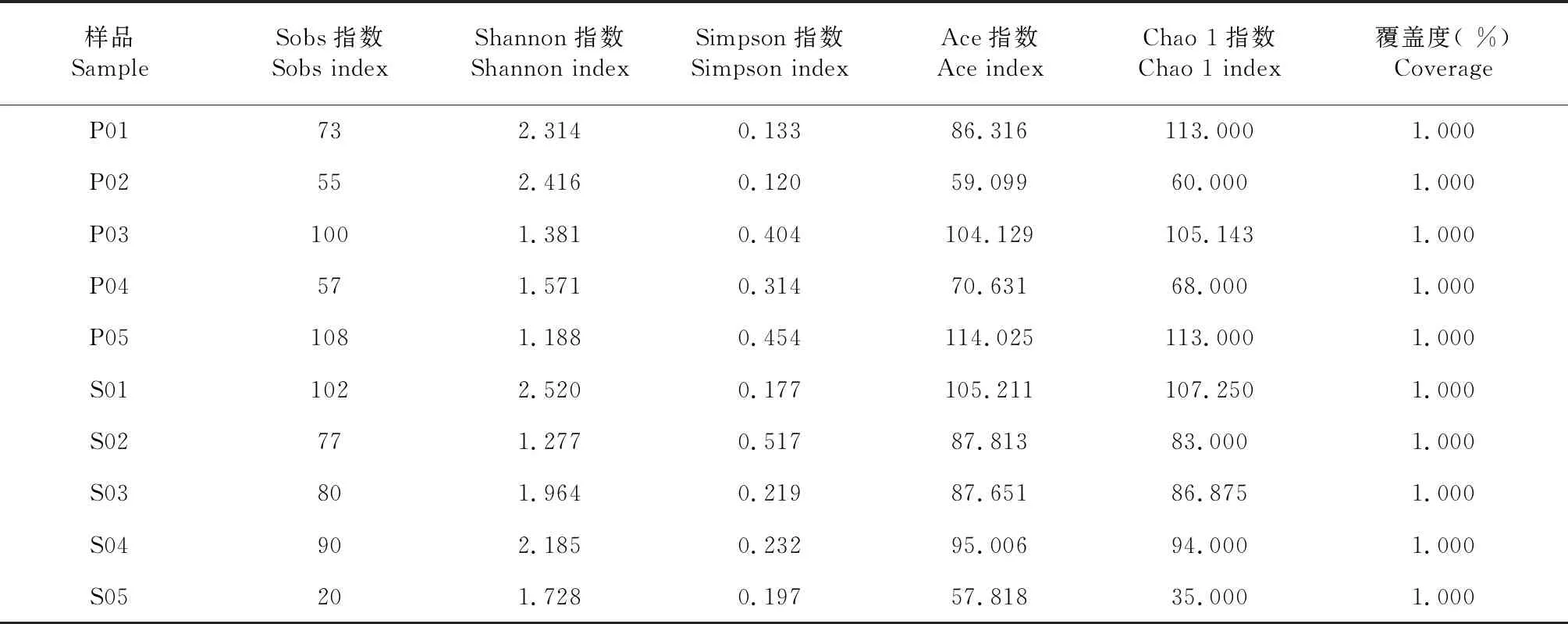
表2 各样品真菌群落的Alpha多样性分析结果
主成分(PCA)分析结果表明,主成分1(PC1)和主成分2(PC2)对样品真菌群落组成差异性的贡献率分别为63.33 %和12.11 %,合计达75.44 %,是差异的主要来源(图3)。根区土壤样品较集中分布在一个区域,距离较近,表明根区土壤样品间的真菌群落组成差异较小;而根样品分布较分散,距离较远。说明带叶兜兰根区土壤样品间的真菌群落组成差异较小,根样品间虽有相似的真菌群落组成,但仍存在较大差异,可能与植株个体间存在差异有关。
2.4 各带叶兜兰根样品和根区土壤样品间的真菌群落结构组成
对各带叶兜兰根样品和根区土壤样品的OTUs依次在门(Phylum)、纲(Class)、目(Order )、科 ( Family )和属(Genus)水平上的信息进行分析,结果(表3)表明,带叶兜兰真菌群落共涉及25门48纲81目96科107属141种及大量未分类种。其中,根样品中P05的真菌种类最多,有95种,P01的真菌种类最少,仅59种;根区土壤样品中S01的真菌种类最多,有102种,S05的真菌种类最少,仅21种。
在科水平上对32科[包括丛赤壳科(Nectriaceae)、虫草科(Cordycipitaceae)、小疱毛壳科(Herpotrichiellaceae)、小双腔菌科(Didymellaceae)、枝孢霉科(Cladosporiaceae)、发菌科(Trichocomaceae)、扁孔腔菌科(Ophiostomataceae)、圆盘菌科(Orbiliaceae)、Trichomeriaceae、Mytilinidaceae及一些未知类群]进行群落分析,结果(图4)发现,根样品中P03涉及的科最多,有16科,P04涉及的科最少,仅8科;根区土壤样品中S01涉及的科最多,有27科,S05涉及的科最少,仅5科(图4-A)。其中,根样品中的丛赤壳科、虫草科、norank_o_Liliopsida和unclassified_c_Embryophyta为优势菌群,约占根样品中总科数的80 %,而根区土壤样品中的丛赤壳科、虫草科、norank_p_Mucoromycota和unclassified_c_Thecofilosea为优势菌群,约占土壤样品中总科数的75 %(图4-B);丛赤壳科和虫草科同为根样品及根区土壤样品的优势菌群,说明根样品和根区土壤样品的部分优势菌群差异影响了真菌群落的组成。此外,在根样品和根区土壤样品中还存在大量未分类菌群,占比分别达5 %和10 %左右。
基于种分类水平,5个根样品和5个根区土壤样品可分为3大分支,根样品与根区土壤品样无单独聚在一起的分支(图5)。其中,根区土壤样品中的S04单独聚为1个分支,其物种种类和丰度与其他样品间差异最明显;根样品中P03、P04和P05聚为1个分支,其物种种类和丰度较相似;根样品中P01和P02在第三大分支上聚为1个小枝,其物种种类和丰度相似,根区土壤样品中S01和S03在第三大分支上聚为1个小枝,其物种种类和丰度相似,根区土壤样品中S02和S05在第三大分支上各聚为1个小枝,其物种种类和丰度与其他小枝存在一定差异。说明根样品和根区土壤样品在种类和丰度方面存在一定差异,但总体上趋于一致。
在属水平上,共有15属真菌的相对丰度存在差异,其中镰刀菌属(Fusarium)和虫草属(Cordycipitaceae)在根样品和根区土壤样品中的相对丰度较接近,分布较均衡,肉环菌属(Sarcosomataceae)、Embryophyta、Liliopsida、Mucoromycota和Alloteropsis5属的真菌在根样品和根区土壤样品真菌的相对丰度存在显著差异(图6,P<0.05)。此外,Embryophyta和Liliopsida真菌仅在根样品中检测到,肉环菌属、Mucoromycota和Alloteropsis真菌仅在根区土壤样品中检测到,属于根样品或根区土壤样品中的特异真菌。说明根样品和根区土壤样品中仅有少部分真菌种类和相对丰度存在差异,多数真菌的相对丰度总体上差异较小。
3 讨 论
本研究对带叶兜兰根样品和根区土壤样品的真菌群落进行分析,发现在带叶兜兰根样品中大部分真菌属于非菌根真菌,菌根真菌仅占极少部分,可能与带叶兜兰是迁地保存材料,其生长的环境、气候发生改变和人为的管理造成在适应环境过程中菌根真菌群落发生了较大变化有关。前人研究发现,兰科菌根(OM)真菌群落结构受多种因素影响,植被、海拔、土壤物理性质如湿度、类型、有机质成分和pH等均能影响OM真菌群落组成[15-19];生境变化也会影响OM真菌群落结构,以光和自养型地生兰菌根为例,有些真菌种类存在于干燥环境而其他真菌仅在非本地种植园内存在[20]。此外,镰刀菌是一种兰科植物根中常见的非菌根真菌,但能有效促进兰科植物种子萌发和生长[15,21-22];采用传统方法分离获得的带叶兜兰菌根真菌中,镰刀菌为优势菌群,可能是由于生境改变,使得带叶兜兰从非菌根真菌中获取养分的机率增大,从而减少对菌根真菌的依赖。

表3 带叶兜兰根样品和根区土壤样品的真菌群落分类学统计结果
本研究从带叶兜兰根样品中测得600条OTUs,从根区土壤样品中测得587条OTUs,说明兰科植物根的真菌种类和数量与根区土壤接近,即根内与根区土壤的真菌组成趋于一致,PCA和UPGMA聚类分析结果也发现带叶兜兰根样品的真菌群落与根区土壤样品的真菌群落在组成和结构上虽然存在一定差异但差异程度较小,其中Nectriaceae和Cordycipitaceae同为根样品和根区土壤样品的优势菌群,而根样品与根区土壤样品的优势真菌组成具有较高相似度,表明兰科植物根内与根区土壤的真菌群落在组成方面存在明显的相关关系。但也有研究认为兰科植物的真菌群落与土壤的真菌群落在一定程度上相互独立[11,16]。这可能与样品的土壤环境关联性较大。本研究所用带叶兜兰材料为迁地保护材料,生长环境和土壤条件与其原生生境差异较大导致兰科植物根内真菌群落与根区土壤真菌群落的关联性与前人研究结果不同。然而,目前对兰科植物菌根真菌在土壤中的动态分布仅局限于了解到根中发现的大部分菌根真菌在土壤中广泛分布[9-14]。
土壤中潜在的兰科菌根真菌也存在兰科植物根中,但二者菌根真菌的相对丰度不同[23];与兰科植物相关的某些菌根真菌群落在土壤中未被发现[7,24]。本研究通过分子手段,对带叶兜兰根样品和根区土壤样品真菌群落进行初步分析,发现根区土壤中潜在的非兰科菌根真菌镰刀菌为优势菌群,而鉴于目前关于带叶兜兰根区土壤潜在非兰科菌根真菌的研究鲜见报道,本研究认为带叶兜兰根区土壤真菌群落组成可在一定程度上反映其根内的真菌群落组成。
4 结 论
带叶兜兰根内与根区土壤的真菌群落具有相似结构,种类间和丰度间差异不明显,但根内与根区土壤共有多数种类的优势菌群。
