肺泡巨噬细胞来源的微囊泡对肺损伤的作用
2021-05-24张蓝予秦春妮陈书弘黑飞龙
张蓝予,秦春妮,梁 影,陈书弘,黑飞龙
急性肺损伤发生率较高,感染、创伤、机械通气及体外循环等均可导致急性肺损伤[1-3],中重度肺损伤的死亡率超过40%[4],新冠肺炎所致重度肺损伤为致死的重要因素之一。 然而肺损伤的发病机制仍不十分明确。
细胞外囊泡是细胞间的沟通桥梁,包括凋亡小体,微囊泡(microvesicles, MVs)及外泌体,其在机体中的作用得到越来越广泛的关注。 新近研究表明肺损伤期间肺泡灌洗液中含有大量胞外囊泡[5]。 在肺损伤早期,巨噬细胞来源的胞外囊泡占据60%[5]。 而其中,MVs 为巨噬细胞产生的主要胞外囊泡类型[5-6]。 但MVs 对肺损伤的作用及机制仍待研究。 因而本项研究拟通过获取肺泡巨噬细胞来源的MVs 探究其对肺损伤的作用及潜在机制,拟为肺损伤提供基于胞外囊泡治疗新方向的参考。
1 材料与方法
1.1 肺泡巨噬细胞的培养 小鼠肺泡巨噬细胞系(mouse alveolar macrophage cell, MHS)(ATCC 公司),经RPMI-1640 培养基中添加10%胎牛血清(Gibico,美国)及1%双抗于T225 培养瓶(Corning,美国)中培养。培养箱条件:37℃,5% CO2。 待细胞量长至108,更换为去除囊泡的完全培养基并给予脂多糖(Lipopolysaccha⁃rides,LPS,Sigma Aldrich,美国)100 μg/L 或等量磷酸缓冲盐溶液(phosphate buffer saline,PBS)刺激1 h。
1.2 提取肺泡巨噬细胞来源的MVs[6]收集刺激后的细胞上清,放入离心机(赛默飞,美国),300 g 4℃离心10 min 后,弃沉淀,上清液再次2 000 g 4℃离心20 min,弃沉淀,上清移入高速离心管中,放入高速离心机(贝克曼,美国)继续20 000 g 4℃离心30 min,离心后弃上清,PBS 重悬沉淀于20 000 g 4℃再次离心30 min,重复一次PBS 清洗,最终沉淀于PBS 重悬保存。
1.3 肺泡巨噬细胞来源的MVs 的鉴定 采用透射电镜(transmission electron microscope,TEM) 观察MVs 形态,纳米粒径追踪技术(nanoparticle tracking analysis,NTA)观测MVs 数量及粒径分布。
1.4 实验分组及处理 将C57/BL6 小鼠随机分为三组:①PBS 组(PBS 气管内刺激,剂量为50 μl,n =4);②Control-MV 组(PBS 刺激的肺泡巨噬细胞来源的MVs 经气管内刺激小鼠,剂量为50 μg/50 μl,n =4);③LPS-MV 组(LPS 刺激的肺泡巨噬细胞来源的MVs 经气管内刺激小鼠,剂量为50 μg/50 μl,n =4)。 分别作用4 h 后获取小鼠肺组织。
1.5 肺损伤评估 评分内容为肺间质水肿、肺泡水肿、肺泡充血、中性粒细胞浸润,病变程度为:0 分-无病变或极轻度病变;1 分-轻度病变;2 分-中度病变;3 分-重度病变;4 分-极重度病变。
1.6 蛋白免疫印迹 提取MVs 蛋白和肺组织蛋白后,行聚丙酰胺凝胶电泳,后将蛋白转印至PVDF膜上,5%脱脂牛奶(TBST 配制),封闭1 h,TBST 清洗3 次后孵育一抗4℃过夜:CD68(1 ∶800),CD63(1 ∶800) 及ALIX(1 ∶1 000),闭合小环蛋白(ZO-1,1 ∶800),咬合蛋白(Occludin,1 ∶1 000),闭合蛋白(Claudin-5,1 ∶800),内参(GAPDH,1 ∶1 000);TBST 清洗PVDF 膜三次后,孵育二抗90 min;TBST清洗后进行电化学发光法显影,采用image J 对各蛋白进行含量分析。
1.7 统计学方法 应用SPSS 17.0 软件处理数据,符合正态分布的数据采用均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用Bon⁃ferroni 事后检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 肺泡巨噬细胞来源的MVs 提取与鉴定 经梯度离心获取MVs,TEM 鉴定MVs 形态(图1),NTA 发现MVs 粒径峰值集中于100~200 nm(图1),蛋白免疫印迹发现MVs 表达CD63、CD68 及ALIX(图2)。
2.2 肺泡巨噬细胞来源的MVs 致小鼠肺损伤 HE染色显示,与PBS 组及Control-MV 组相比,LPSMVs 刺激的肺组织呈现明显间质水肿及炎性细胞浸润,且肺损伤评分更高(P<0.05,n =4,图3)。
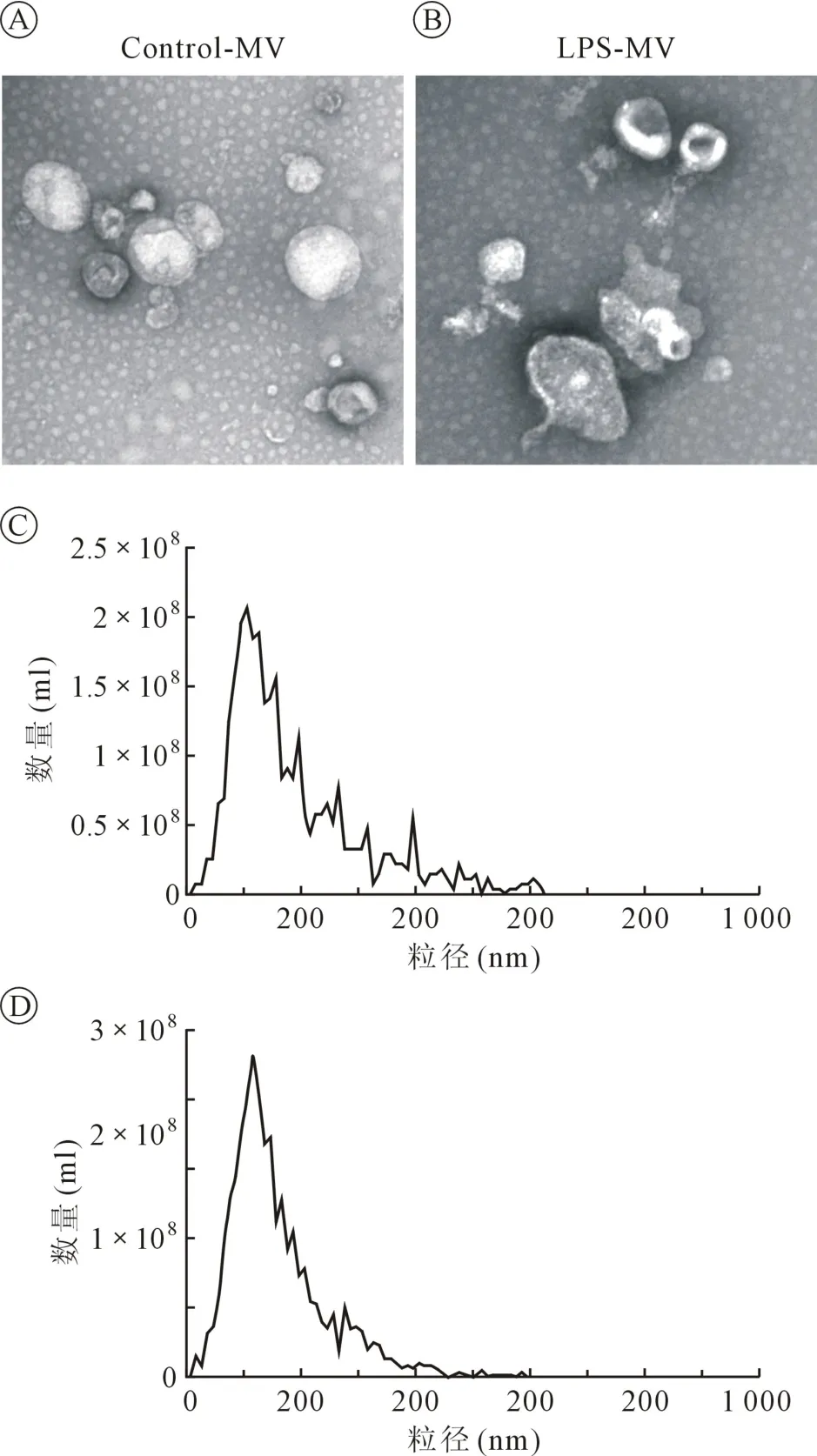
图1 巨噬细胞来源的MVs 的鉴定

图2 巨噬细胞来源的MVs 表面标志物表达
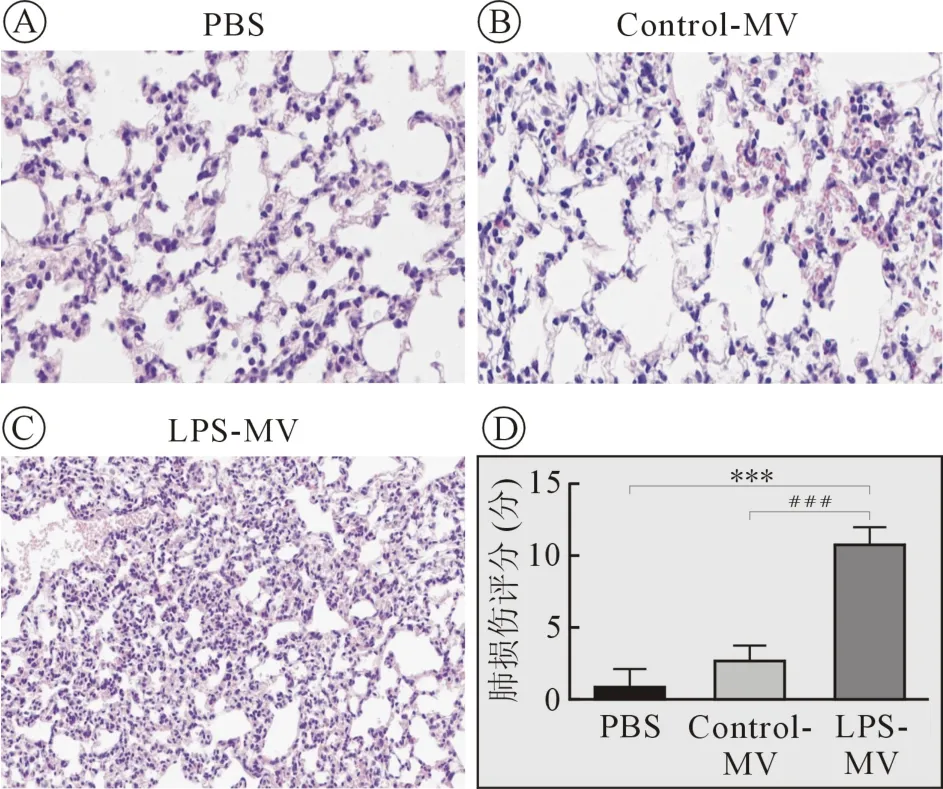
图3 巨噬细胞来源MVs 对肺损伤的作用
2.3 肺部连接蛋白(tight junction, TJ)的表达 蛋白免疫印迹结果表明,相比PBS 组及Control-MV组,LPS-MV 组的肺组织TJ 的ZO-1,Occludin 及Claudin-5 的表达均降低(P<0.05,n =4,图4)。
3 讨 论
炎性细胞在急性肺损伤的发展过程中占据重要地位,而肺泡巨噬细胞是肺部对抗刺激的第一道防线,也是肺组织中占主导地位的免疫细胞[7]。 肺损伤发生后,肺部细胞均可分泌胞外囊泡,例如肺泡巨噬细胞、肺上皮细胞、肺血管内皮细胞及中性粒细胞等[8],研究发现肺泡灌洗液中存在大量上述细胞分泌的胞外囊泡[5],但不同时期胞外囊泡的主要来源有所不同。 在感染所致急性肺损伤早期,肺泡巨噬细胞激活,分泌大量MVs,其作为生物介质载体,在肺部细胞间起着传递作用。
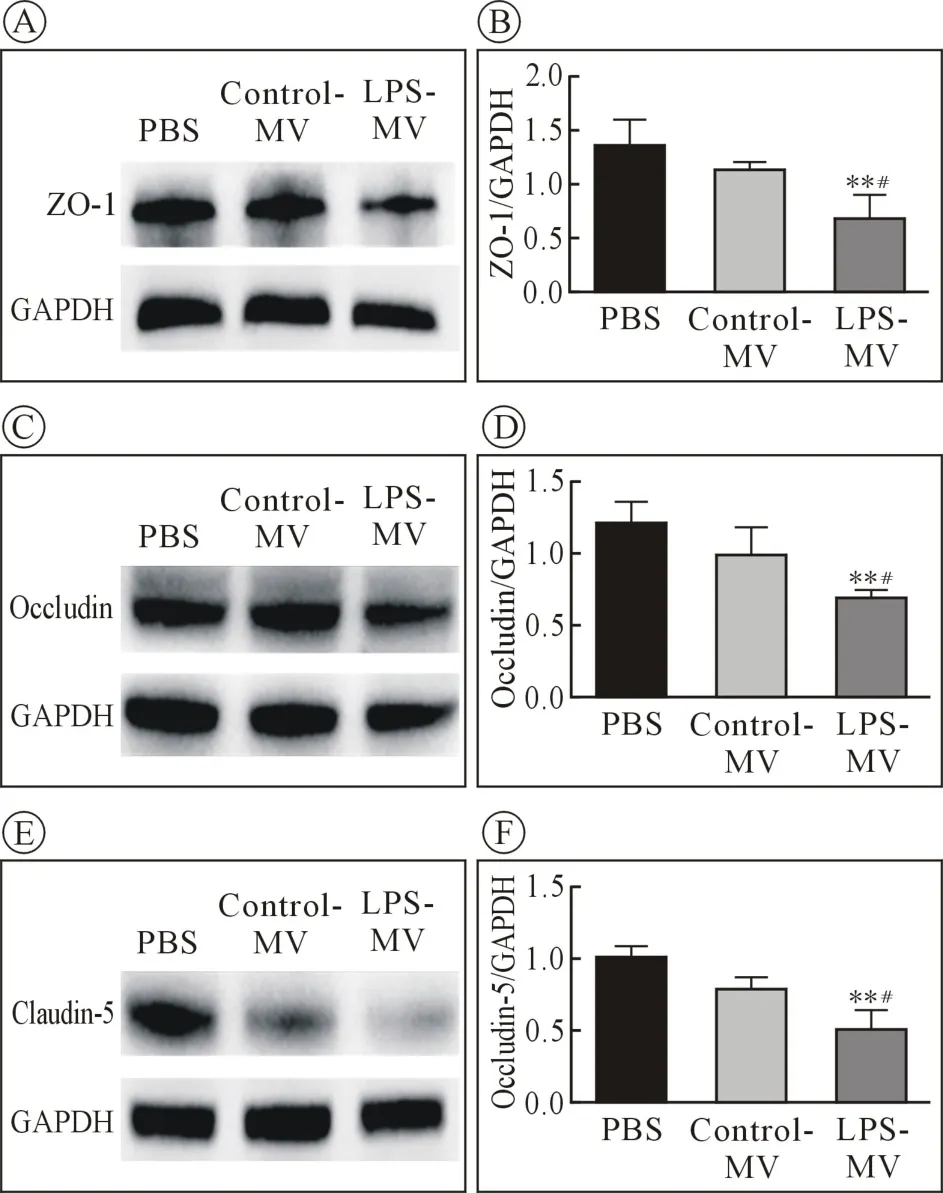
图4 巨噬细胞来源的MVs 对紧密连接相关蛋白表达的影响
小鼠原代肺泡巨噬细胞难以大量获取,本项研究采用大量培养MHS 以获取足量MVs。 本项研究发现MHS 培养过程中可产生大量的MVs,LPS 刺激肺泡巨噬细胞后产生的MVs 可导致正常小鼠发生肺损伤。 MVs 根据巨噬细胞的不同活性在胞内主动包裹较多生物活性物质,并将其携带进入其它细胞或组织。 研究表明巨噬细胞来源的MVs 早期携带较多 肿瘤 坏死 因子 蛋白 及microRNA 等[6,9-10]。MVs 可被邻近的肺上皮细胞及肺血管内皮细胞等吸收,通过携带的活性介质影响其它细胞活性。 So⁃ni 等[6]发现肺泡巨噬细胞来源的MVs 可增加小鼠肺上皮细胞的细胞间黏附分子-1 及角化细胞来源细胞因子的表达,影响上皮细胞活性。 而Zhang等[10]通过对炎性肺泡巨噬细胞来源的MVs 中mi⁃coRNA 的探究发现肺泡巨噬细胞来源的miR-223/142 可抑制肺部炎性小体活性。 表明炎性肺泡巨噬细胞来源的胞外囊泡包裹的生物活性物质既包括损伤性因子,也存在保护性物质。 此外,巨噬细胞来源的胞外囊泡在各类疾病,如心肌损伤、肾损伤、关节炎等均扮演着重要角色[6,9,11]。 新近研究亦考虑将肺泡巨噬细胞来源的MVs 作为肺损伤的标志物[10],因其作为细胞特异性载体,可促进蛋白及miRNAs 的传递,为肺损伤的标志物探究提供可能性。 此外,新近研究也发现干细胞来源的胞外囊泡对肺损伤存在治疗作用[12]。
紧密TJ 由Occludin、Claudins-5 及ZO-1 等组成,其在肺泡内皮屏障间起着重要作用[13]。 肺泡上皮细胞或内皮细胞Occludin、ZO-1 等蛋白表达的减少通常导致肺血管通透性增加,导致肺损伤或水肿。本项研究中发现LPS 刺激后的巨噬细胞来源的MVs 减少了肺组织Occludin,Claudin-5 及ZO-1 的蛋白表达,但对照组MVs 未对TJ 蛋白的表达造成影响,这可能是炎性巨噬细胞来源的MVs 引发肺损伤的原因之一。 据报道肺组织的TJ 的表达受到炎症反应的影响[14]。 巨噬细胞来源的MVs 可携带炎性因子进入肺上皮细胞、血管内皮细胞及细胞间隙[15],可能以此途径降低TJ 的表达。
综上所述,炎性巨噬细胞可产生大量MVs,影响肺部TJ 的表达,并可对肺组织造成损伤。 MVs 作为细胞间的沟通桥梁,其在肺损伤中的作用机制并未完全明确,仍待更深入地机制探讨。
