4例糖尿病肾脏病伴膜性肾病的临床病理及预后分析*
2021-05-24周越张帆罗琼侯霜
周 越 张 帆 罗 琼 侯 霜
北京大学深圳医院肾内科 (广东 深圳 518036)
糖尿病所致肾衰竭已经逐渐上升为临床上透析的主要原因,对个人生活及国家医疗卫生开支影响巨大。糖尿病肾脏病(diabetic kidney disease,DKD)发病率逐年增高,病情进展快,临床主要评估指标为蛋白尿及血肌酐,与肾脏预后相关,但存在不一致性,考虑与合并其它病理类型有关[1]。肾活检为肾脏病变评估的“金标准”,近年来发现DKD可合并多种非糖肾脏病变(nondiabetic kidney disease,NDKD),如IgA肾病、膜性肾病(membranous nephropathy,MN)、局灶节段性肾小球硬化、微小病变等,预后与DKD不同[1-2]。
对于原发性肾病综合征,MN在中老年群体中发病率较高,依据临床白蛋白及尿蛋白指标,MN可分为高、中、低危三种[3],对不同风险等级进行相应的保守或积极治疗,有较多患者可达到部分或完全缓解,对延缓肾病的进展有很大帮助[4],且高危MN患者血栓风险高,及时识别该类患者,积极抗凝治疗,可降低血栓疾病风险。糖尿病可引起继发性肾病综合征,除DKD以外,合并MN的患者,其临床及病理表现与原发MN有相似与区别。本研究拟通过回顾性研究我院2型糖尿病行肾活检且合并MN的患者,分析其临床与病理特点及预后情况。
1 资料与方法
1.1 研究对象 选取2013年1月至2020年3月于北京大学深圳医院肾内科行肾穿刺活检的T2DM,病理诊断为DKD,且合并MN患者共4例,对其临床病理资料及预后进行分析。排除标准:光镜下肾小球<5个,1型糖尿病,伴ANCA,伴NDKD(ⅠgA,MPGN,C3)。本研究经医院伦理委员会审核通过,研究对象均签署肾穿刺知情同意书。
1.2 研究方法
1.2.1 临床资料 通过肾活检当次的医疗记录收集,包括糖尿病病程、体重指数、血压、血红蛋白、24h尿蛋白、生化指标、乙肝、免疫、M蛋白;并发症如血栓、感染、急性肾损伤(AKI);用药如肾素血管紧张素醛固酮系统抑制剂(RASI)、他汀、激素、环磷酰胺(CTX)。
1.2.2 肾脏病理资料 光镜[包括苏木素-伊红染色(HE),PAS染色(PAS),马松三色染色(Masson),六胺银染色(PASM)]、免疫荧光及电镜。DKD依据2010年国际肾脏病理学会DKD病理分型标准[5],分别对肾小球及小管间质评分,肾小球评分依次Ⅰ、Ⅱa、Ⅱb、Ⅲ、Ⅳ级。MN光镜可见基底膜不规则增厚,免疫荧光见ⅠgG及C3在肾小球毛细血管袢呈颗粒样沉积;电镜表现为上皮下、基底膜内电子致密物沉积。通过两位肾脏病理医师阅片评定。
1.2.3 随访 通过门诊就诊信息及电话随访确定患者预后情况。
1.3 统计学方法 本研究重点描述及分析病例信息。
2 结 果
2.1 临床资料 因糖尿病患者穿刺较少,合并非糖肾疾病比例低,本研究合并MN总入组4人,见表1。入组年龄依次38、43、49、67岁,男性比例25%;其糖尿病病程0.5~24年,病例1/2血压达标,病例3/4未达标。4例均达到NS诊断标准,因正在使用他汀调脂治疗,所以部分病例总胆固醇指标下降。合并症/并发症及治疗方面:病例1有乙肝病史,M蛋白阳性;病例3发病前有脑梗;病例4出现深静脉血栓及肺部感染;4例均未发现AKI,均使用RASI;病例3/4使用激素+CTX治疗,见表2。
2.2 肾脏病理
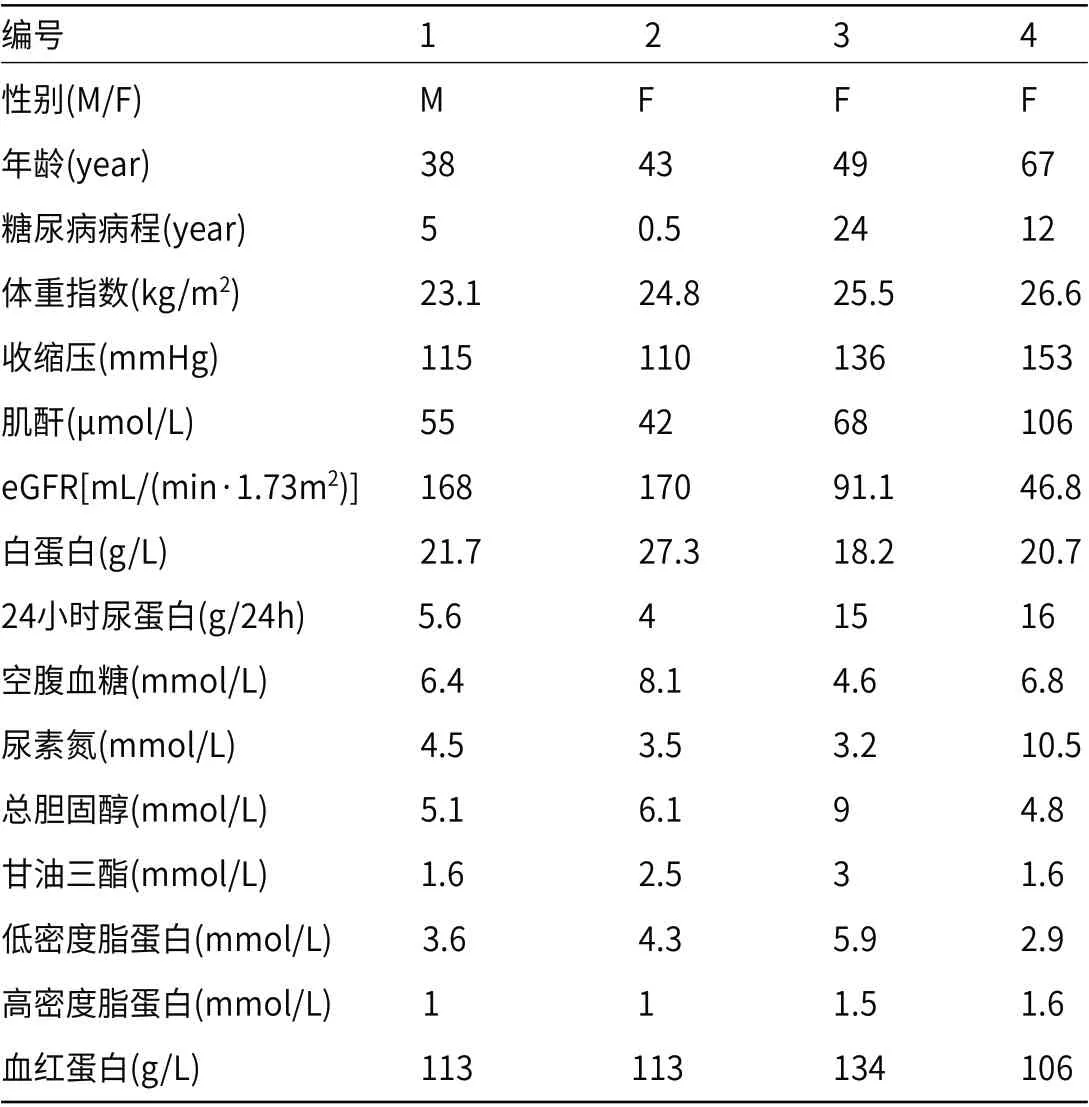
表1 各例临床基本信息及生化指标
2.2.1 光镜 4例病例均可见基底膜增厚(图1),病例1与3为DKD Ⅲ级,糖尿病肾小球病变偏重,均出现K-W结节(图3),病例3出现渗出病变及瘤样扩张(图2、图4);病例2与4分别为DKDⅠ级和Ⅱa级。病例1~3间质小管病变轻度;病例4间质小管病变中度。
2.2.2 电镜 4例病例均表现为基底膜弥漫均质增厚,厚度从900~3900nm,达到DKD诊断标准,伴足突弥漫融合。通过上皮下、基底膜内电子致密物沉积可明确合并MN。图5为膜性肾病,图6为不典型膜性肾病,结合临床及荧光考虑为膜性乙型肝炎病毒相关性肾炎,其系膜细胞和基质增生明显,伴少许电子致密物沉积。
2.2.3 免疫荧光 4例病例均可见IgG呈细颗粒状沿肾小球毛细血管壁沉积,见图7。
图8可见病例3ⅠgG亚型表现ⅠgG1++++,ⅠgG2+,ⅠgG3+++,ⅠgG4++++。
2.3 预后 2例中低危MN指标均有改善;2例高危MN,通过激素+CTX治疗,获得缓解(表3)。
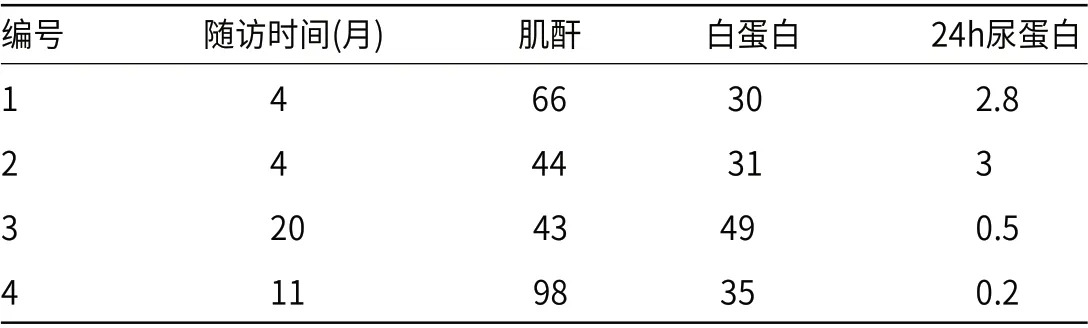
表3 4例病例预后情况
3 讨 论
本研究发现,对于DKD合并MN患者,临床表现多为NS,其糖尿病病程越久者,蛋白尿升高越显著,考虑为两种肾脏病理类型均可影响肾小球基底膜及足细胞,其协同作用导致肾小球滤过屏障损伤,蛋白尿漏出增多。
NS病理类型为MN者易出现血栓,病例3白蛋白<20g/L,蛋白尿>8g/L,为高危MN,未治疗前已发生脑梗;病例4也是高危MN,发病时合并深静脉血栓,伴肺部感染;临床表现上也提示,病理类型可能合并MN。结合糖尿病疾病特点,高血糖、氧化应激、炎症等多种因素导致血管内皮损伤,营养不良增加低蛋白血症发生,血液高凝,均增加血栓风险[6-7]。因此对于糖尿病伴NS,特别是短期内出现大量蛋白尿患者,需重视血栓的防治。
病理方面:病例1与3为DKD Ⅲ级,提示糖尿病肾小球病变偏重,均出现K-W结节,病例3出现瘤样扩张及渗出病变。病例1病理为不典型膜性肾病,临床发现M蛋白阳性(IgG-Lambda 1.4g/L),有乙肝病史,乙肝病毒DNA 2.3×107IU/mL,电镜除上皮下、基底膜内见多量电子致密物沉积,系膜区系膜细胞增生明显,免疫荧光见“满堂亮”,kappa及lambda均阳性,但非单克隆表达,HBsAg+~++,HBcAg++,考虑糖尿病肾病伴乙肝病毒相关性肾炎,治疗上予恩替卡韦抗乙肝病毒联合RASI;病例3病理DKD与MN两者影响均明显,考虑糖尿病病史久,治疗上在强化免疫治疗时,需关注激素对血糖的影响,在病情允许下,尽早激素减量及停用。病例2与4糖尿病肾小球病变较轻,提示蛋白尿主要考虑为MN所致。病例2保守治疗;病例4为高危MN,已出现血栓形成,需积极治疗,重点考虑控制MN及其并发症。病例1~3间质及小管病变轻度,与其肾功能匹配;病例4间质小管病变中度,结合其临床上已达到慢性肾脏病3期,提示慢性小管间质病变对肾功能有较大影响[8]。
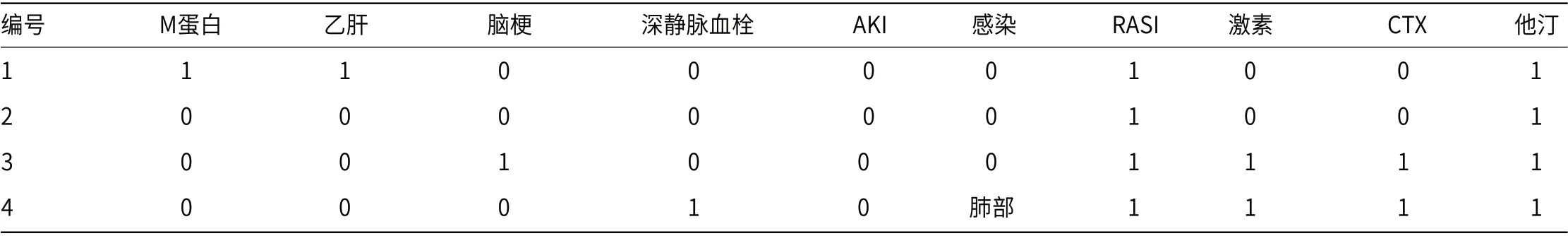
表2 各例合并症/并发症及用药
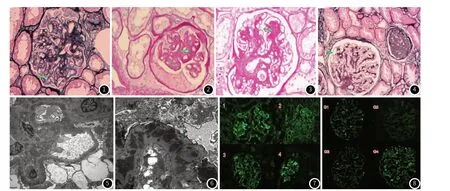
图1 基底膜不规则增厚,可见钉突(PASM×400)。图2 DKD肾小球毛细血管袢纤维素样帽状病变(PAS×200)。图3 K-W结节(PAS×400)。图4 毛细血管袢瘤样扩张(PASM×200)。图5 膜性肾病(电镜×5000)。图6 不典型膜性肾病(电镜×5000)。图7 4例IgG(免疫荧光×400)。图8 病例3 IgG亚型(免疫荧光×400)。
预后:MN基础治疗为RASI,此4例均未发现AKI,均使用RASI降尿蛋白;病例3/4达到高危MN,使用激素+CTX。随访发现,2例中低危MN指标均有改善;2例高危MN,通过强化免疫治疗,均获得缓解。考虑这2例蛋白尿主要是MN所致,需注意激素对其糖尿病的影响。人数限制,病例较少。
综上所述,DKD伴MN患者,NS表现较多,需重视血栓的防治,积极治疗MN有益于改善肾脏病预后,可为之后的临床判断及研究提供新的思路。
