基于线粒体COI 序列的中华绒螯蟹养殖群体与野生群体遗传多样性与遗传结构分析
2021-05-22轩中亚薛竣仁陈修报姜涛刘洪波杨健
轩中亚,薛竣仁,陈修报,姜涛,刘洪波,杨健,
(1.南京农业大学无锡渔业学院,江苏 无锡 214081;
2.中国水产科学研究院淡水渔业研究中心,长江中下游渔业生态环境评价与资源养护重点实验室,江苏 无锡 214081)
中华绒螯蟹Eriocheir sinensis 俗称河蟹、大闸蟹,是我国经济价值极高的重要水产物种[1,2]。中华绒螯蟹在我国的分布范围广泛,东起鸭绿江口、西至湖北沙市、北起辽宁、南至福建的通海河流中几乎均有自然分布[3,4],其中,长江、黄河、辽河等流域是中华绒螯蟹的主要栖息地。长江种群生长速度快、体型大、肉质细嫩、味道鲜美而广受欢迎,价值较高,被广泛引入其他流域养殖[5]。然而,由于过度捕捞、生态环境破坏等原因,长江水系天然蟹苗资源严重衰退,之后辽河流域的蟹苗资源也被大规模开发,资源情况堪忧。因此,保护不同水域中华绒螯蟹种质资源十分必要,而研究不同水域中华绒螯蟹的遗传结构是有效管理和保护中华绒螯蟹种质资源的前提。
目前,对不同水域中华绒螯蟹种质资源从多方面开展了大量研究,包括形态学[6-8]、生理生化指标[6,9-11]、分子生物学等都取得了一定的进展。其中,Sui 等[12]应用微卫星标记(SSR)分析了辽河、海河、黄河、长江、瓯江、南流江等水系的中华绒螯蟹的群体遗传学,发现南流江的合浦绒螯蟹Eriocheir hepuensis 应当被视为遗传上独立的种群,而南流江之北的其他流域的绒螯蟹之间缺乏显著的地理群体结构。Xu 等[13]运用扩增片段长度多态性(AFLP)标记分析了包括辽河、长江等在内的东亚地区14 个群体,结果辽河、长江的中华绒螯蟹被划为同一个遗传簇。葛家春等[14]、许志强等[15]分别利用线粒体COI 标记与微卫星标记分析了辽河、长江、瓯江、莱茵河等四流域的中华绒螯蟹,结果显示中国三大流域的中华绒螯蟹群体间无显著差异,没有明显的地理群体结构。高祥刚等[16]基于GBS(Genotyping-bysequencing)技术分析了辽河家系、辽河野生、长江群体、海南群体、黄河群体的遗传特征,发现海南的中华绒螯蟹苗种可能来自长江流域。然而,之前对于长江流域中华绒螯蟹的研究大多集中在长江口或距离长江口较近的南京、镇江等区域[13-15,17-19],对距离长江口更远的水域(如安徽无为江段等)野生中华绒螯蟹传统重点捕获区域尚缺乏研究。
为了进一步了解长江、黄河、辽河等主要分布区域的中华绒螯蟹野生以及养殖群体的种质资源情况,仍需进行进一步遗传分析。线粒体细胞色素氧化酶亚基I(COI)基因进化速度适中[20],广泛应用在中华绒螯蟹遗传研究中,有利于与已有的研究结果进行对比[14,21-23]。因此,本研究利用COI 基因分析尚未研究的长江流域无为江段野生中华绒螯蟹群体,同时分析了黄河流域的野生群体,湖南大通湖与辽宁盘锦的养殖群体,并与已报道的辽河野生群体进行对比,以完善对中华绒螯蟹的种质资源现状的最新认识,为其相关的资源评价和保护提供理论支撑。
1 材料与方法
1.1 样本采集及DNA 提取
样本采自4 个不同的中华绒螯蟹群体,详见表1。DNA 提取采用康为世纪生物科技有限公司的柱式基因提取试剂盒,按照说明书进行操作。提取后的DNA 溶液在1.0%的琼脂糖凝胶上电泳,检测其质量。检测合格后保存在-20℃下备用。
1.2 mtDNA 扩增及测序
参照Zhang 等[22]的研究,使用引物F:TAAACT TCAGGGTGACCAAAAAATCA 和R:GGTCAACAAA TCATAAAGATATTGG 用于扩增中华绒螯蟹COI 序列。PCR 扩增反应体系包括:100 ng DNA 模板,12.5 μL 2×Taq MasterMix(康为世纪生物科技有限公司),引物(10 mM)各0.5 μL,然后加双蒸水至终体积25 μL。PCR 反应程序如下:95℃预变性5 min;94℃变性1 min,58.1℃退火45 s,72 ℃延伸90s,共30 个循环;最后72℃延伸10 min。PCR 扩增产物用1%琼脂糖凝胶电泳检测,然后用上海生工生物工程技术有限公司的UNIQ-1 柱式PCR 产物纯化试剂盒进行纯化回收,用ABI3730XL 测序仪(天霖生物技术有限公司)进行双向测序。
1.3 数据分析
使用BioEdit 软件中的Clustal W 程序对比排列所得序列,并辅以手工校正。同时,从GenBank 上下载了Tang 等[24]、Xu 等[21]报道的辽河野生中华绒螯蟹COI 基因序列(单倍型登录号为AF317335,FJ750-306、FJ750307、AY640085、AY6400856 和AY6400-87),作为本研究中的一个同种对照群体,以便与黄河、长江野生群体进行比较分析。同时下载了两个合浦绒螯蟹COI 基因序列为外群(登录号为AF317-328 和AF317327)。用DnaSP 软件[25]计算各种群样本Cyt-b 序列的单倍型个数(N)、单倍型多样性(Hd)和核苷酸多样性(Pi)等。由DnaSP 软件输出单倍型文件,由POPART 软件[26]构建median joining network(MJN)以分析单倍型之间的关系,构建本研究所得单倍型的网络图。
用ARLEQUIN 软件[27]计算两两种群间的FST值,用以检验种群遗传结构,通过10 000 次重抽样检验两两种群间FST值的显著性。用MEGA 软件[28]分析核苷酸最佳替换模型。在MEGA 软件中,以合浦绒螯蟹作为外群,基于核苷酸最佳替换模型采用最大似然法(ML)构建系统发育树,并基于K2P 模型分别采用邻接法(NJ)、UPGMA 法构建系统发育树,各分支的支持率均用1000 次自举法检验。
2 结果与分析
2.1 不同中华绒螯蟹种群的遗传多样性
共测得85 条序列,经BLAST 比对,确定是目标序列。与下载的辽河野生群体(LH)共同分析,经DnaSP 软件检测,共有36 个变异位点,其中简约信息位点8 个。对各个群体的分析表明:下载的辽河野生群体(LH)内部具有变异位点7 个,其中简约信息位点3 个,群体内单倍型数6 个;盘锦养殖群体(PJ)内部具有变异位点5 个,其中简约信息位点2个,群体内单倍型数5 个;东营野生群体(DY)内部具有变异位点8 个,其中简约信息位点4 个,群体内单倍型数9 个;无为野生群体(WW)内部具有变异位点4 个,其中简约信息位点3 个,群体内单倍型数5 个;大通湖养殖群体(DTH)内部具有的变异位点最多,达30 个,其中简约信息位点4 个,群体内单倍型数7 个。其中单倍型Hap15、16、17 为LH群体的独有单倍型,单倍型Hap6、7、8、10 为DY 群体的独有单倍型,单倍型Hap11 为PJ 群体独有单倍型,单倍型Hap12、13、14 为DTH 群体独有单倍型。在将DTH08 个体(该个体与合浦绒螯蟹更接近)从DTH 群体中剔除后,DTH 群体的内部具有变异位点5 个,其中简约信息位点3 个,群体内单倍型数6 个。每个单倍型在各群体内代表的不同个体的数量见表2。
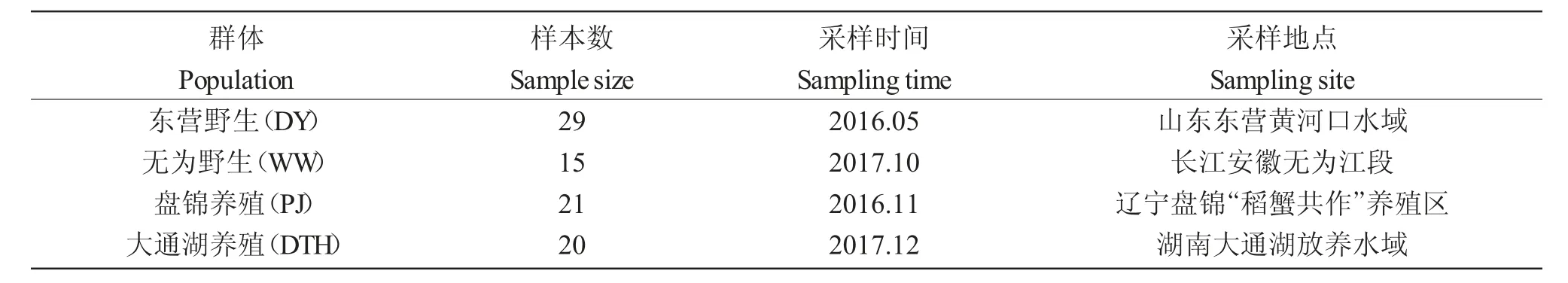
表1 采样时间、地点及样本数Tab.1 Sampling time,site and sample size of Chinese mitten crab Eriocheir sinensis

表2 中华绒螯蟹COI 基因单倍型在不同群体中的分布Tab.2 Frequency of COI haplotypes in different populations of Chinese mitten crab Eriocheir sinensis
5 个群体的COI 序列的单倍型多样性(Hd)、核苷酸多样性(Pi)、平均核苷酸差异数如表3 所示。数据显示,在本研究中LH 群体的单倍型多样性(Hd)最高,而DTH 群体的核苷酸多样性(Pi)最高;WW群体的单倍型多样性与核苷酸多样性都最低。在养殖群体中PJ 群体的单倍型多样性(Hd)、核苷酸多样性(Pi)都低于DTH 群体(表3)。
2.2 不同中华绒螯蟹种群的群体遗传分化、遗传距离与分子变异分析
中华绒螯蟹5 群体间基于的COI 序列的固定指数FST值为-0.034~0.089(表4),其中DY 群体与WW 群体之间、DTH 群体与WW 群体之间的FST值为负。在所有群体之间,仅有DY 群体与LH 群体之间具有显著的FST值,同时这两个群体间的FST值也最高,为0.089。在所有群体中,LH 群体与其他群体之间的FST值最高,除了与DTH 群体的FST值为0.012 外,与其他群体的FST值为0.074~0.089。DTH群体与其他群体的FST值最低,为-0.010~0.032,基因流与FST值的结果相似。
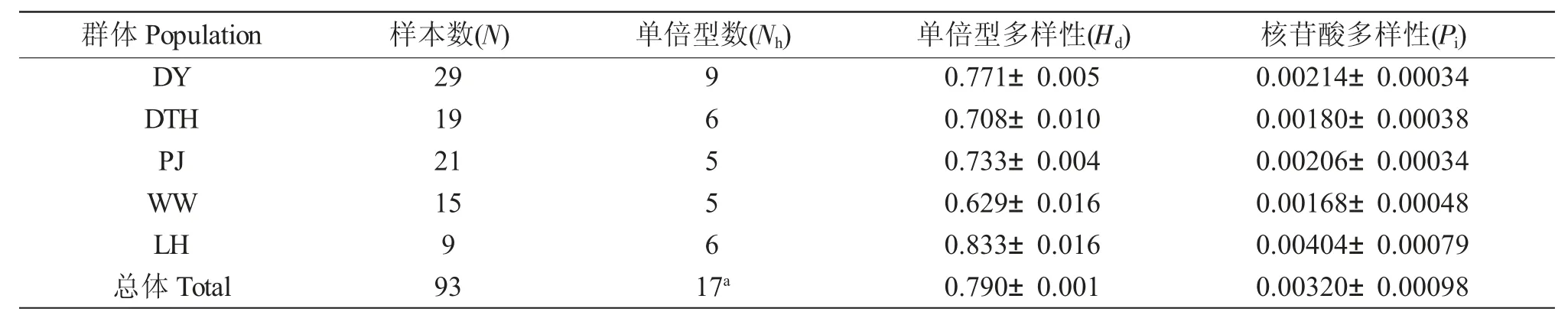
表3 不同群体中华绒螯蟹的遗传多样性参数Tab.3 Genetic diversity parameters among different populations of Chinese mitten crab Eriocheir sinensis
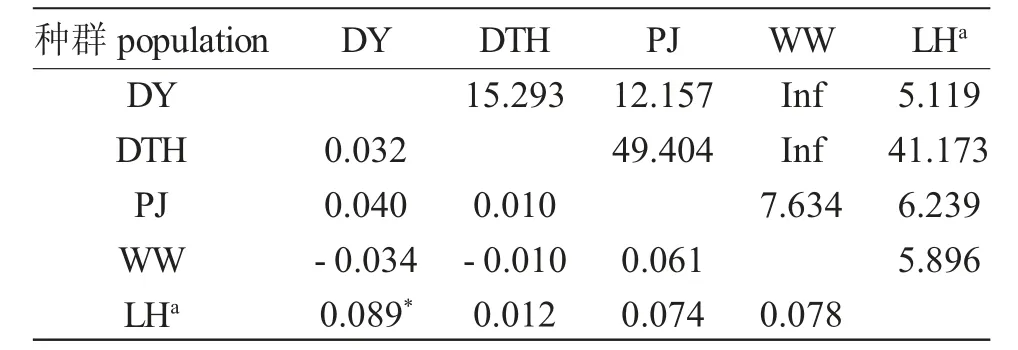
表4 五个不同中华绒螯蟹群体间的FST值与基因流Tab.4 The values of FSTand gene flow among five populations of Chinese mitten crab Eriocheir sinensis
分子变异分析(AMOVA)结果显示,5 个群体总的遗传分化指数为0.022,差异不显著。其中大部分遗传变异(97.84%)在中华绒螯蟹各群体内部,群体间的遗传变异极小,仅为2.16%(表5)。
2.3 不同中华绒螯蟹种群的系统发育分析和最小跨度网络图
经检验,核苷酸最佳替换模型为Tamura-Nei+G(G=0.05)模型。使用MEGA 软件按照最适模型以最大似然法(ML)构建的COI 单倍型系统发育树如图1 所示。在ML 树上,17 个单倍型构成了一个大的分支,而单倍型Hap12(对应绒螯蟹个体DTH08)则与外群合浦绒螯蟹聚在一起构成了另一个分支,显示了该个体与合浦绒螯蟹具有更近的母系亲缘关系。以最大似然法构建的系统关系图显示(图1),本研究的中华绒螯蟹5 个群体混杂分布在系统发育树上,地理位置与单倍型之间没有明显的对应关系。
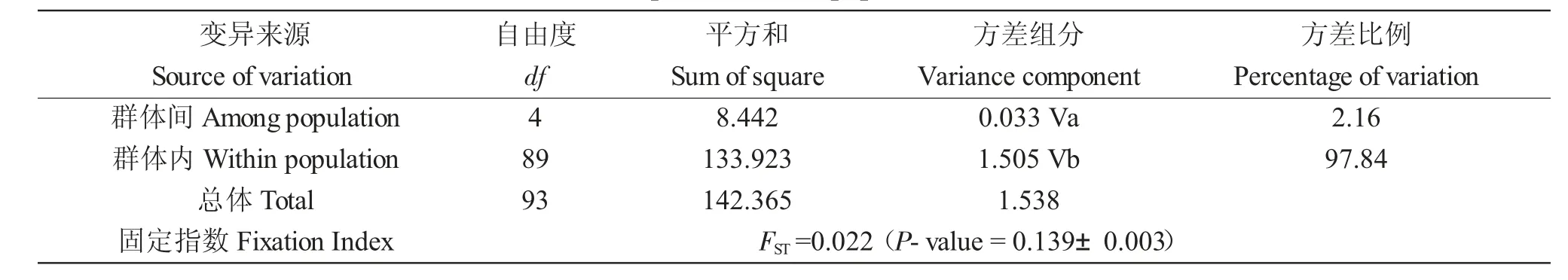
表5 中华绒螯蟹五个不同群体线粒体COI 序列分子变异分析Tab.5 AMOVA results of mtDNA COI sequences in five populations of Chinese mitten crab Eriocheir sinensis
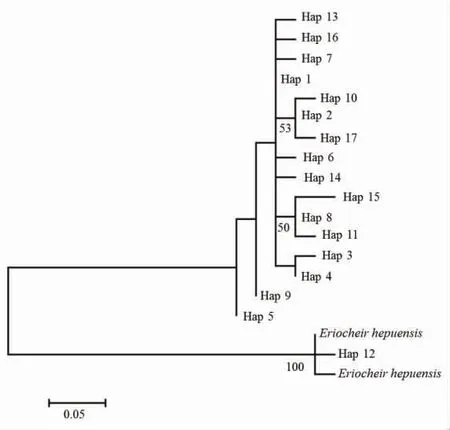
图1 基于中华绒螯蟹COI 单倍型构建的ML 系统树Fig.1 ML molecular dendrogram based on the COI haplotypes of Chinese mitten crab Eriocheir sinensis
基于COI 序列构建的单倍型网络图(图2)显示,除了单倍型Hap12 外,本研究中5 个中华绒螯蟹群体的单倍型之间的变异步数较低,聚为一簇,而Hap12 与其他中华绒螯蟹单倍型之间变异步数极高,与合浦绒螯蟹之间变异步数较低。表明单倍型Hap12 与合浦绒螯蟹具有更近的母系亲缘关系。单倍型Hap1 具有最高的单倍型频率,且在单倍型网络图中处于中心的位置,推测这个单倍型可能较为原始。总体而言,本研究中5 个中华绒螯蟹群体间存在较为广泛的共享单倍型,未表现出明显的地理位置、生活形式与单倍型之间的对应关系。
3 讨论
3.1 遗传多样性
遗传多样性是由种群内个体基因突变、迁移、杂交、遗传漂变和自然选择等多种因素共同作用所决定,同时遗传多样性也是物种适应环境变化、保持进化潜力的基础,对种群的延续具有重要意义[29]。因此,群体的遗传多样性研究具有重要的理论与实践价值。
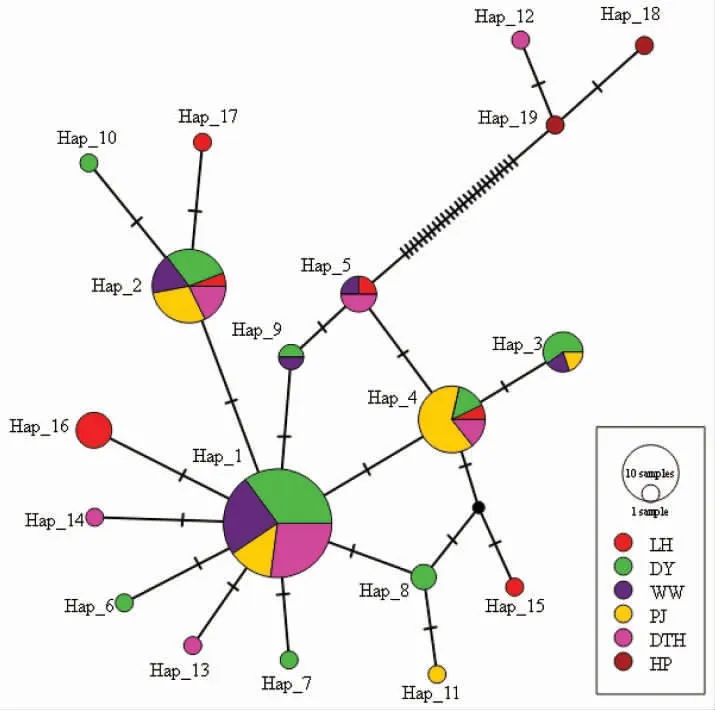
图2 基于中华绒螯蟹COI 单倍型构建的网络图Fig.2 Network diagram of COI haplotypes in Chinese mitten crab Eriocheir sinensis
在分子遗传学中,常用核苷酸多样性(Pi)评价群体内遗传多样性水平,Pi值越高表明遗传多样性越丰富。本研究的5 个中华绒螯蟹群体的总体核苷酸多样性水平较低,显示中华绒螯蟹群体的遗传多样性已面临较大挑战。其中,养殖的DTH 群体的核苷酸多样性最高,达0.00713,与彭欣悦等[23]得到的长江口野生中华绒螯蟹群体的核苷酸多样性指数接近,高于本研究中野生群体。然而,这实际上是DTH 群体中DTH08 个体的单倍型接近合浦绒螯蟹导致的(详见3.3)。在包含DTH08 个体时,DTH 群体内部具有的变异位点最多,达30 个,其中简约信息位点4 个,群体内单倍型数7 个(表2);将DTH08个体从DTH 群体中剔除后,DTH 群体的内部的变异位点仅有5 个,其中简约信息位点3 个,群体内单倍型数6 个,单倍型多样性(Hd)为(0.708±0.010),核苷酸多样性(Pi)为(0.00180±0.00038),与PJ、DY和WW 群体接近,低于LH 野生群体。这表明DTH群体相对其他群体丰富的核苷酸多样性其实是由于DTH08 个体的COI 单倍型为合浦绒螯蟹单倍型,从而与其他中华绒螯蟹单倍型有较大差异造成的。这种单个差异巨大的个体对群体遗传多样性的评估带来了巨大的影响,掩盖了实际的群体遗传多样性,因此在遗传多样性分析中剔除该个体。
LH、DY 野生群体的遗传多样性高于养殖群体,但WW 野生群体的核苷酸多样性低于两个养殖群体(排除DTH08 个体)。本研究中DY、WW 野生群体与Zhang 等[22]基于COI 序列与Cyt-b 序列得到的黄河野生群体、长江野生群体(上海崇明)的核苷酸多样性水平接近,而下载的LH 野生群体(Xu 等[21])的核苷酸多样性(Pi=0.00404)高于Zhang 等[22]报道的辽河野生群体基于线粒体COI 基因的核苷酸多样性(Pi=0.0019),也高于闫龙等[18]报道的辽河野生群体基于线粒体控制区的核苷酸多样性(Pi=0.0019)。这可能显示了近10 年辽河野生中华绒螯蟹种群内遗传多样性下降,反映了种质资源保护的迫切性。
同时,DY、WW 野生群体的遗传多样性也处于较低水平。DY 野生群体的遗传多样性较低可能与该群体所处的生活环境有关。黄河流域处于纬度较高的地区,流域面积小,水温较低,河蟹种群规模较小,这可能就造成了黄河野生群体的遗传多样性水平较低。而WW 野生群体所处的长江流域水域面积广,拥有大量与干流相通的河道与湖泊,适宜河蟹生长和育肥,但其核苷酸多样性水平却是三个野生群体中最低的,与Zhang 等[22]报道的辽河、黄河、长江三流域,闫龙等[18]报道的鸭绿江、辽河、黄河、长江四流域中长江种群核苷酸多样性最低的情况类似,这说明过度捕捞后长江中华绒螯蟹种群遗传多样性遭到了破坏。
3.2 群体遗传分化
在本研究中,所有群体间的遗传分化水平都较低,仅有DY 群体与LH 群体之间有显著的FST值。这两个群体间的FST值也是所有群体之间最高的(0.089),其他群体之间的FST值统计上均不显著。DY 野生群体与WW 野生群体之间、DTH 养殖群体与WW 野生群体之间的FST值为负,意味着基于COI 基因在两群体之间没有检测到遗传分化。DY野生群体与WW 野生群体之间、DTH 养殖群体与WW 野生群体之间的基因流无限大,表明这些群体间的基因交流非常频繁。Sui 等[12]运用微卫星标记、闫龙等[18]利用线粒体控制区对中华绒螯蟹群体遗传研究的结果也显示:辽河水系群体与黄河水系群体之间、辽河水系群体与长江水系群体之间具有显著的遗传差异,而黄河水系群体与长江水系群体间的遗传差异不明显。
中华绒螯蟹具有降海洄游生活史,其成体在生殖蜕壳前主要在淡水中生活,生殖蜕壳后则向河口附近洄游,在河口的半咸水中交配、产卵、孵化。孵化后在河口半咸水中发育为大眼幼体后开始溯河进入淡水中生长发育[30,31]。在此过程中,蚤状幼体可随海流沿岸被动迁移,这种不同河口来源的蚤状幼体的扩散可能给不同河口群体带来遗传交流,降低不同河流群体的遗传分化,这种幼体扩散带来的基因流在降海洄游的多种生物中都有体现[32-34]。Xu等[13]也认为,这种幼体扩散导致了中国北方水系中华绒螯蟹群体间缺乏遗传差异。但黄河口、长江口之间沿岸距离遥远,洋流复杂[35,36],黄河、长江水系间中华绒螯蟹能否形成极大的自然基因交流有待进一步的查证。另外,黄河、长江水系间中华绒螯蟹的基因交流更可能与中华绒螯蟹养殖活动中的跨区域引种和养殖逃逸造成的基因流有关,无序引种导致各地理种群之间遗传结构混杂,遗传分化降低。刘青等[19]通过微卫星标记分析辽河、黄河、长江三大水系野生与养殖中华绒螯蟹群体也发现,所有群体间未能形成明显的地理结构,呈现出种质混杂的现象。
养殖的DTH 群体与其他群体的FST值为-0.010~0.032,与WW 野生群体的遗传分化最低,基因流与FST值的结果相似。这表明DTH 群体在遗传上仍主要来源于长江野生群体,但其与其他群体之间的FST值也是群体间较低的水平,表明该养殖群体也与其他群体发生了混杂。相对而言,在本研究中盘锦养殖群体与其他群体间具有一定的遗传分化,这与刘青等[19]基于微卫星的研究结果相似。
分子变异分析结果显示,大部分遗传变异(97.84%)存在于中华绒螯蟹各群体内部,群体间的遗传变异极小,仅为2.16%。这与刘青等[19]基于微卫星对长江、黄河、辽河水系中华绒螯蟹野生和养殖群体的研究一致,表明本研究的5 个群体遗传变异多发生在群体内个体之间,群体间差异极小。
3.3 遗传结构
基于COI 构建的系统发育树及单倍型网络图显示,本研究的5 个中华绒螯蟹群体的17 个单倍型构成了一个大分支,而来自DTH 群体的单倍型Hap12(对应绒螯蟹个体DTH08)则与外群合浦绒螯蟹聚在一起构成了另一个分支,这显示了该个体与合浦绒螯蟹具有更近的母系亲缘关系。孙红英等[37]的研究显示,在长江铜陵江段及辽河都发现过具有合浦绒螯蟹Cyt-b 基因单倍型的绒螯蟹,表明合浦绒螯蟹单元型在北方水系也存在。Xu 等[21]基于线粒体COI 和Cyt-b 基因的研究也表明,长江流域中存在合浦绒螯蟹单倍型。尽管不能确定这种具有合浦绒螯蟹单倍型的个体是基因渐渗、共享祖先单倍型,还是人为活动导致的基因交流的结果[37],但可以确定的是,合浦绒螯蟹的线粒体基因单倍型存在于长江流域的中华绒螯蟹中。因此,个别具有合浦绒螯蟹单倍型的野生中华绒螯蟹被作为养殖亲本,从而导致在养殖群体中发现合浦绒螯蟹单倍型,是极有可能的。
系统发育树显示:本研究的中华绒螯蟹5 个群体混杂分布在系统发育树上,地理位置与单倍型之间没有形成明显的对应关系,单倍型网络图也显示各群体共享单倍型为主,较少有独有单倍型,这与葛家春等[14]、闫龙等[18]、Zhang 等[22]基于线粒体分析中华绒螯蟹种质资源的结果相似,都显示不同种群之间基因交流较为频繁,没有明显的遗传结构。
综上所述,目前野生中华绒螯蟹遗传多样性较低,尤其是在长江水系,反映了过度捕捞对种质资源的极大破坏。随着2019 年开始禁止对中华绒螯蟹等的商业捕捞以及从2020 年开始长江流域10年全面禁渔等措施的实施,将会对中华绒螯蟹野生种质资源的恢复和保护起到重要作用。同时,不同水系间的遗传混杂现象也应引起重视,在人工移植和增殖放流时必须做到科学管理,避免人为因素进一步破坏该经济物种的自然遗传结构。
