黄曲霉毒素B1、玉米赤霉烯酮和呕吐毒素的累加细胞毒性研究
2021-05-22王晓敏尹清强刘超齐杨小进
王晓敏, 常 娟, 王 平, 尹清强*, 刘超齐, 朱 群, 彭 峰, 杨小进
(1.河南农业大学动物科技学院,河南郑州450046;2.河南德邻生物制品有限公司,河南新乡453000;3.河南省正阳种猪场,河南正阳463612;4.洛阳欧科拜克生物技术股份有限公司,河南宜阳471611)
霉菌毒素广泛存在于粮食和动物饲料中,其是由真菌产生的有毒次级代谢产物(Cimbalo 等,2020),目前大约有100 多种真菌产生300 多种霉菌毒素(Wei 等,2019)。 我国2018 年饲料和原料中霉菌毒素污染情况调查报告显示,全国约99%的饲料和原料不同程度受到霉菌毒素污染, 其中85%以上的饲料和原料被2 种或2 种以上的霉菌毒素污染(雷元培等,2020)。 分析其原因主要如下:(1)一种霉菌可能会产生多种毒素,例如黄曲霉菌会产生黄曲霉毒素、赭曲霉毒素和桔霉素,禾谷镰孢菌会产生玉米赤霉烯酮和呕吐毒素等;(2)不同地区、不同环境、不同饲料受霉菌毒素污染的种类和严重程度不同, 当用来自不同地区和不同饲料原料来配制畜禽饲粮时, 导致多种霉菌毒素的污染不可避免。 在动物饲料中常见且危害较大的霉菌毒素主要有黄曲霉毒素B1(AFB1)、玉米赤霉烯酮(ZEA)、呕吐毒素(DON)。这三种霉菌毒素能够降低畜禽生产性能和机体免疫力, 对机体具有致癌性、基因毒性和生殖毒性,可严重危害机体健康 (黄珂等,2019;Meissommier 等,2006;Wang和Groopman,1999)。 据报道,多种霉菌毒素协同或累加作用对动物健康和生产性能的危害要比单一霉菌毒素作用的危害更大(Chang 等2020;李彦伸等,2020;Huang 等,2019)。 为了探索多种霉菌毒素的互作及累加细胞毒性, 本研究通过体外培养仔猪肠上皮细胞(IPEC-J2)试验,探究AFB1、ZEA 和DON 不同配比对IPEC-J2 细胞活力的联合损伤作用, 为后续研究多种霉菌毒素的同步降解奠定基础。
1 材料与方法
1.1 试验材料 DON 购自上海源叶生物科技有限公司,ZEA 和AFB1购自Sigma 公司;DON 定量检测试剂盒购自江苏省苏微微生物研究有限公司,AFB1和ZEA 定量检测试剂盒购自德国RBiopHarm 公司;仔猪肠上皮细胞(IPEC-J2)由河南农业大学动物营养与饲料生物技术实验室保存。
1.2 培养基的配制及细胞活力的测定(MTT 法)细胞培养基:10%胎牛血清、1%青链霉素混合液和89%高糖培养液充分混合均匀,4 ℃保存备用。取对数生长期细胞,常规消化计数后接种至96 孔板,100 μL/孔,每孔细胞数为1×104个,然后将细胞培养板置CO2培养箱培养24 h,吸弃掉原培养液,加入PBS 缓冲液清洗一遍,分别加入不同浓度的用细胞培养基稀释的霉菌毒素, 对照组加入与试验组相同体积的培养基, 每个处理组6 个重复。 24 h 后每孔加入10 μL 的MTT (终浓度为0.5 mg/mL),37 ℃、5% CO2培养箱中共同孵化4 h后,小心吸走培养液,加入150 μL 的DMSO,在低速振荡器上振荡10 min 使得甲瓒充分溶解,在酶标仪下测其490 nm 和630 nm 处的吸光度值(OD值),根据OD 值计算细胞活率公式为:细胞活力/%=(试验组OD490nm值-试验组OD630nm值)/(对照组OD490nm值-对照组OD630nm值)×100。
1.3 AFB1、ZEA、DON 对IPEC-J2 细胞毒性试验的响应面设计 利用Design-Expert 8.0.6 软件,将AFB1、ZEA 和DON 作为响应面Box-Behnke 设计的三个因素, 以AFB1:10、20、30 μg/L,ZEA:150、300、450 μg/L,DON:500、1000、1500 μg/L 分别作为Box-Behnke 设计三因素的三个编码水平。 设计因素与编码水平见表1。 将试验结果输入Design-Expert 软件进行分析,得出回归方程。根据线性回归方程, 得出霉菌毒素导致细胞高损伤和低损伤的组合比例。 为了体现自变量和因变量的关系,采用二次多项方程进行拟合,预测二次多项方程式如下:Y=β0+β1X1+β2X2+β3X3+β11X12+β22X22+β33X32+β12X1X2+β13X1X3+β23X2X3+β112X12X2+β113X12X3+β122X1X22;式中:Y 为细胞活力,%;X1、X2、X3为自变量, 分别对应AFB1、ZEA 和DON;β0为截距;β1、β2、β3为线性系数;β11、β22、β33为平方系数;β12、β13、β23、β112、β113、β122为交叉系数。

表1 Box-Behnke 设计因素及编码水平 μg/L
1.4 统计分析 试验数据经Excel 初步整理后,采用SPSS 25.0 软件进行One way ANOVA 方差统计分析,利用Duncan’s 法进行多重比较。 所有结果均以“平均值±标准差”表示,以P < 0.05 表示差异显著,P > 0.05 表示差异不显著。
2 结果与分析
2.1 不 同AFB1、ZEA 和DON 配 比 对IPEC-J2细胞活力的影响 由表2 可知, 试验1 组细胞活力最高,为50.05%,与试验6 组差异不显著(P >0.05),显著高于其余各组(P <0.05);试验17 组细胞活力最低,为39.02%,与试验1、6 组差异显著(P <0.05),与其余各组差异不显著(P >0.05)。
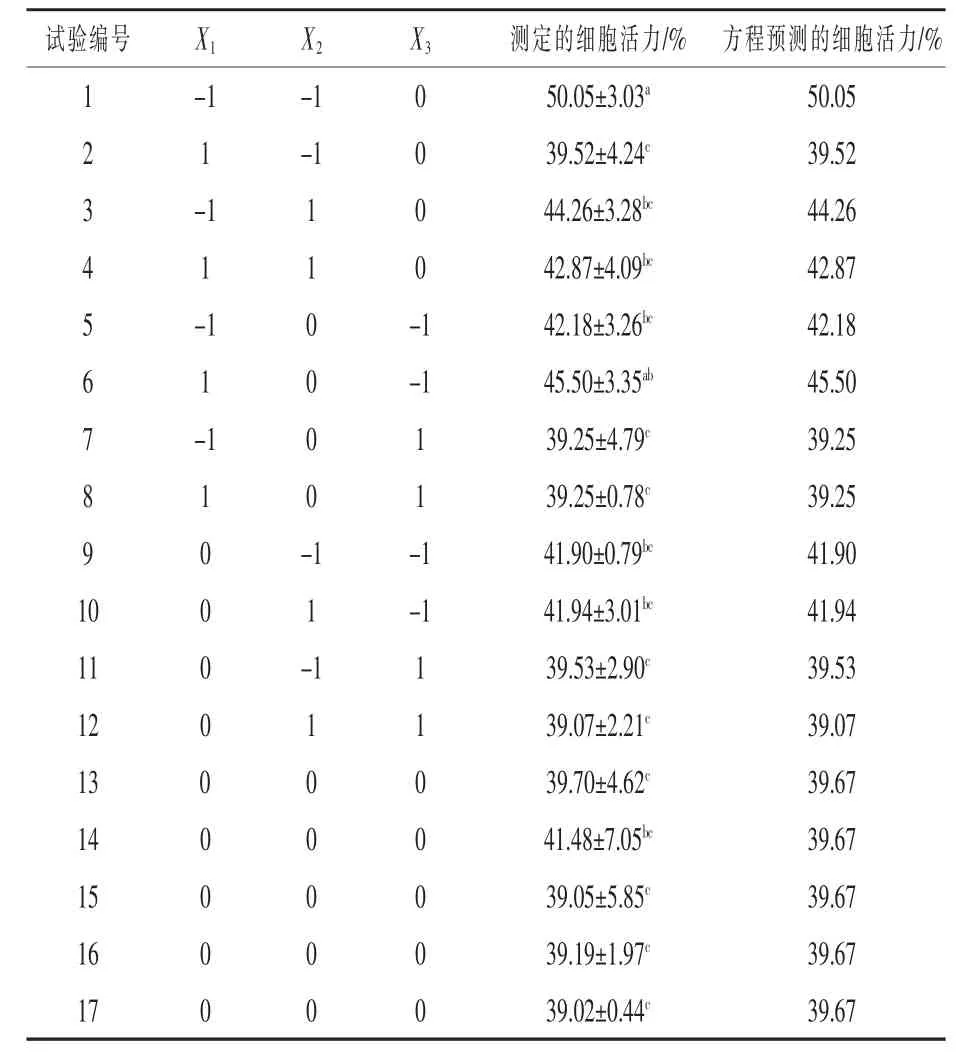
表2 Box-Behnken 设计参数与细胞活力
2.2 响应面模型构建及方差分析 把17 组霉菌毒素组合对IPEC-J2 细胞活力作为响应值Y,利用Design-Expert 8.0.6 软件对模型进行二次回归分析, 可得出回归方程:Y=39.67+0.83X1-0.11X2-1.31X3+2.28X1X2-0.83X1X3-0.13X2X3+2.72X12+1.78X22-0.85X32-0.50X12X2-0.99X12X3-3.81X1X22。对回归方程进行方差分析,结果见表3,该回归模型P <0.05,决定系数R2=0.97,表明该模型拟合度较好。从方程方差分析表P 值可得出各因素对 响 应 值 的 影 响 程 度,X1、X2、X3、X1X3、X2X3、X32、X12X2和X12X3对响应值的影响均不显著 (P >0.05),X1X2和X22对 响 应 值 的 影 响 显 著 (P <0.05),X12、X1X22的影响极显著(P <0.01),说明AFB1和ZEA 及其交互作用对细胞活力有显著影响(P <0.05)。经方程预测后,得到细胞活力最低(霉菌毒素毒性最高)的AFB1、ZEA 和DON 组合为30、150 μg/L 和1500 μg/L, 经测定细胞活力为32.32%;得到细胞活力最高(霉菌毒素毒性最低)的AFB1、ZEA 和DON 组合为10、150 μg/L 和600 μg/L,经测定细胞活力为53.01%。
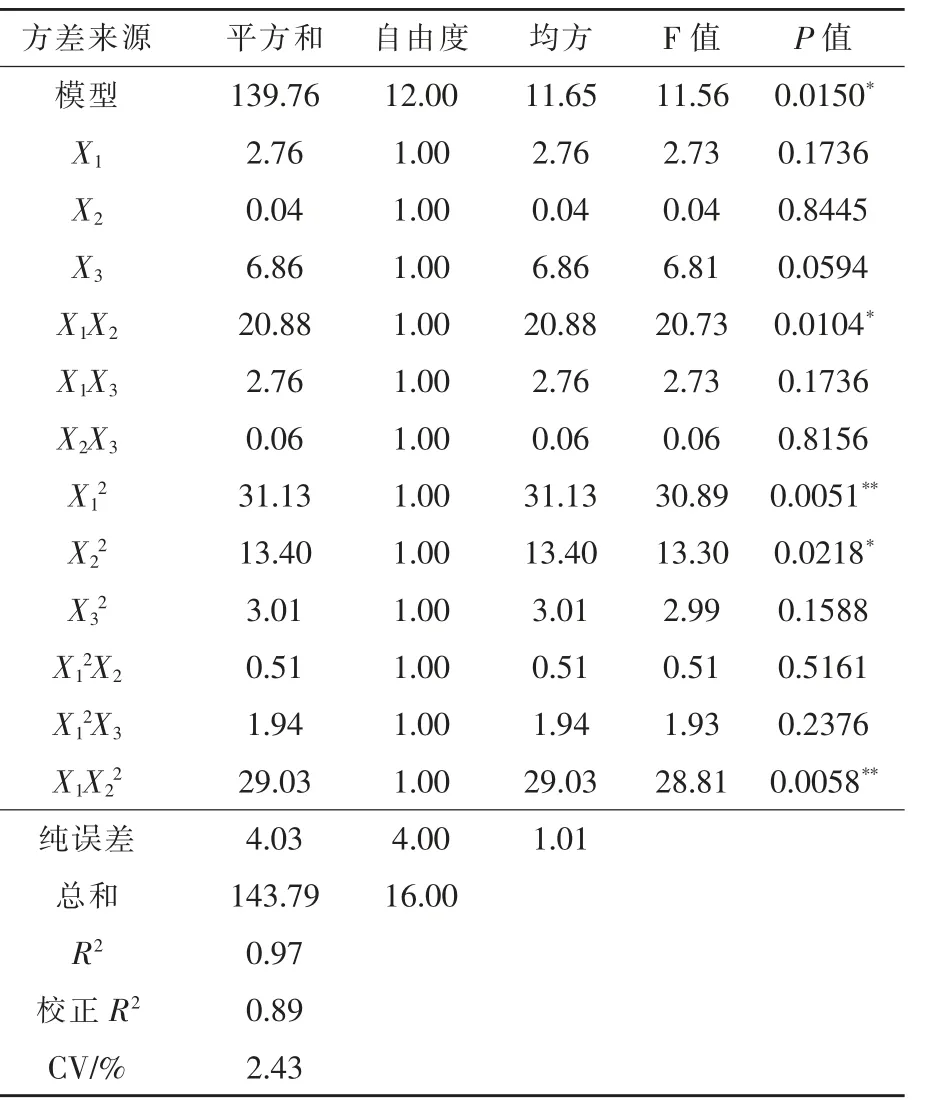
表3 细胞活力作为响应值时回归方程的方差分析
3 讨论
动物肠道是抵抗霉菌毒素侵入的第一道防线,动物摄入被霉菌毒素污染的饲料后,会引起肠道上皮细胞受损,以及严重肠道炎性反应,降低营养物质的吸收和消化功能以及肠道免疫力, 增加传染病的感染系数(潘佳雯等,2018)。在严重情况下,还可导致动物死亡,并通过食物链在人和动物体内积聚,从而危及人类和动物的健康。有研究表明,AFB1会损伤动物肠道正常的组织形态, 破坏肠道黏膜的物理屏障功能, 同时对肠道化学屏障和免疫屏障产生影响(齐灿灿等,2017)。 ZEA 是一种雌激素类似物, 其与雌激素受体结合会造成动物体内生殖激素紊乱, 破坏生殖系统、 免疫系统,还具有遗传毒性和细胞毒性(Gao 等,2018)。DON 对细胞的毒性主要是改变细胞形态和分化。促进炎性因子的升高和细胞凋亡, 抑制蛋白合成来影响肠上皮细胞完整性 (Pinton 和Oswald,2014)。 多种霉菌毒素累加危害的研究表明,AFB1分别与ZEA 或赭曲霉毒素A(OTA)两两联合或3种毒素的联合均能影响奶山羊肠道微生物区系的结构,其中3 种毒素联合毒性更强,对肠道微生物区系结构影响也越大 (范彩云等,2017)。 武晨清(2020) 用AFM1、OTA 和ZEA 处理Caco-2/HT29-MTX 细胞后,肠上皮细胞的通透性增强,紧密连接蛋白(TJ 蛋白)的形态改变,TJ 蛋白的结构被破坏;并证明AFM1与OTA、ZEA 共存时, 对肠道屏障功能的影响更为严重, 这与TJ 蛋白定位的改变和黏蛋白分泌的减少有关。 本研究结果表明,不同种类和不同剂量的霉菌毒素配伍,对IPEC-J2 细胞的损伤程度不同,得到了多种霉菌毒素导致猪肠道细胞高损伤和低损伤的组合模型,为研究多种霉菌毒素的累加细胞毒性及同步降解提供了依据。
4 结论
本研究利用响应面回归设计, 得到了导致IPEC-J2 细 胞 高 损 伤 和 低 损 伤 的AFB1、ZEA 和ZON 配伍比例,为研究多种霉菌毒素的累加细胞毒性奠定了基础。
