干细胞修复牙槽骨缺损:微环境认知新进展
2021-05-21杨艳兰徐普
杨艳兰,徐普
中南大学湘雅医学院附属海口医院口腔中心/海南省口腔医学中心种植科,海口 570208
牙周疾病常造成牙槽骨缺损,自体骨移植及骨替代材料植入为临床常规的治疗方法。自体骨移植具有良好的骨诱导性、骨传导性及成骨性,但不能避免感染、出血、神经损伤、供体不足及移植后骨吸收等一系列问题,而骨替代材料则缺乏骨诱导性且存在免疫炎症反应等问题[1]。虽然自体骨移植仍是修复骨缺损的“金标准”[2],但现有诊疗技术仍有诸多缺陷无法克服。近年来,基于干细胞的组织工程替代疗法成为研究热点。口腔组织是干细胞的重要来源之一,基于干细胞的牙周组织再生治疗已部分应用于牙槽骨缺损的治疗,但干细胞移植后的存活情况及疗效仍有较多不确定因素,限制了其在临床上的应用[3]。本文从微环境角度着重介绍了局部微环境对干细胞功能的影响及调控作用,并介绍了干细胞衍生的外泌体在牙周组织尤其是牙槽骨缺损修复中的治疗潜能,旨在强调微环境对干细胞的影响,以探索最佳治疗方案。
1 口腔来源干细胞在牙周组织再生中的作用
常见的口腔来源干细胞有牙周膜干细胞(PDLSCs)、根尖乳头干细胞(SCAPs)、牙髓间充质干细胞[包括乳牙牙髓间充质干细胞(SHED)、恒牙牙髓间充质干细胞(DPSC)]等。口腔来源干细胞具有良好的免疫耐受性,可安全地用于同种异体移植。除免疫调节功能外,口腔来源干细胞还可通过抑制氧化应激水平而减轻移植后的免疫炎症反应。干细胞移植后,可产生类似于牙骨质及牙周膜的结构,诱导新骨形成,促进血管新生,进而恢复部分牙齿功能、替代牙槽骨缺失、重建受损的唾液腺功能、促进下颌骨髁突再生、治疗髁突变性、促进缺失或损伤舌组织再生、恢复部分舌组织功能等[4](表1)。

表1 口腔来源干细胞修复牙周缺损的主要作用Tab.1 The main role of oral-derived stem cells in repairing periodontal defects
然而,干细胞治疗的疗效受供体和受体微环境的双重影响。了解病变微环境对干细胞的影响及其可能机制,优化干细胞治疗策略,是目前基于干细胞的口腔再生疗法面临的重大挑战。
2 干细胞诱导牙周组织再生的微环境调控机制
微环境是指移植干细胞的周围结构及成分,包括邻近细胞和组织、激素、各种生长因子/细胞因子、代谢状态等[5]。充足的血供、分子信号转导通路、细胞增殖与分化,是微环境中影响干细胞再生修复的关键。在牙周炎微环境中,干细胞在胰岛素样生长因子1(IGF-1)、血管内皮生长因子(VEGF)、转化生长因子-β1(TGF-β1)、肿瘤坏死因子-α(TNF-α)等生长因子介导下可促进血管新生,诱导肉芽组织形成;在成骨分化过程,TNF-α可通过核因子κB(NF-κB)信号转导通路,增加细胞外基质的矿化,并上调骨矿化相关基因的表达,如骨形态发生蛋白2(BMP2)、碱性磷酸酶(ALP)、成骨特异性转录因子(Runx2)等。此外,TGF-β1可通过哺乳动物雷帕霉素靶蛋白(mTOR)信号通路刺激Runx2及骨钙素(OPG)的产生,促进成纤维细胞合成胶原并成骨分化。OPG在白细胞介素(IL)-6的刺激下,可正反馈诱导成骨细胞的骨矿化[6]。
细胞外基质的合成与矿化是影响牙周再生的重要因素。干细胞可在降低基质金属蛋白酶(MMP)-1、MMP-8表达的同时增加基质金属蛋白酶抑制剂(TIMP)-2、TIMP-4的表达,使成骨分化过程中的细胞外基质重构处于最佳状态[7]。此外,血液中的单核细胞及辅助T细胞(Th)2可通过分泌IL-10负向调节NF-κB受体活化子配体(RANKL),活化T细胞核因子1(NFATC1)及巨噬细胞集落刺激因子(M-CSF),促进OPG的表达,发挥减少骨吸收、降低破骨细胞分化及活化的作用,同时还可减轻Th1引起的炎症反应,改善炎症微环境。
此外,口腔来源干细胞介导的免疫调节在牙周组织再生中也发挥着重要作用。Toll样受体(TLR)是参与非特异性免疫的一类重要蛋白质分子。在炎症微环境下,TLR3、TLR4激动剂可增强牙源性干细胞的免疫抑制作用,从而抑制外周血单核细胞的增殖。此外,干细胞分泌的IL-6、IL-8等炎性因子亦可影响TLR的表达。还有研究发现,牙源性干细胞的免疫功能受微环境中TGF-β、TNF-α、γ干扰素(IFN-γ)等生长因子的调节;此外,牙源性干细胞还可通过激活补体系统促进牙周组织再生[8]。
最后,干细胞定植后,在微环境中IL-6、抑瘤素M(OSM)等细胞因子介导下,可通过酪氨酸激酶3(JAK3)、信号传导与转录激活子3(STAT3)等信号转导通路分化为成骨细胞、成纤维细胞等,并分泌牙骨质蛋白1抗体(CEMP1)和Ⅰ型胶原蛋白(COL-Ⅰ),分别合成牙根牙骨质及牙周韧带的胶原纤维,促进牙周组织的再生[9]。图1展示了干细胞的微环境调控机制。
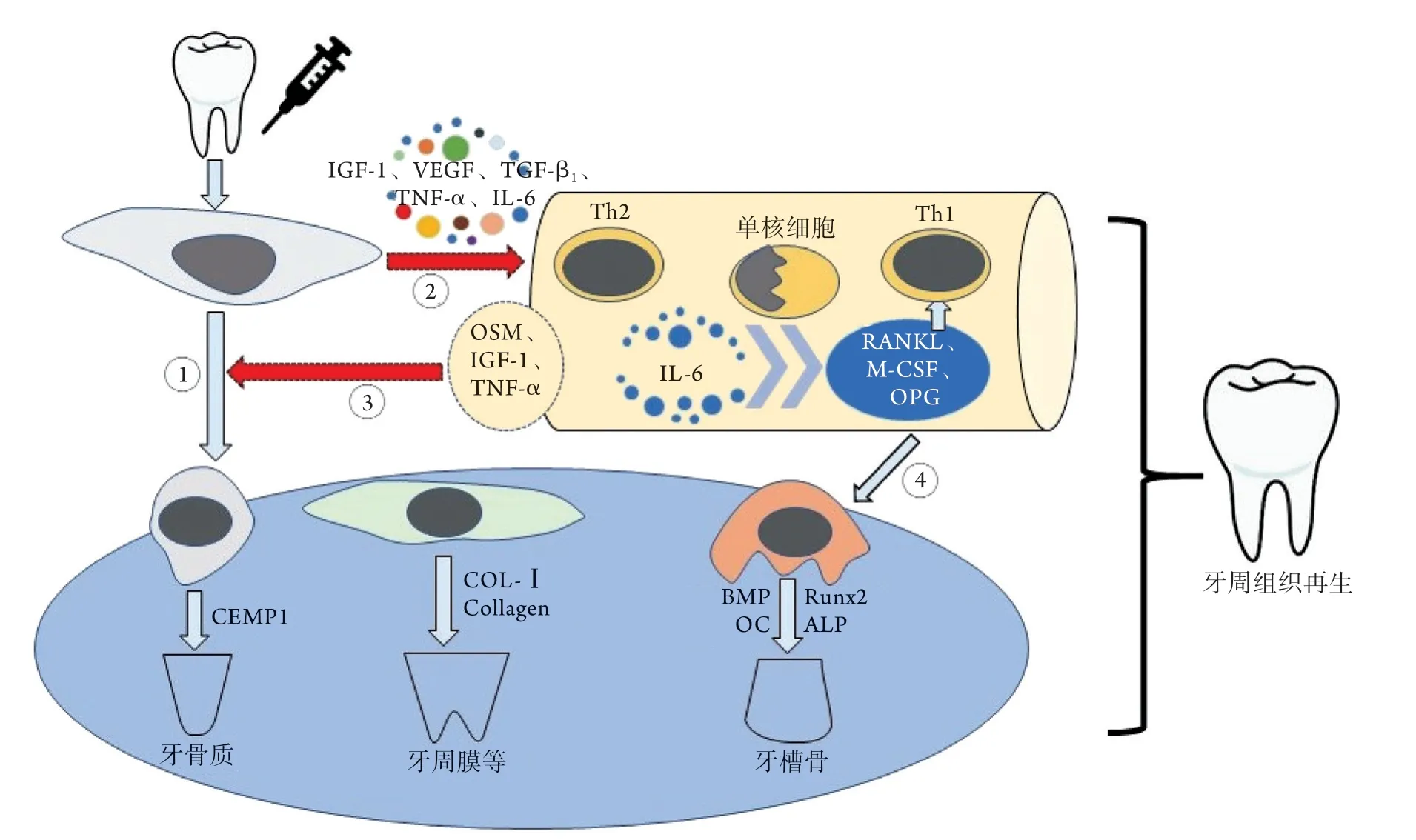
图1 干细胞诱导牙周组织再生的微环境调控机制Fig.1 Microenvironmental regulation mechanism of stem cells inducing periodontal tissue regeneration
3 微环境对干细胞功能的影响
移植微环境,如宿主激素水平、代谢状态及免疫调节等,均为影响干细胞功能的重要因素。研究发现:(1)当干细胞移植至损伤部位时,可通过抑制局部IFN-γ及TNF-α等炎性因子,促进骨缺损的修复;(2)在关节炎发病时短期应用硼替佐米可改善炎性微环境,增强干细胞的治疗效果;(3)控制糖尿病患者的血糖水平,可提高干细胞疗效;(4)干细胞移植前输注T细胞,可改善免疫介导的干细胞异位骨再生[10]等。
3.1 激素水平 激素是微环境的重要组成部分,可影响干细胞的增殖、分化及成骨-破骨细胞间的平衡。宿主微环境中的激素水平处于最佳平衡状态时,可促进干细胞诱导的牙周组织再生。如17β-雌二醇在微环境中表皮细胞生长因子(EGF)、碱性成纤维细胞生长因子2(bFGF2)等生长因子的刺激下,可促进干细胞向神经元的分化[11]。但是,雌激素缺乏可造成活性氧大量聚集,从而诱导干细胞凋亡[12-13];而雌激素过高,则可影响干细胞表面的雌激素受体(ER)-α、ER-β的表达,导致细胞衰老[14]。甲状旁腺激素可促进干细胞的成骨诱导分化,减轻移植后的氧化应激反应,促进干细胞的存活[15]。如Pang等[16]、Zhao等[17]的体外实验发现,适当增加甲状旁腺激素浓度,可通过c-Jun氨基末端激酶(JNK)及p38丝裂原活化蛋白激酶(p38MAPK)磷酸化途径调节SCAPs的成牙/成骨分化,增强干细胞的成骨分化能力。糖皮质激素常用于干细胞的体外成骨诱导,然而,过量的糖皮质激素可抑制干细胞增殖,降低其成骨潜能,导致骨质丢失[18-19]。胰岛素是由胰岛β细胞分泌的一种蛋白质激素,可激活磷脂酰肌醇3激酶/蛋白激酶(PI3K/Akt)通路,调节线粒体呼吸,促进干细胞存活[20];类胰岛素生长因子结合蛋白(IGFBP)可通过JNK及细胞外调节蛋白激酶(ERK)信号通路增强牙髓干细胞的牙本质再生潜能[21]。
虽然宿主微环境中的各种激素对干细胞的再生潜能至关重要,但具体的修复机制及最佳的激素水平仍需进一步探索。
3.2 代谢状态 代谢状态也是影响干细胞功能的重要因素[22-23]。干细胞在体内主要通过糖酵解及有氧分解获得能量,然而葡萄糖浓度过高可损害干细胞的功能及成骨分化能力,促进细胞衰老,增加骨质疏松、骨折及牙周疾病的患病风险,如糖尿病合并牙周炎患者的PDLSCs分化潜能明显降低。在糖尿病患者中,直接注射干细胞治疗骨质疏松的疗效较差,但在输注干细胞前注射胰岛素,改善机体血糖水平后则可明显提高其疗效[10]。高脂血症可影响牙骨质的合成代谢,抑制ALP、Runx2及miR-29a-3p基因的表达,从而引起骨整合受损、骨质丢失,最终抑制干细胞的成骨分化潜能[24]。Liu等[25]的研究发现,牙龈间充质干细胞(GMSCs)可调节高脂血症牙周炎小鼠的脂质代谢,抑制炎症,促进新骨形成及牙槽骨高度升高,改善牙周组织的再生。此外,GMSCs还可抑制高脂血症相关的牙周炎小鼠模型中M1巨噬细胞的活化,通过免疫作用调节脂质代谢,减轻炎症反应,促进骨再生[26]。因此,宿主的代谢状态直接影响移植后的细胞功能。患者在细胞移植前调整至最佳的血糖、血脂水平,可极大地提高干细胞的疗效。
3.3 免疫调节 炎症微环境是干细胞介导的免疫调节及骨愈合的关键[18,27]。口腔来源干细胞在微环境中各种生长因子/细胞因子的介导下,可调控T细胞、B细胞、巨噬细胞、中性粒细胞等的功能,影响骨和牙体组织再生[28]。牙髓干细胞表达的C3a、C5a可激活补体系统,影响干细胞的增殖及活化。口腔来源干细胞的再生及免疫调节功能受微环境中TGF-β、TNF-α、IFN-γ等细胞因子的调节。TNF-α、IFN-γ可通过抑制T细胞活性降低干细胞的成骨分化潜能,但高浓度的TNF-α可诱导干细胞凋亡。有研究将干细胞注射至牙周缺损部位后,观察到明显的牙周组织再生,且局部IL-1β、TNF-α、IFN-γ等的表达也明显降低[29]。当T细胞与干细胞同时注射时可明显促进骨缺损的修复[30-31]。
口腔来源干细胞与免疫系统相互作用,且受微环境中各种炎性因子的调节。但口腔来源干细胞的免疫调节功能与其在不同口腔组织中再生潜能的具体机制仍需进一步探索。
4 优化干细胞治疗策略
虽然干细胞在牙周疾病治疗中已显示出诸多优势,但影响干细胞疗效的因素较多且不易控制。优化或恢复宿主正常微环境,增强干细胞对病变微环境的耐受能力,恢复受损干细胞的功能,提高干细胞疗效仍是目前的研究重点[10,32-33]。
4.1 预防性干预 如女性绝经后预防性应用雌激素可提高干细胞的成骨潜能,预防骨质疏松;改善高血糖状态可延缓干细胞衰老,增强成骨能力,增加骨密度,降低骨折的风险;口服白藜芦醇可改善干细胞的成骨潜能,调节成骨-破骨平衡,减少牙槽骨质丢失,抑制炎症及氧化应激损伤[34];抗炎治疗可恢复干细胞功能,有利于牙周炎患者牙槽骨及牙组织的治疗等。
4.2 根据微环境状态选择适当的干细胞类型 骨再生治疗可首选骨髓间充质干细胞(BMSCs);骨质疏松者可选择雌激素缺乏供体的脂肪间充质干细胞(ADMSCs),较BMSCs更易适应病变微环境[27,35];牙周疾病者可首选PDLSCs[36]。此外,可通过基因修饰增强干细胞对病变微环境的耐受能力,增强干细胞功能[37],如在雌激素缺乏骨缺损小鼠中,通过基因修饰可上调移植干细胞miR-26a基因的表达,促进骨缺损愈合。最后,还可通过体外干预增强干细胞的功能,如组蛋白甲基化抑制剂(DZNep)可增强病变微环境中干细胞的成骨潜能[38],小分子化合物可增强干细胞再生潜能[39],低浓度IFN-γ可增强干细胞免疫调节功能[40]、促进成骨等。
5 总结与展望
虽然干细胞在口腔组织损伤修复中有着巨大的应用前景,但不论是内源性修复还是外源性移植,均受到局部微环境的调控。本文从微环境与干细胞相互作用的角度出发,较全面地概述了干细胞修复口腔组织的微环境调控机制,并强调了机体内环境,包括激素、代谢、免疫等因素对干细胞功能的影响。然而,如何在病变微环境中提高干细胞移植的疗效仍然面临诸多挑战。
通过基因修饰提高外源性干细胞的功能或改善病变微环境均为有效可行的策略。近年来,有研究发现,外泌体对组织缺损修复的潜在作用优于单分子药物、细胞、合成脂质体等[41]。此外,外泌体具有易于获取及储存,安全性高,对受体微环境的适应能力较强等优点,在骨和口腔组织尤其是牙槽骨的缺损治疗中潜力巨大[42-43]。下一步可研究干细胞衍生的外泌体用于口腔组织再生治疗的可行方法,以促进无细胞治疗策略的建立,并揭示干细胞治疗的机制。此外,还需建立特定的口腔疾病模型,进一步了解干细胞影响供体和宿主微环境的生物学过程,加深对干细胞治疗时微环境调控的认识,优化并构建更有效的治疗策略。
