蒲公英多糖的分级醇沉及其降血糖和抗氧化活性研究
2021-05-21郭慧静陈国刚赵志永
郭慧静,陈国刚,赵志永
(1.新疆农垦科学院农产品加工研究所,新疆石河子 832000;2.石河子大学食品学院,新疆石河子 832000)
0 引言
蒲公英(Taraxacum mongolicum Hand.-Mazz) 是一种药食同源的多年生草本植物,为菊科蒲公英属,又名华花郎、婆婆丁等[1]。蒲公英是一味传统的中草药,其花、叶、根均可入药,具有清热解毒、消肿散瘀、排毒利尿等功效[2]。有研究结果表明,蒲公英全草中含有甾醇类、香豆素类、多酚类、黄酮类及糖类等多种功能成分[3-4]。其中,多糖作为蒲公英功能成分的重要组成之一具有重要的研究价值。已有报道指出,蒲公英多糖具有较强的抗氧化活性[5]和抗菌活性[6],此外还可以显著提高小鼠的胸腺指数和吞噬指数等,并促进免疫器官的生长发育,从而增强小鼠的免疫功能[7]。石丹等人[8]研究发现蒲公英多糖还可以改善林可霉素诱导的小鼠肠道菌群失调,表明其具有微生态调节的作用。以上研究集中在蒲公英多糖的药理活性方面,对于其成分及结构方面的报道还相对较少,高金波等人[9]采用柱前衍生化法测定蒲公英多糖中的单糖组成,表明主要由鼠李糖、葡萄糖、半乳糖、木糖和阿拉伯糖组成。Chen M 等人[10]经阴离子柱和凝胶柱分离纯化蒲公英多糖得到一个均一的水溶性多糖组分,该组分的分子量为80 kDa,单糖组成为鼠李糖、阿拉伯糖、半乳糖。
目前,对蒲公英多糖提取方法的研究较多,而有关醇沉分级纯化蒲公英多糖及不同组分的成分、结构和生物活性的报道还相对较少。为了进一步探究蒲公英多糖的结构和生物活性,试验利用分级醇沉的方法对超声辅助提取得到的蒲公英多糖进行纯化分级,得到相应的多糖组分,测定不同组分的糖含量、蛋白质含量及糖醛酸含量等理化指标,并采用GC-MS 分析各组分的单糖组成,并比较各组分的体外降血糖和抗氧化活性,筛选出活性较高的组分,为蒲公英多糖的深入研究和开发应用提供理论依据。
1 材料与方法
1.1 材料和试剂
蒲公英全草,采自新疆哈密地区,经石河子大学药学院韩博教授鉴定为菊科蒲公英属植物。将原料洗净,置于50 ℃烘箱中干燥,备用。α - 葡萄糖苷酶、考马斯亮蓝G-250,上海源叶生物技术有限公司提供;PNPG,上海宝曼生物科技有限公司提供;牛血清蛋白,美国AMRESCO 公司提供;单糖标准品,美国Sigma 公司提供;浓硫酸、苯酚、吡啶、咔唑、维C、无水乙醇、邻苯三酚、1,1 - 二苯基- 2 - 三硝基苯肼(DPPH)、三羟甲基氨基甲烷(Tris)、三氟乙酸、醋酸酐等,均为国产分析纯。
1.2 仪器和设备
HH-2 型数显恒温水浴锅,荣华仪器制造(江苏) 有限公司产品;KQ-200VDE 型双频数控超声波清洗器,昆山市超声仪器有限公司产品;Multifuge X1R 型高速冷冻离心机,赛默飞世尔科技有限公司产品;DGG-9053AD 型电热恒温鼓风干燥箱,上海森信实验仪器有限公司产品;RE-3000 型旋转蒸发仪,上海亚荣生化仪器厂产品;FDU-1200 型冷冻干燥机,上海爱朗仪器有限公司产品;UV-2600 型紫外分光光度计,日本岛津仪器有限公司产品;Nicolet iS10 型傅立叶变换红外光谱仪,美国Thermo Fisher Scientific 公司产品;QP2010 型气相色谱- 质谱联用仪,日本岛津公司产品。
1.3 试验方法
1.3.1 蒲公英多糖提取工艺流程
蒲公英原料→烘干→粉碎过筛→脱色、脱脂→超声处理→热水浸提→抽滤、浓缩→乙醇沉淀→蒲公英粗多糖→分级醇沉→冷冻干燥→蒲公英多糖不同醇沉组分。
1.3.2 蒲公英多糖的分级醇沉
将得到的蒲公英多糖配制成10%的多糖溶液,以转速8 000 r/min 离心10 min,去除不溶性杂质。在溶液中加入无水乙醇,使得其体积分数达到20%,于4 ℃冰箱中放置12 h,离心分离收集多糖获得20%醇沉组分。在上清液中继续加入无水乙醇,使得乙醇体积分数达到40%,4 ℃下醇沉过夜,离心分离获得40%多糖组分。按照上述方法,依次得到20%,40%,60%,80%的多糖醇沉组分。所得沉淀用蒸馏水透析72 h,透析液蒸发浓缩后进行冷冻干燥,得到不同多糖组分(依次为PD-20,PD-40,PD-60 和PD-80)。
1.3.3 不同组分化学组成分析
采用苯酚- 硫酸法[11]对不同组分总糖含量进行测定。以葡萄糖为标准品,于波长490 nm 处测定糖含量,以葡萄糖质量浓度X 为横坐标、吸光度为纵坐标,得到标准曲线:Y=0.015 5X-0.009 8,R2=0.999 6。采用考马斯亮蓝G-250 法[12]测定蛋白含量。以牛血清蛋白为标准品,于波长595 nm 处测定蛋白质含量,以牛血清蛋白质量浓度X 为横坐标,吸光度为纵坐标,得到标准曲线:Y=0.006 2X+0.010 9,R2=0.999 2。采用硫酸- 咔唑法[13]测定糖醛酸含量。以半乳糖醛酸为标准品,于波长530 nm 处测定糖醛酸含量,以半乳糖醛酸质量浓度X 为横坐标,吸光度为纵坐标,得到标准曲线:Y=4.586 5X-0.029 6,R2=0.999 7。
1.3.4 不同组分单糖组成分析
称取3 mg 待测多糖样品溶解于2 mol/L 三氟乙酸中,在温度120 ℃下水解2 h 后用甲醇反复蒸发除去三氟乙酸,残基溶于蒸馏水中并在室温下用硼氢化钠还原3 h,加适量冰醋酸中和过量的硼氢化钠。中和后蒸发至干,残渣用乙酸酐在100 ℃下乙酰化1 h,冷却后加入甲苯旋转蒸发除去多余的醋酐。乙酰化产物用3 mL 氯仿溶解,加入少量蒸馏水充分混合后除去上层水溶液,最后用无水硫酸钠除去氯仿层的水分,定容至10 mL 后进行GC-MS 检测。
GC-MS条件如下:RXI-5 SIL MS色谱柱(30 m×0.25 mm×25 μm);升温程序:起始温度为120 ℃,以3 ℃/min 升到250 ℃,保持5min;进样口和检测器温度为250 ℃,载气为氦气,流速为1 mL/min。
1.3.5 光谱分析
参照Wang L 等人[14]方法,用蒸馏水配制2 mg/mL的多糖溶液,于波长200~400 nm 处进行紫外扫描,根据扫描图判断是否存在核酸及蛋白质。参照Chen G等人[15]方法,称取多糖待测组分各2 mg,加入100 mg烘干至恒质量的KBr,置研钵中研磨均匀,用电动压片机压片,在4 000~400 cm-1进行红外光谱扫描。
1.3.6 抑制α - 葡萄糖苷酶活性测定
根据文献[16]方法并稍加修改,取浓度为0.2 U/mL α - 葡萄糖苷酶溶液0.1 mL 加入0.1 mol/L 磷酸盐缓冲液2 mL(pH 值6.8),于37 ℃下水浴15 min,加入样品溶液反应10 min 后再加入25 mmol/L PNPG 0.25 mL。水浴30 min 后,加入0.1 mol/L Na2CO3溶液2 mL 终止反应,于波长400 nm 处测定吸光度(A2);以1 mL 缓冲液替代样品溶液,测其吸光度值为(A0);以0.1 mL 缓冲液替代酶液测其吸光值为(A1)。重复测定3 次,并以阿卡波糖为阳性对照。
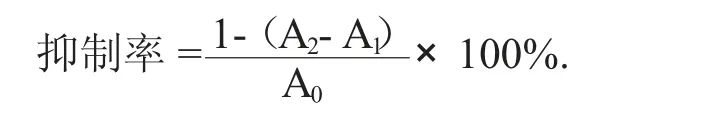
此外,酶活力定义为温度37 ℃,pH 值6.8 条件下,1 min 内水解底物(PNPG) 产生1 μmol 对硝基苯酚所需的酶量为一个酶活力单位(U)。
1.3.7 抗氧化活性测定
(1) 清除DPPH 自由基活性测定。参照Liu Y 等人[17]方法,稍加修改。依次移取质量浓度为0.2,0.4,0.6,0.8,1.0 mg/mL 的多糖溶液2 mL,分别加入0.1 mmoL DPPH - 乙醇溶液2 mL,混合均匀后常温暗处反应30 min。维C 溶液作阳性对照,于波长517 nm 处测定吸光值,并以下式计算清除能力:
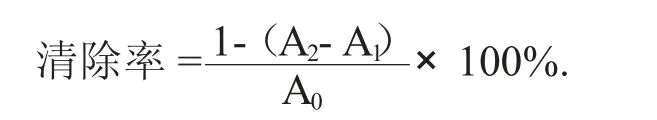
式中:A2——DPPH 溶液和样品混合物的吸光度;
A1——没有添加DPPH 溶液样品的吸光度;
A0——没有添加样品的DPPH 溶液的吸光度。
(2) 清除超氧阴离子活性测定。参照Bo J 等人[18]方法,略作修改。将50 mmol/L Tris-HCl 缓冲液4.5 mL(pH 值8.2) 和0.2 mL 不同质量浓度的多糖溶液在25 ℃下水浴20 min。加入25 mmol/L 邻苯三酚溶液0.2 mL,静置反应5 min 后立即加入0.1 mL HCl 溶液(10 mol/L) 终止反应,并于波长320 nm处测定吸光度。以维C 作为阳性对照,并利用以下公式计算清除能力:
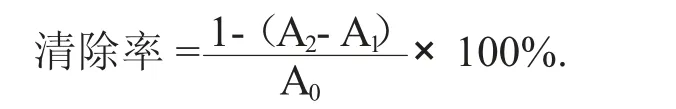
式中:A2——邻苯三酚和样品混合物的吸光度;
A1——未加邻苯三酚的样品吸光度;
A0——未加样品的邻苯三酚的吸光度。
1.4 数据分析
试验结果采用3 次重复平均值±标准差(SD)表示,采用Excel 2010,SPSS 19.0 软件对数据进行统计分析,用Origin 8.0 软件作图。
2 结果与分析
2.1 分级醇沉样品化学组成分析
分级醇沉制备的蒲公英多糖样品为淡黄色粉末,可溶于水,不溶于无水乙醇、甲醇等有机溶剂。
不同组分蒲公英多糖的化学组成见表1。
其中,PD-40 和PD-80 的总糖含量较高,且PD-80 最高,总糖含量达到64.41%,而PD-20 含量最低,为32.73%。4 个组分的糖醛酸含量没有显著差异,范围为25%~30%。4 个组分的蛋白质含量都较高,为17%~27%,差异不显著,推测4 种组分多糖均为蛋白结合的复合物。由表1 可知,4 个组分中总糖、糖醛酸、蛋白质三者含量之和均达到90%,纯度较高,可以用来进一步分析。
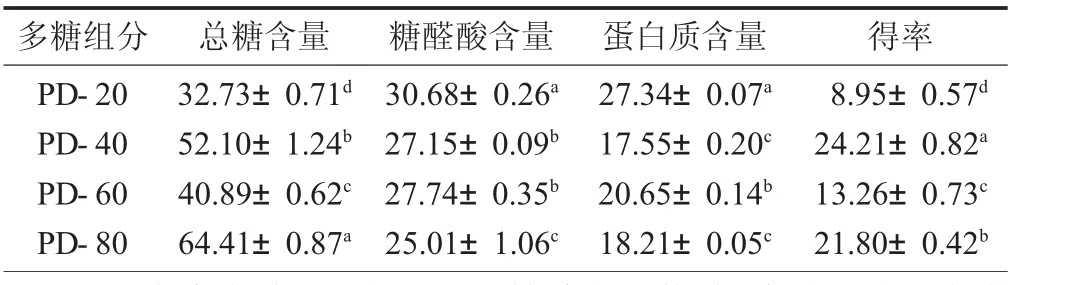
表1 不同组分蒲公英多糖的化学组成/%
2.2 分级醇沉样品单糖组成分析
7 种单糖标准品的气相色谱结果见图1。
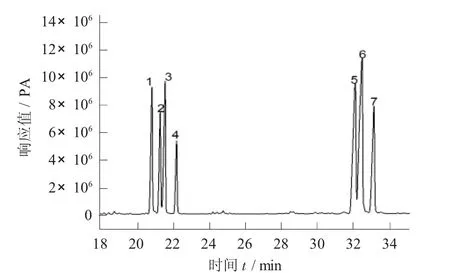
图1 7 种单糖标准品的气相色谱结果
由图1 可知,这7 种单糖标准品的衍生物分离程度较好。通过GC-MS 检测,分级醇沉所得的各组分蒲公英多糖的单糖组成分析结果。
不同组分蒲公英多糖的单糖组成物质的量比见表2。
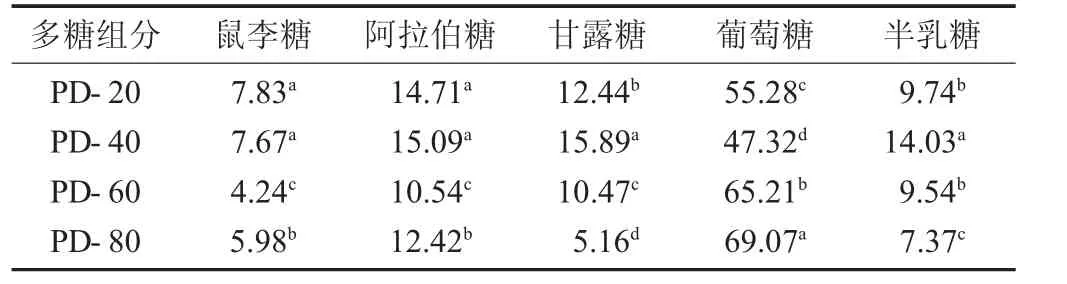
表2 不同组分蒲公英多糖的单糖组成物质的量比/%
由表2 可知,4 种组分样品所含有的单糖种类相同,均含有除了岩藻糖和木糖之外的其他5 种单糖,但单糖组成比例存在显著差异。其中,各组分中葡萄糖含量最高,其次是阿拉伯糖,鼠李糖含量最低。
2.3 紫外光谱分析
不同组分多糖紫外扫描图谱见图2。
蒲公英多糖分级醇沉得到4 个组分在波长200~400 nm 经紫外扫描后的结果。
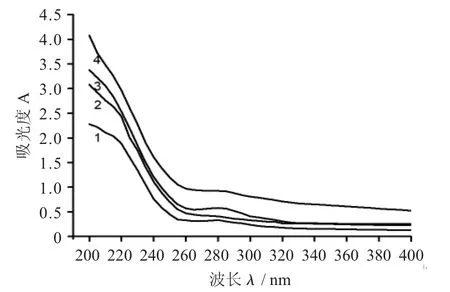
图2 不同组分多糖紫外扫描图谱
由图2 可知,这4 种样品于波长260 nm 处均没有吸收峰,表明4 种多糖均不含核酸,于波长280 nm处均有吸收峰,其中PD-20 吸收峰最明显,这表明4 个组分中都含有蛋白质,且PD-20 蛋白质含量最高,这与2.1 化学组成分析中蛋白质含量的测定结果基本一致。
2.4 红外光谱分析
不同组分多糖红外扫描图谱见图3。
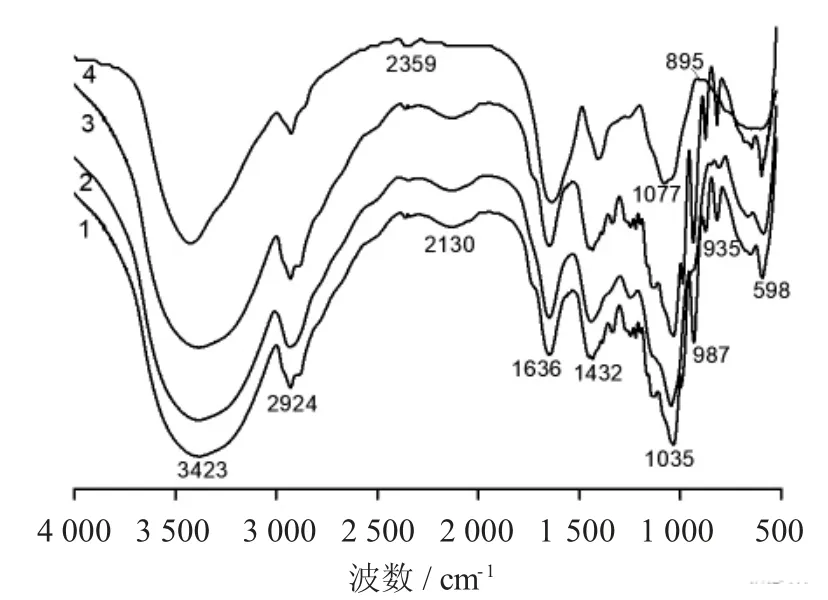
图3 不同组分多糖红外扫描图谱
由图3可知,4 个组分的红外光谱扫描图十分相似,这表明4 个组分中的化合物组成及其分子结构基本相同,这与组分的理化性质及单糖组成测定结果基本一致。以PD-20 为例,其中3 423 cm-1左右宽而强的吸收峰是由O-H 伸缩振动引起的;2 924 cm-1左右的吸收峰是甲基或亚甲基C-H 伸缩振动引起的,而1 400~1 200 cm-1的一组吸收峰是C-H 变角振动形成的,以上3 个吸收峰为多糖的特征吸收峰[17],由此可以初步判定PD-20~80 这4 个组分均为多糖。在1 636 cm-1左右的吸收峰由C=O 伸缩振动形成的,表明糖醛酸的存在;1 035 cm-1和1 077 cm-1左右的吸收峰是由C-N 伸缩振动形成的,由此可以推断这4 个组分中均含有蛋白质,这与化学组成分析和紫外扫描结果一致。图中1 432 cm-1处的吸收峰是表明存在糖醛酸;890~1 200 cm-1的吸收峰是β - 吡喃型糖苷的特征吸收峰。
2.5 蒲公英多糖体外降血糖活性研究
不同组分多糖对α- 葡萄糖苷酶的抑制率见图4。
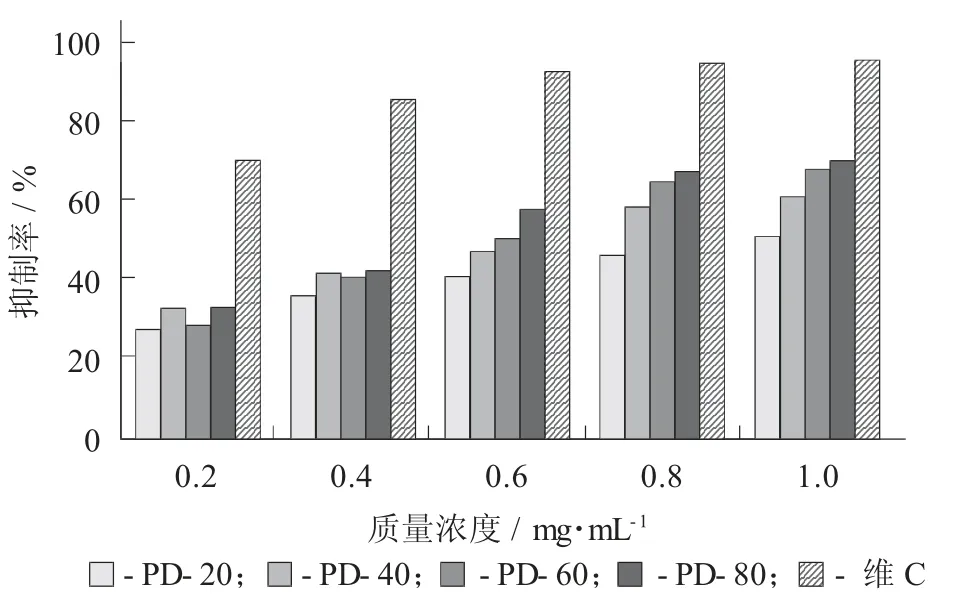
图4 不同组分多糖对α - 葡萄糖苷酶的抑制率
由图4 可知,4 个组分多糖样品在试验浓度范围内均具有一定的α - 葡萄糖苷酶抑制能力,且随着质量浓度的增加,抑制能力逐渐增强。此外,随着乙醇体积分数的升高,IC50值逐渐减小,表明抑制α -葡萄糖苷酶的能力逐渐增大,即PD-80>PD-60>PD-40>PD-20。PD-80 的抑制能力最强,IC50为0.56 mg/mL(表3),多糖质量浓度为1 mg/mL 时,抑制率达到70.05%。可能是由于经过分级醇沉,小分子物质、色素等杂质被脱除,对其功能基团影响变小,导致抑制α - 葡萄糖苷酶能力增强[19-20]。
不同组分多糖对自由基和糖苷酶的半抑制质量浓度(IC50) 见表3。
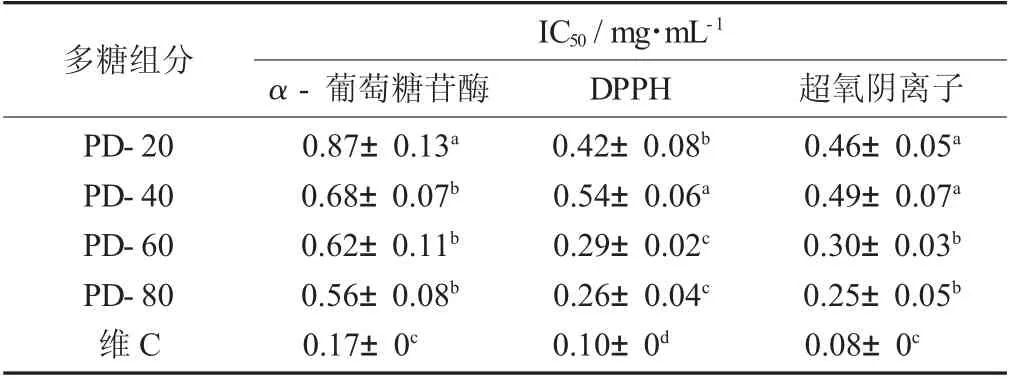
表3 不同组分多糖对自由基和糖苷酶的半抑制质量浓度(IC50)
2.6 蒲公英多糖抗氧化活性研究
2.6.1 DPPH 自由基清除能力
不同多糖组分对自由基的清除能力见图5。
由图5(a) 可知,4 个蒲公英多糖组分对DPPH的清除能力均随质量浓度的增加而增强;IC50值越小,表明其抗氧化活性越好。其中,PD-80 的清除活性表现良好,IC50为0.26 mg/mL,清除DPPH 能力优于其他3 个组分,多糖质量浓度为0.5 mg/mL 时清除率达到84.32%。其次为PD-60,IC50为0.29 mg/mL,与PD-80 无显著差异。PD-20 和PD-40 清除DPPH活性相对较弱,PD-20 组分IC50为0.42 mg/mL,清除DPPH 能力显著高于PD-40 组分0.54 mg/mL(p<0.05)。
2.6.2 超氧阴离子清除能力
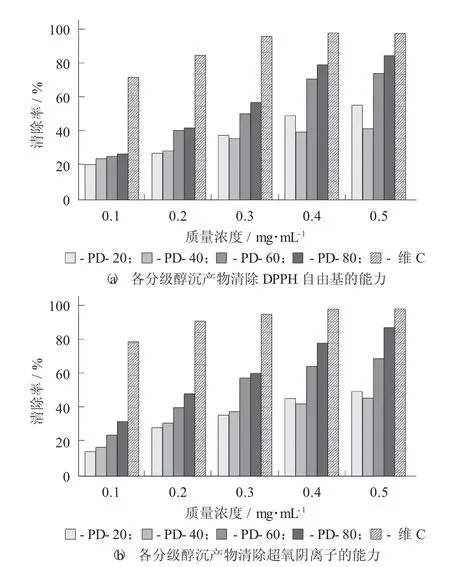
图5 不同多糖组分对自由基的清除能力
由图5(b) 可知,4 个多糖组分对超氧阴离子清除活性均随多糖质量浓度的增加而逐渐增强,PD-80 与PD-60 的半抑制质量浓度(IC50) 分别为0.25,0.30 mg/mL,抗氧化活性显著高于其他2 种多糖(p<0.05)。当多糖质量浓度达到0.5 mg/mL 时,PD-80 对超氧阴离子的清除率达到86.47%左右;当多糖的质量浓度超过0.3 mg/mL 时,PD-20 对超氧阴离子的清除率渐渐高于PD-40;但都显著低于维C(p<0.05)。
3 结论
试验采用超声辅助提取和分级醇沉法获得蒲公英粗多糖。设置20%,40%,60%和80%共4 个梯度,乙醇分级沉淀得到4 种蒲公英粗多糖,PD-80总糖含量最高,达到64.41%。各样品均含有一定量的蛋白质,PD-20 蛋白质含量最高,其余3 组样品蛋白质含量PD-60>PD-80>PD-40,可能为结合态的蛋白质。
研究不同组分的光谱学性质,发现4 个组分结构无明显变化,多糖结构未受到破坏。4 个组分均含有阿拉伯糖、鼠李糖、甘露糖、葡萄糖和半乳糖5 种单糖,且葡萄糖含量最高,但单糖组成比例存在差异。4 个组分体外降血糖和抗氧化活性随着质量浓度的升高而逐渐增强,呈量- 效关系。此外,随着乙醇体积分数的增加,抑制α - 葡萄糖苷酶和清除自由基的能力也逐渐增强。表明该方法可以快捷高效地得到不同组分蒲公英多糖,筛选出活性较高的组分,为蒲公英多糖的深入研究和开发利用提供一定的理论依据。
