3.0T MR扩散加权成像及动态增强诊断直肠癌神经脉管侵犯的价值
2021-05-21谢玉海钱银锋刘星崔玲曹莉范影石梦娟
谢玉海, 钱银锋, 刘星, 崔玲, 曹莉, 范影, 石梦娟
在我国,直肠癌发病率及致死率均逐年上升,已成为我国发病率和死亡率最高的肿瘤之一[1]。目前直肠癌根治性手术切除仍是最主要的治疗手段。相关研究表明,直肠癌患者是否存在神经脉管侵犯是影响直肠癌根治性切除术后无复发生存时间的独立危险因素[2]。MRI作为一种重要的影像学检查方法,尤其是高分辨力T2WI,具有较高的软组织分辨力[3],能清晰显示肠壁各层结构,已广泛应用于直肠癌术前评估。高分辨力MRI对直肠癌管径较大的受侵脉管的诊断具有一定临床价值[4],但对于显微镜下小的脉管神经受侵则无法诊断[5]。本研究旨在探讨3.0T MR扩散加权成像(diffusion weighted imaging,DWI)及动态增强MRI(dynamic contrast enhanced MRI,DCE-MRI)半定量参数对诊断直肠癌神经脉管侵犯的价值。
材料与方法
1.病例资料
回顾性搜集我院2017年4月-2020年6月间经直肠癌根治性切除术后病理证实的39例患者的病例资料,以术后病理为金标准,将直肠癌壁内脉管和/或神经受侵设为实验组,无脉管和/或神经受侵设为对照组。所有患者术前均行MR常规序列、DWI及动态增强扫描。39例患者中男20例,女19例,年龄42~80岁,平均(62.92±10.51)岁。患者主要临床症状包括大便习惯改变、血便等。病例纳入标准:①MRI检查前及手术前均未采取任何治疗措施;②术前均行MRI平扫、DWI及DCE-MRI检查;③所有患者均行直肠癌根治性切除术且术后有完整病理资料;④患者均签署MRI检查知情同意书。病例排除标准:①术前有其他肿瘤而行放化疗者;②图像伪影显著影响数据测量结果者;③有磁共振检查禁忌症者;④钆对比剂过敏者。
2.检查方法
MRI检查采用联影3.0T uMR770扫描仪,体部12通道相控阵线圈。EIP-DWI序列扫描参数:TR 5250 ms,TE 79.5 ms,视野280 mm×280 mm,矩阵128×128,层厚4 mm,层间距0.4 mm,带宽1800 Hz/pixel,翻转角90°,体素2.19 mm×2.19 mm×4.00 mm,平均采集次数8,b值取0、1000 s/mm2,扫描时间为279 s。动态增强扫描采用t1_quick3d_tra_fs序列,扫描参数:TR 4.22 ms,TE 1.87 ms,视野240 mm×240 mm,矩阵192×134,层厚4 mm,带宽450 Hz/pixel,翻转角10°,体素1.79 mm×1.25 mm×4.00 mm,无间隔动态重复扫描20期,于第4期结束后立即经肘静脉以3.0 mL/s流率团注对比剂钆特酸葡胺15 mL,注射结束后以相同流率注射生理盐水20 mL,扫描时间为180 s。
3.DWI、DCE-MRI数据采集
MR-DWI及DCE-MRI数据的采集均在UWS-MR后处理工作站上完成,由两位经验丰富的高年资医师在不知病理结果的情况下进行测量,结果取两位医师所测的平均值。感兴趣区(region of interest,ROI)尽量选择信号强度比较均匀,无出血、囊变、液化坏死,无可见血管穿行及正常组织区,面积0.1~0.5 cm2。由软件自动计算生成表观扩散系数(apparent diffusion coefficient,ADC)、指数化表观扩散系数(exponential apparent diffusion coefficient,eADC)、达峰时间(time to peak,TTP)、信号增强比(signal enhancement ratio,SER)、平均强化时间(mean time to enhance,MTE)、正性增强积分(positive enhanced intensity,PEI)、最大增强线性斜率(maximum slope of increase,MSI)。DWI及DCE-MRI 的ROI位置和大小尽量保持一致,测量3次取其平均值。
4.统计学分析
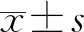
结 果
1.病理结果及两组间MRI检查与直肠癌根治性切除术间隔时间比较
术后病理诊断为直肠癌伴脉管和/或神经受侵(实验组)15例,其中高分化2例,中分化9例,低分化4例,伴有肠系膜癌结节3例;直肠癌不伴脉管和/或神经受侵(对照组)24例,其中高分化4例,中分化17例,低分化3例,伴有肠系膜癌结节1例。实验组的MRI检查与直肠癌根治性切除术间隔时间为(4.5±2.2)天,对照组为(4.9±3.8)天,两组间差异无统计学意义(P>0.05)。
2.两组间瘤体ADC值、eADC值、DCE-MRI半定量参数比较
两组的瘤体ADC值及eADC值均符合正态分布,实验组的瘤体ADC值低于对照组,eADC值高于对照组(图1、2),差异均有统计学意义(P<0.05)。DCE-MRI半定量参数中PEI和SER值符合正态分布,实验组的PEI值高于对照组(图1c、2c),差异有统计学意义(P<0.05),但SER值在两组间差异无统计学意义(P>0.05,表1)。
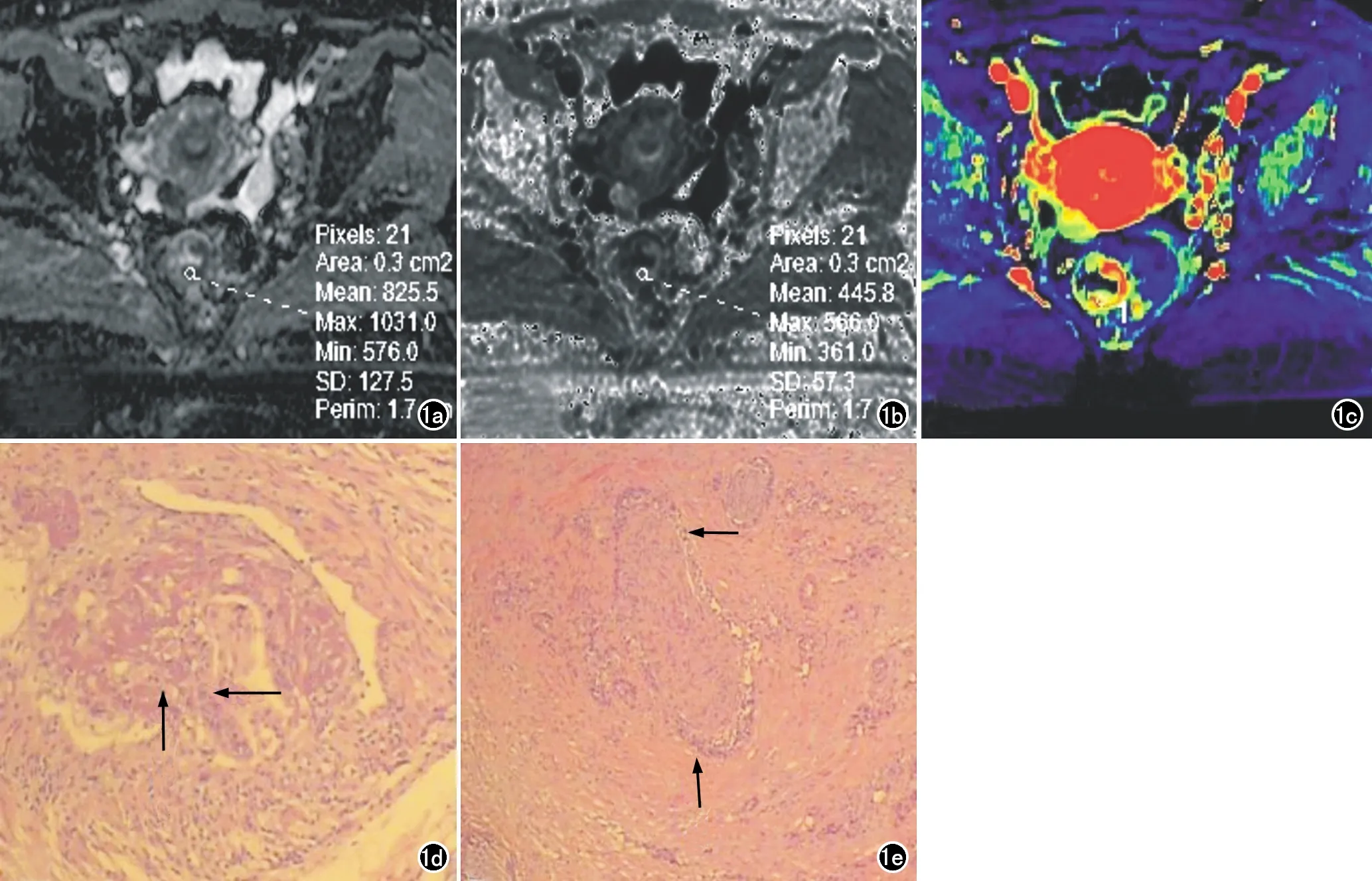
图1 女,52岁,低分化直肠腺癌侵犯脉管神经。a)瘤体在ADC图呈低信号,感兴趣区瘤体ADC值为0.826×10-3mm2/s; b) 瘤体在eADC图呈高信号,感兴趣区瘤体eADC值为0.446mm2/s; c) 瘤体在PEI图呈红色,感兴趣区瘤体PEI值为1691.90; d) 镜下示脉管受侵犯(箭)(×100,HE); e) 镜下示神经受侵犯(箭)(×100,HE)。
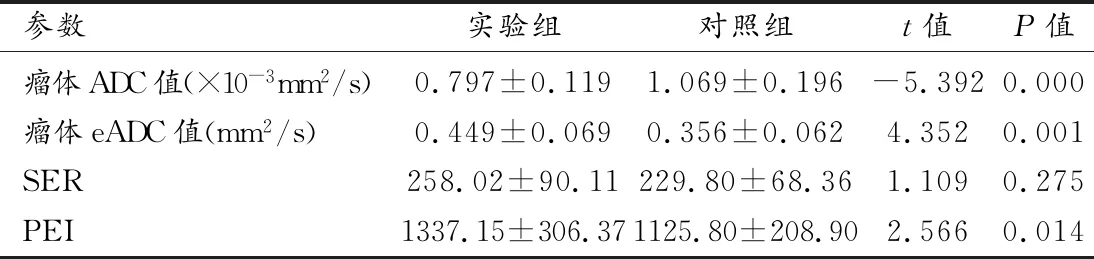
表1 两组间瘤体各参数比较
DCE-MRI半定量参数中TTP、MTE、MSI值不符合正态分布。实验组与对照组的TTP、MTE、MSI值中位数(Q1,Q3)分别为108.67(85.45,142.30)和110.17(83.17,122.20)、102.00(99.67,105.53)和99.27(94.14,104.65)、799.20(741.75,833.60)和714.67(595.44,876.72),两组间差异均无统计学意义(Z=-0.433、P=0.665;Z=-1.328、P=0.184;Z=-1.433、P=0.149)。
3.两组间瘤体ADC值、eADC值、PEI参数的ROC曲线分析比较
ROC曲线分析结果显示虽然瘤体ADC值、eADC值及PEI值的AUC逐渐减低(图3、表2),但瘤体ADC值与eADC值、瘤体ADC值与PEI值、瘤体eADC值与PEI值间AUC比较的Z值分别为0.944、1.550、1.017,差异均无统计学意义(P=0.345、0.121、0.309)。
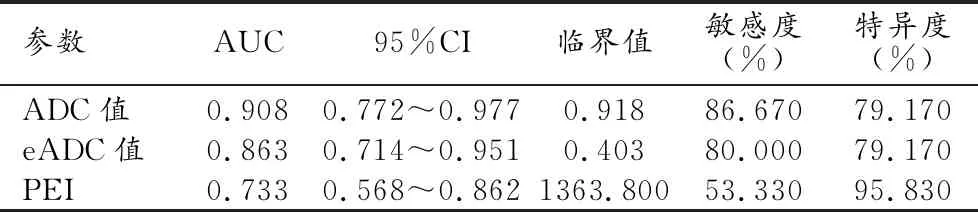
表2 两组间瘤体各参数的ROC曲线分析结果
讨 论
DWI是目前唯一能在活体组织内监测水分子扩散运动的技术,它通过间接反映组织微观结构的变化来对疾病进行诊断[6,7]。ADC、eADC作为DWI序列的两个定量指标,可以量化病变组织的信号特点。在DWI序列中,b值的选择尤为重要[8],直肠癌DWI检查中最佳b值组合为0和1000 s/m2,因此本研究采用b=1000 s/mm2来进行数据采集。
神经脉管受侵是影响直肠癌患者预后的重要独立影响因素之一[9],也是影响直肠癌根治性切除术后无复发生存时间的独立危险因素[2]。一项Meta分析结果显示Ⅱ期结直肠癌合并神经侵犯的患者预后与Ⅲ期类似[10]。有研究表明脉管受侵的患者术后生存率明显低于未受侵者[11,12],且在脉管受侵者中,术后行新辅助治疗组的3年无病生存率显著高于未行新辅助治疗组,差异有统计学意义[13]。因此,术前评价直肠癌患者脉管神经是否受侵对临床治疗方案的选择具有一定的指导价值。而目前运用DWI术前评估直肠癌患者神经脉管是否受侵的研究不多,且结论尚不一致。本研究结果表明,神经脉管受侵组的瘤体ADC值低于无神经脉管受侵组,差异有统计学意义;神经脉管受侵组的eADC值高于无神经脉管受侵组,差异亦有统计学意义,这与王玉娟等[4]和吕茜婷等[14]的研究结果相符,但与唐翠等[15]的研究结果不相符。笔者认为造成研究结果不一致的可能原因如下:①不同分化肿瘤的占比不同。本研究15例神经脉管受侵组中高分化2例,中分化9例,低分化4例,高、中、低分化分别占比13.33%、60.00%、26.67%;24例无神经脉管受侵组中高分化4例,中分化17例,低分化3例,高、中、低分化分别占比16.67%、70.83%、12.50%。多项研究结果也表明,直肠癌瘤体ADC值和eADC值与其分化程度密切相关,且分化越差,瘤体ADC值越低、eADC值越高[16-18]。而肿瘤的分化越低,侵袭性越强[19-20],越易引起神经脉管侵犯。②分组。本研究是将脉管受侵和/或神经受侵统一归为实验组,而唐翠等[15]的研究是将脉管受侵与不受侵、神经受侵与不受侵分开研究。③还可能与ROI的选择、磁共振场强及成像参数有关。
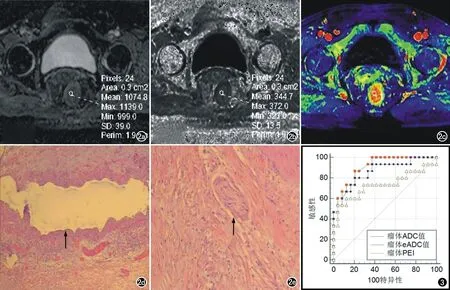
图2 女,68岁,中分化直肠腺癌未累及脉管神经。a) 瘤体在ADC图呈稍低信号,感兴趣区瘤体ADC值为1.075×10-3mm2/s; b) 瘤体在eADC图呈稍高信号,感兴趣区瘤体eADC值为0.345mm2/s; c) 瘤体在PEI图呈红色,感兴趣区瘤体PEI值为1273.50; d) 镜下显示脉管未受侵犯(×100,HE); e) 镜下显示神经未受侵犯(×100,HE)。 图3 两组间瘤体ADC值、eADC值、PEI参数的ROC曲线。
DCE-MRI作为一种功能成像,它不仅可以提供肿瘤组织的形态学信息,还可以反映肿瘤组织的微循环状态[21]。目前,运用DCE-MRI技术多是研究直肠癌的病理分化[22,23]、临床TN分期[24]、区域淋巴结良恶性的判断[25,26]以及新辅助放化疗的疗效评价[27-29],而对直肠癌神经脉管受侵的研究较少。本文通过分析DCE-MRI半定量参数,结果显示TTP、SER、MTE、MSI在两组间差异无统计学意义,对直肠癌神经脉管是否受侵无判断价值,而PEI在两组间差异有统计学意义。PEI为动态增强各时相内TIC曲线下面积的积分总和,它反映了肿瘤组织微循环的相对血容量。相关研究结果表明,肿瘤组织微循环血容量的高低与其侵袭性呈正相关,血容量越高,其侵袭性越强[30,31]。
以术后病理为金标准,采用ROC曲线对各参数的诊断效能进行分析,结果显示瘤体ADC值、eADC值和PEI的AUC分别为0.908、0.863和0.733,取瘤体ADC值为0.918×10-3mm2/s、eADC值为0.403mm2/s、PEI为1363.80为临界值时,诊断神经脉管是否受侵的敏感度和特异度分别为86.67%和79.17%、80.0%和79.17%、53.33%和95.83%,两两参数间AUC的比较差异均无统计学意义。因此,直肠癌瘤体ADC值、eADC值及动态增强PEI参数对术前诊断神经脉管是否受侵均具有较高的诊断效能。
本研究存在以下局限性:①样本量较少,有待于进一步的大样本研究;②未将脉管受侵与不受侵、血管受侵与不受侵分开进行统计分析;③ROI的选择可能存在一定的人为误差。
综上所述,DWI的ADC值和eADC值以及DCE-MEI半定量参数中的PEI对术前评估神经脉管是否受侵均具有较高的诊断效能,可为临床诊疗提供一定参考信息。