微流控肠道芯片研究进展
2021-05-20李英洁车炼强
李英洁 张 琛 王 蕾 车炼强*
(1.四川农业大学动物营养研究所,成都 2611130;2.中国科学院过程工程研究所,生化工程国家重点实验室,北京 2100089;3.山东省食品药品检验研究院,济南 2250101)
动物试验为营养与医学研究做出了巨大贡献。适宜的动物试验模型(如坏死性肠炎仔猪模型、肥胖和糖尿病小鼠模型等)已被广泛用于研究疾病发生机制及药物或营养干预效果评估[1-2],然而,体内试验受外部环境、个体差异、个体内多器官复杂相互作用影响,只能在一定程度上反映试验因素下动物的整体情况,不能反映试验因素对特定器官的作用[3]。20世纪60年代,Russell等[4]提出针对动物试验的“3Rs”原理,即“Replacement、Reduction、Refinement”:采用非生命体替代试验动物、减少动物数量至最低限度、不断改进动物试验以提高动物福利,基于此涌现出了大量体外试验模型,如组织培养、细胞培养及微流控技术等。
微流控芯片又称芯片实验室,是一种在微米尺度空间对流体进行操控的试验技术,能将生物、化学等实验室基本功能微缩到几平方厘米的芯片上[5];微流控技术具有高通量性、简易性、快速性等优势,使其成为体外试验中最具发展潜力的技术。本文将基于微流控芯片平台,综述微流控肠道芯片技术的研究历史与应用进展。
1 微流控芯片的研究历史
1990年,瑞士科学家Manz等[6]提出“小型化学平板芯片分析系统”概念,并命名为“微全分析系统(micro total analysis system,μTAS)”,微流控芯片即微全分析系统中的主要分支技术;1993年,Harrison等[7]采用微机械加工技术,研制出微流控芯片化学分析系统,此次改进为微流控芯片技术的长远发展奠定了基础;1994年,Verpoorte等[8]证实微流控芯片能够实现微全分析,并利用光刻胶技术对芯片构造进行了改善。1995年,Woolley等[9]在微流控芯片上成功实现了准确率高达97%的DNA测序,昭示了利用微流控芯片进行高速、高通量DNA测序的可行性;同年,集DNA分离、测序、PCR、受体结合、酶联免疫分析于一体的微流控芯片研究成功,标志着微流控技术可促进研究快速即时、检验自动化与集成化[10]。
我国微流控芯片研究始于1996年[11]。2003年,周小棉等[12]利用微流控芯片平台完成SARS病毒基因反转录多重PCR检测;龚海洋等[13]、洪承吕等[14]利用生物芯片技术进行营养代谢机理研究,分析营养与肿瘤相关基因、心脑血管疾病关系等;侯威[15]、侯宇等[16]分别基于仿生肺芯片技术阐明癌症机理;汪萌等[17]则构建起以微流控为基础的输卵管芯片,辅助研究受精和早期胚胎发育过程。
2 微流控肠道芯片
与其他试验模型相比,细胞模型在预测吸收、分泌和免疫功能等方面更为准确,可为动物研究提供基础数据[18]。迄今为止,多种细胞已在芯片上成功建模,如人结肠癌细胞、人脐静脉内皮细胞、肝细胞和牛内皮细胞等。肠道体外模型的构建对深入探究营养吸收、肠道细胞与微生物间互作以及药物代谢机制至关重要,与机体免疫和营养代谢密切相关的微流控肠道芯片,已成为当前研究热点和前沿。不同微流控肠道芯片的功能及优缺点见表1。
2.1 微流控肠道芯片结构
微流控肠道芯片利用仅几立方厘米的体积即可实现细胞培养、试剂添加以及酸碱度、温度等物化条件调节[23]。微流控肠道芯片主体由细胞操作部件和流体控制部件组成[5],细胞操作部件包括试剂进样、细胞培养单元;流体控制部件以多孔道蠕动泵为主,用于控制试剂在细胞培养部件间的流动。芯片结构如图1所示。

PDMS:聚二甲基硅氧烷 polydimethylsiloxane;PC:聚碳酸酯 polycarbonate。
芯片上下框架由2张聚碳酸酯(polycarbonate,PC)板组成,通过4个螺丝固定,既有效保证装置气密性,又方便拆卸。根据肠道组织的生理特征,细胞培养单元通常由2张平行对齐的聚二甲基硅氧烷(polydimethylsiloxane,PDMS)膜组成[24]。PDMS膜呈直径为30 mm的圆柱体,柱高分别与肠上皮细胞、血管内皮细胞的平均直径相同。通过软光刻技术构建起薄膜柱体中宽0.8 mm、高0.2 mm、长18 mm的微通道[25]以及连接外界进、出样孔和微通道的孔洞(直径为1 mm)(图1-a)。此外,每个PDMS膜中心都有直径为5 mm的圆柱状孔洞,当2张PDMS膜垂直重叠时,即可形成1个圆柱形密闭空间,此空间经径迹蚀孔膜隔离,一分为二,形成单独的上、下2层细胞小室。径迹蚀孔膜的正反面都覆有细胞外基质以支持细胞生长,膜上每隔10 μm即有1个1 μm的孔隙,为肠上皮细胞-血管内皮细胞间的物质交换提供可能,形成肠道-组织界面(图1-b)。
微流控肠道芯片通常在外部泵体的支持下实现流体循环,即利用蠕动泵或注射泵将适于细胞生长的培养基以适宜流速从外界导入或导出细胞培养单元,以此模拟体液的持续流动,与此同时还对培养细胞施加了与机体肠腔一致的剪切力[26](图1-c);培养基的持续导入为细胞提供营养并清除其代谢废物,同时也以培养基为载体精确控制营养素、生长因子、药物甚至毒素添加,使量化屏障功能、药物或营养素的吸收成为可能。除此之外,当外界泵体向真空的微通道中以不同速率导入气体时,会对径迹蚀孔膜施加大小不一的压强,导致附着在膜上的细胞层因受机械力作用发生变形[27],从而潜在控制径迹蚀孔膜波动,模拟肠道蠕动现象。
2.2 微流控肠道芯片材料
细胞操作单元的材质能直接影响细胞生长情况。硅(silicon,Si)和二氧化硅(silicon dioxide,SiO2)是制作微流控芯片最常见的原料,而随着微流控技术的发展,性能更优、成本更低、加工更易的高聚化合物材料如聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)、聚碳酸酯、环烯烃共聚物(copolymers of cycloolefin,COC)及PDMS逐渐成为它们的替代物。微流控芯片材料及其性能如表2所示。
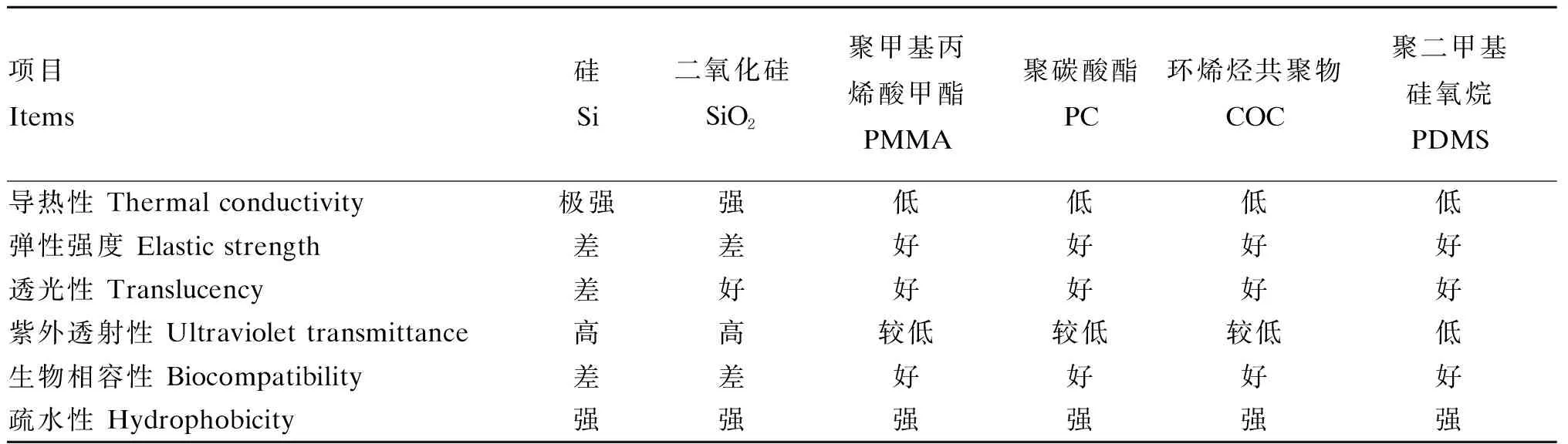
表2 微流控芯片材料及其性能
PDMS遵守以下原则:1)无毒性,不影响细胞正常生长;2)光学特性良好,使细胞观察和检测更加直观;3)可塑性强,简化芯片制作过程;4)PDMS材料间具有黏附性,能增强微流控芯片装置的气密性[32-33];5)气体渗透性,为芯片内细胞创造适宜的气体环境[34]。结合表1,PDMS较其他材料更优,且加工简便,成本更低,是微流控芯片制作常用材料。
2.3 微流控肠道芯片的优势
2.3.1 动态仿生
在机体中,细胞总是受相邻细胞、细胞外基质、细胞因子或机械力作用,但无论是传统细胞培养或Transwell及3D培养技术,均无法充分还原位于体内环境时的细胞形态与功能[35-36]。例如,培养在Transwell小室中的肠上皮细胞呈扁平状,肠绒毛无法分化,肠道分泌功能受到抑制[37],如图2-a所示。随着3D培养技术的改进,水凝胶细胞培养模型逐渐被用于试验研究[38-39],在此培养条件下,细胞虽能形成正常形态,但仍不能发挥正常功能[40]。同时,Bein等[41]报道,在静态体系中,细胞-微生物共培养不能超过1 d;故无论是2D还是3D细胞培养模式都无法模拟肠道微生态,更无法保证预期试验效果。
传统细胞培养模型由于无法充分模拟肠道关键特征,限制了特定生理条件下的肠道功能研究;而微流控肠道芯片由外部泵体介导培养基的循环流动,高度模拟肠道细胞所处的动态体液环境以及所受剪切力。泵体介导的气体压强还深入模拟了肠道蠕动样运动,即在机械力的作用下,芯片中的肠细胞能自发形成绒毛结构;如图2-b所示,使用微流控肠道芯片培养时,肠绒毛上分别排布着吸收细胞、杯状细胞、肠内分泌细胞以及潘氏细胞,这与体内生理环境下观察到的绒毛结构一致[42];在自发形成绒毛结构的条件下,芯片中的肠细胞能进一步分化,发挥黏液分泌功能。

图2 细胞生长状况示意图
2.3.2 生理仿生
传统的细胞培养只局限于1种细胞,而体内环境下,肠道总是与毛细血管发生物质交换,微流控肠道芯片中径迹蚀孔膜的微孔允许细胞间发生物质交换,实现了肠上皮细胞与血管内皮细胞的共培养[43],对研究肠道屏障、吸收以及分泌功能具有重要意义。
动物胃肠道含有的共生菌群称为微生物群,其与免疫调节、屏障功能、组织再生以及疾病发生等密切相关[44]。此外,肠道微生物菌群还会影响药物的吸收与代谢[45]。因此,在肠上皮细胞和微生物群之间建立稳定的共生关系对于研究炎症疾病至关重要,但以往的研究模型通常因为细菌过度生长而未能成功[46]。微流控肠道芯片通道内培养基的流动性为肠道-微生物共培养提供了可能性(图3),在动态培养条件下,细胞-微生物可在与体内环境相似的条件下共培养1周以上[41],为肠道微生物研究提供新途径。

图3 肠道细胞和微生物共培养
微流控芯片在仿生性上还有以下优势:1)芯片形成的密闭空间相对独立,符合机体生理环境;2)芯片用于培养细胞的通道间隙极小,可达到微米级别,与细胞大小相匹配[47];3)芯片导热性良好,细胞能在更佳的温度条件下生长;4)相较常规培养方法,微流控芯片中的细胞黏附性更强[48],更贴近于体内环境。
2.3.3 精准可控和可重复性
微流控肠道芯片以微升级流速向其微米级通道通入营养物质,在保证细胞正常生长的同时,可依托进样孔实时添加药物、营养素或更改酸碱度、温度等单一或综合处理因素,实现试验条件和处理时间的精确可控性,从而提高微流控肠道芯片的可重复性[49]。
2.3.4 试验周期短
由于微流控芯片具有强大的仿生性,故肠道细胞增殖分化迅速。通常,肠上皮细胞在传统培养方式下需要5~7 d才能形成完整细胞单层,而在微流控芯片中只需2 d即能形成[25]。
微流控肠道芯片能为肠道上皮细胞提供动态环境及相应的剪切力,模拟肠道蠕动,促使细胞分化、形成绒毛结构。在此培养条件下,芯片能构建细胞-细胞界面,实现细胞-微生物共培养并维持数天至数周。然而,受制于微流控芯片设计、传感器、微量检测等技术发展限制,微流控肠道芯片还存在仿生性不完善、低含量芯片样本采集和实时检测困难等问题,仍需进一步完善和发展。体外试验模型优缺点对比如表3所示。

表3 体外试验模型优缺点对比
3 微流控肠道芯片应用进展
目前微流控肠道芯片主要应用于新药物开发、肠道病理、功能营养及微生物研究等医学与营养领域[54-56]。医学研究中药物开发难度大,然而动物试验和传统细胞培养技术在药物筛选上效率欠佳,通常开发一种新药物需10~15年时间[57];微流控肠道芯片的发展则为新药物的快速开发提供了新的方案。
微流控肠道芯片已进入生物化学实验室用于构建疾病相关模型。例如,炎症性肠病(inflammatory bowel disease,IBD)主要是由于肠上皮细胞对微生物群系发生异常免疫反应造成[58];Kim等[27]首次在微流控芯片上实现了鼠李糖乳杆菌GG株(LactobacillusrhamnosusGG,LGG)与肠上皮细胞共培养,发现LGG能抑制绒毛钝化和屏障缺失,增强肠上皮细胞完整性和功能发挥,但用Transwell培养方法却导致细胞大量凋亡;此外,益生菌VSL#3、非致病性大肠杆菌和致病性大肠杆菌已成功应用于微流控肠道芯片的长期共培养,对探究IBD发生机理和治疗方法发挥了重要作用[59]。同时,Villenave等[60]向微流控肠道芯片中添加柯萨奇B1病毒(CVB1)感染肠上皮细胞,发现细胞因子、淋巴细胞的变化趋势与以往研究一致,证实肠道芯片是肠道病毒感染机制研究的适宜体外模型。

营养是保证人类和动物健康的前提。瑞士“NutriChip”项目旨在利用微流控肠道芯片,对乳制品在肠道中的消化、吸收、代谢规律进行研究[64]。Ramadan等[65]报道,“NutriChip”微流控装置结合免疫荧光显微镜,可实时监测细胞对促炎症因子(如脂多糖)的反应,筛选出乳制品抗炎性成分。
4 微流控肠道芯片在动物营养研究中的潜在应用价值
目前动物营养研究大多基于动物模型、细胞系或原代分离细胞模型开展研究。以猪为例,猪营养研究依靠动物试验探究营养与生长发育或健康关系,阐述活体生理系统的复杂代谢特征和免疫反应等,这类研究涉及动物饲养试验的高成本付出、操作性及伦理问题,且在体试验的机制探索研究往往较难控制;同时,2018年非洲猪瘟爆发使得动物饲养试验更加难以开展;此外,动物试验、传统单层培养皿或Transwell肠细胞培养均难以可视化展现器官如肠道的代谢及增殖分化过程。过去猪营养调控肠道功能研究中最常用的细胞系是猪小肠上皮细胞(IPEC-J2);Karimi等[66]利用IPEC-J2建立大肠杆菌炎症模型,发现罗伊氏乳杆菌可改善大肠杆菌引起的肠漏;毛湘冰等[67]用异亮氨酸处理IPEC-J2,结果显示提高了细胞中黏液蛋白2(mucin 2)、闭锁小带蛋白-1(zonula occludens-1,ZO-1)和闭合蛋白(occludin)的基因表达量,为饲粮添加异亮氨酸提高断奶仔猪的肠道功能提供研究基础;除此之外,建立肠道干细胞培养模型也可探究多种营养素(如谷氨酸、蛋氨酸和锌等)对肠道功能损伤修复的分子机制[68-70]。然而,以上细胞试验皆采用传统静态模式,在此条件下细胞为单层细胞,仿生性差,无法行使正常生理功能。相反,微流控肠道芯片在高度模拟肠道生理特征即体液流动和蠕动运动的条件下,反映营养素等试验因素对肠道的独立效应[71];微流控肠道芯片的动态仿生性、生理仿生性使其能深度模拟机体细胞形态和功能,实现微生物-肠道共培养,体现两者真实的互作效应;因此,相比传统单层细胞培养,微流控肠道芯片的开发与利用对于动物营养学研究方法的充实显得十分必要。
5 小结与展望
微流控肠道芯片可模拟肠道生理环境,构建肠道-微生物共生界面,为评估药物干预或营养处理效果及探究作用机制提供了新的技术平台,因此,微流控肠道芯片的开发与应用对于丰富动物营养学研究方法显得十分必要。随着微流控肠道芯片技术的发展,构建集肠道、肝脏、肾脏、心脏、脂肪等组织器官于一体的微流控装置——“动物芯片”将成为可能[72];“动物芯片”可能将独立的消化、代谢、排泄、内分泌、循环等系统融为一体,具备与动物机体一致的完整生理体系,使得体外研究模型更加贴近于机体内在环境,从而展现药物或营养素对机体的作用过程。
