磁性铝基MOF的表征和对水体中氟化物吸附性能研究
2021-05-20段平洲贾晓波后希康张新飞
段平洲, 贾晓波, 后希康, 夏 瑞*, 郭 勇, 张新飞
1.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012
2.中国环境科学研究院水生态环境研究所, 北京 100012
3.宿州市环境保护监测站, 安徽 宿州 234000
受自然本底值、地壳运动或人为活动的影响,地表水中都有一定浓度的氟离子存在. 虽然氟离子是人体必需的微量元素,然而一旦超过了特定限值,会导致严重的骨骼问题,损害幼儿肝和肾的正常功能等人体健康风险. 我国将饮用水中氟化物浓度限值设定为1.0 mg/L,低于世界卫生组织(WHO)规定的1.5 mg/L. 我国皖北[1]、宁夏回族自治区[2]、京津冀[3]及苏北[4]等地区,由于土壤中氟浓度较高,或受到长期采矿、挖沙的影响,造成一些地区天然地表水中氟化物浓度背景值高于1.0 mg/L,多处国控和省控断面水质难以达到GB 3838—2002《地表水环境质量标准》Ⅲ类标准,对国家和地方水污染管理和治理造成了较大的挑战,也是当前水环境修复面临的主要难题.
迄今为止,许多相关领域专家和学者针对去除和回收水体中氟化物的技术开展了广泛的研究. 其中,最受关注的除氟方法有混凝沉淀法[5]、电凝聚法[6]、反渗透法[7]、分子筛[8]等. 在这些方法中,吸附技术以其操作简单、效率高、成本低、环境友好等优点被认为是最具竞争力的方法之一. 总结现有研究结果表明,活性炭、活性氧化铝[9]、稀土金属氧化物(Ce2O3和ZrO2等)[10]、羟基磷灰石[11]等材料在除氟工艺中应用较多. 由于氟离子活泼性强,碳材料对其的物理吸附难以达到30%以上. 羟基磷灰石可以通过Ca—OH与F-发生取代反应,但并不适合在自然水体中应用[12]. 含铝吸附剂由于可以和Al3+形成较多的且带正电的Al—OH,被证明可以高效吸附F-. HE等[13]制备了Al修饰的羟基磷灰石(Al-HAP),在200 mg/L的氟离子溶液中实现了93.84 mg/g的吸附量. 近年来,由金属节点(簇)和桥接有机连接体组成的金属有机骨架(MOF)材料,得到了广泛的研究和重视. 它们具有比表面积大、孔隙率高、活性位点丰富等优势[14]. 鉴于这些特性,MOFs已逐步开始应用于氟化物的吸附去除. Al-MOF被证明具有良好的水稳定性,晶体结构类似于MIL-53,具有无限连接的Al—OH—Al,以及方形孔道的Al(OH)(O2C—CH—CO2)结构,这样可以更加充分利用Al—OH与F-进行交换[15-16]. Karmakar等[17]研究表明,0.75 g/L的Al-MOF可以实现30 mg/L的氟化物完全去除.
然而,在大多数情况下,所制备的MOFs基材料很难从水溶液中分离出来,阻碍了其实际应用. 因此,磁性纳米粒子在复合材料中的掺杂引起了人们的极大关注. 磁性氧化铁纳米颗粒具有成本低、制备容易、稳定性高等优点,是一种很好的选择[18]. 该研究针对当前水生态环境修复对于氟化物本底值超标的主要难点问题,制备了磁性的Al-MOF@Fe3O4材料,使用扫描电极(SEM)、X射线衍射仪(XRD)、X射线光电子能谱仪(XPS)和孔隙度分析仪(BET)等对该材料的表面形貌和元素组成进行了表征,分析其对水体中氟化物的吸附能力,并考察了吸附剂投加量、初始浓度和共存阴离子等参数的影响,科学辨析了其吸附动力学和机理,旨在探索提出一种针对高浓度氟化物背景值地区的水生态环境修复材料技术.
1 材料与方法
1.1 试验材料和仪器
试验材料:上海麦克林生化科技有限公司生产的NaF、Al2(SO4)3·18H2O、NaOH和氨水(25%);国药集团试剂有限公司提供的丁二酸、FeCl3·6H2O、FeCl2·4H2O,所有试剂均为分析纯,未经任何纯化处理.
试验仪器:利用热场发射扫描电子显微镜(Jeol,JSM-7610F)对材料的形貌结构进行表征;吸附材料的元素组成是使用日本理学株式会社提供的X射线衍射仪Ultima Ⅳ型号进行测试;同时使用美国赛默飞的EscaLab 250Xi型X射线光电子能谱仪对材料的化学键组成和元素价态进行表征;使用美国麦克ASAP2460系列全自动快速比表面与孔隙度分析仪对材料的介孔结构进行表征.
氟离子浓度的测定:首先取20 mL水溶液快速过0.45 μm滤膜,使用离子色谱法以及美国赛默飞的ICS-2100型离子色谱仪AE-205对水体中存留的氟离子浓度进行测定.
1.2 Al-MOF@Fe3O4的制备与表征
a) Al-MOF的制备. 17.42 g的Al2(SO4)3·18H2O加入到100 mL去离子水中,在60 ℃下搅拌1 h,之后将6.2 g琥珀酸(丁二酸SA)和4.75 g NaOH溶解在100 mL去离子水中,确保丁二酸完全溶解,将混合溶液加入到Al2(SO4)3·18H2O中,搅拌2 h,得到白色固体通过离心(4 000 r/min)分离,使用去离子水洗涤若干次,在100 ℃下烘干备用[19].
b) 水热法制备Al-MOF@Fe3O4. 将0.2 g的Al-MOF加入到80 mL水中,超声30 min,称取1.6 g FeCl3·6H2O和0.6 g FeCl2·4H2O加入其中,搅拌30 min,将20 mL的氨水(25%)在85 ℃下逐滴加入,继续保持加热45 min,使用磁场分离,洗涤,60 ℃烘干备用[16]. Fe3O4的制备方法相同,但体系内不加入Al-MOF材料.
1.3 除氟性能试验
通过吸附平衡法测定Fe3O4、Al-MOF和Al-MOF@Fe3O4的吸附等温线和动力学参数,取0.1 g的上述吸附剂分别加入到250 mL、150 mg/L的NaF溶液中,在303 K下恒温振荡一定时间,然后过滤,测试溶液中氟离子浓度,根据式(1)计算除氟容量DC(mg/g).
(1)
式中:C0为氟离子初始浓度,mg/L;C为吸附后剩余的氟离子浓度,mg/L;V为溶液体积,L;m为吸附剂的质量,g.

图1 Al-MOF、Fe3O4、Al-MOF@Fe3O4的SEM图
2 结果与讨论
2.1 材料表征与分析
使用SEM技术对Fe3O4、Al-MOF和Al-MOF@Fe3O4的形貌和结构进行观察和分析,结果如图1(a)所示. 由图1(a)可以看出,Al-MOF具有明显的颗粒状结构,直径在0.2~0.5 μm之间,呈现出不规则的形状和粗糙的表面,可以提供较大的面积来有效地附着在Fe3O4上,改善磁性粒子的团聚[16]. 图1(b)为制备的Fe3O4扫描电镜图,由图1(b)可见,Fe3O4呈现明显的块状结构,表面较为平整,因此不具备较大的比表面积[20]. Al-MOF@Fe3O4的形貌如图1(c)所示,Al-MOF晶体成功地生长在Fe3O4的表面[15]. 为进一步确定该研究中制备材料的化学组成和化学形态,对其进行了XRD和XPS分析.

图2 Al-MOF、Fe3O4、Al-MOF@Fe3O4的XRD谱图
对合成的材料进行XRD分析,结果如图2所示. 结果表明,Al-MOF的元素峰出现在2θ为11.8°和21.2°处,较好地对应了材料中的Al元素[21],2θ=15.6°处则对应不定型碳[22]. Al-MOF/Fe3O4的衍射峰出现在30.3°、35.7°、43.5°、53.9°、57.6°和63.2°处,分别对应(220)(311)(400)(422)(511)和(440)型Fe3O4的衍射峰(JCPDS No.75e0449),这证明了复合材料中包含了磁性Fe3O4和Al-MOF两种组分[18]. 但Al-MOF的衍射峰并不明显,这可能是由于磁性Fe3O4在Al-MOF表面覆盖了晶体结构所致[16]. 该推论也通过XPS表征证实了Fe的含量远高于Al.

Al-MOF材料的BET比表面积为63.144 m2/g,经过修饰后Al-MOF/Fe3O4的BET比表面积增至 83.595 6 m2/g. 同时,Al-MOF材料的平均吸附孔径为 17.811 0 nm,大于Al-MOF/Fe3O4的 6.276 0 nm,因此可以断定Al-MOF/Fe3O4具有较大的比表面积和介孔结构. 图4(a)显示了Al-MOF/Fe3O4的N2吸附和解吸曲线,表现为典型的具有N2滞后曲线的Ⅳ型等温线,是介孔材料的一个特征[21]. 吸附量在P/P0(相对压力)为0.4~0.5范围内急剧增加,这是由于N2在介孔中的毛细冷凝作用所致[18]. 如图4(b)所示,Al-MOF/Fe3O4的孔径都集中在较小的范围内.
对合成材料的磁性测试结果如图5所示,Fe3O4和Al-MOF/Fe3O4的饱和磁化强度分别为54.4和22.3 emu/g,虽然在使用Al-MOF进行修饰后,磁性强度有所降低,但依然可以很容易的将材料分离和回收.

图3 Al-MOF@Fe3O4的XPS谱图
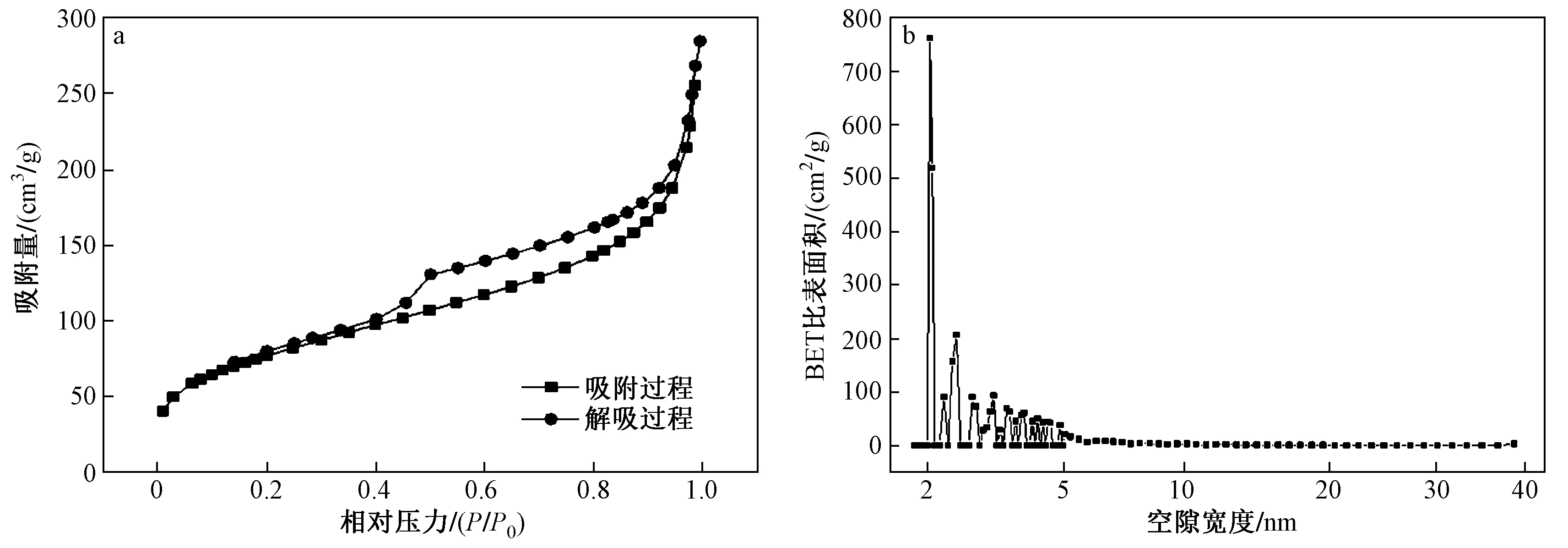
图4 Al-MOF@Fe3O4的BET表征结果

注:磁场强度单位为奥斯特,1 A/m=4π×10-3奥斯特.
2.2 吸附影响因素
2.2.1不同材料的吸附性能
为了评估Al-MOF/Fe3O4的吸附性能,使用Al-MOF、Fe3O4和Al-MOF/Fe3O4分别作为吸附剂,测试其对氟离子的吸附量. 如图6(a)所示,在150 mg/L的NaF溶液(氟离子初始浓度为67.86 mg/L)中,加入0.8 g/L的不同吸附剂,使用摇床在200 r/min下进行吸附试验,发现Al-MOF/Fe3O4的吸附量达到了75.2 mg/g,明显高于其他两种材料〔Al-MOF(66.12 mg/g)和Fe3O4(24.60 mg/g)〕. 这表明Al-MOF/Fe3O4结合了Al-MOF和磁性粒子的优势,表现出协同增强效应. 可能原因是,Al-MOF/Fe3O4所具有的介孔结构、较大的比表面积和多种官能团,促进了Al-MOF/Fe3O4与氟离子间的相互作用.
采用拟一阶动力学模型〔见式(2)〕和拟二阶动力学模型〔见式(3)〕对吸附数据进行模拟,分析氟离子在Al-MOF/Fe3O4上的吸附机理.
ln(qe-qt)=lnqe-k1t
(2)
(3)
式中:qe和qt分别为吸附平衡和t时刻对底物(F-)的吸附量,mg/g;t为反应时间min;k1和k2分别为拟一阶动力学模型和拟二阶动力学模型的速率常数,单位分别为min-1、g/mg.
Al-MOF/Fe3O4对氟离子吸附的拟一阶和拟二阶动力学模型分别如图6(b)和图6(c)所示. 由图6可见,氟离子在Al-MOF/Fe3O4的拟二阶动力学模型的相关系数(R2)明显高于拟一阶动力学模型,另外使用拟二阶动力学模型计算出的qe为78.37 mg/g,更接近试验得到的数据. 这表明氟离子在Al-MOF/Fe3O4的吸附过程更符合拟二阶动力学模型,且化学键取代过程可能是限制该吸附过程的主要机理.

注: 吸附试验条件为氟离子初始浓度67.86 mg/L、温度303 K、搅拌速率200 r/min、pH 7、吸附剂投加量 0.8 g/L.

图7 吸附剂投加量对吸附量和除氟率的影响
2.2.2吸附剂投加量的影响
在初始条件为氟离子初始浓度67.86 mg/L、搅拌速率200 r/min、温度303 K下进行吸附试验,且吸附剂投加量对除氟率的影响如图7所示. 由图7可以看出,随着吸附剂投加量的增加,单位吸附量明显降低,除氟率明显提升. 这表明随着吸附剂用量的增加,提供的表面活性位点数量也随之增加,因此除氟率也显著提高. 低吸附剂用量下氟离子可以充分占据有效活性位点,因此单位吸附量较高,但总体的氟离子去除率较低. 吸附剂投加量分别为0.4、0.8和1.2 g/L时,除氟率分别达73.25%、90.05%和97.17%,可见0.8 g/L的投加量可以达到较高的除氟率,进一步提高Al-MOF/Fe3O4的用量,反而会降低材料的使用效率,因此将0.8 g/L作为最佳吸附剂用量.
2.2.3氟离子初始浓度的影响
图8显示了氟离子初始浓度对Al-MOF/Fe3O4吸附性能的影响. 由图8可见,随着氟离子初始浓度从22.62 mg/L增至135.71 mg/L,氟离子在Al-MOF/Fe3O4上的吸附量越来越大,但是出水浓度也越来越高. 当氟离子初始浓度为135.71 mg/L时,Al-MOF/Fe3O4对氟离子的最大吸附量为131.27 mg/g,这说明溶液中氟离子初始浓度较高时,氟离子的传质速率较快,同时有较多的氟离子可以充分占据吸附剂的活性位点. 随着氟离子初始浓度的增加,去除率明显降低. 在固定量的Al-MOF/Fe3O4条件下,有限的吸附位点不足以吸附大量氟离子,从而获得较低的去除率,氟离子的出水浓度也从1.13mg/L升至30.69 mg/L.

图8 氟离子初始浓度对吸附量和除氟率的影响
2.2.4初始溶液pH的影响
初始溶液pH对Al-MOF/Fe3O4吸附剂除氟的影响较小(见图9),说明Al-MOF/Fe3O4吸附剂在较宽的pH范围内具有良好的除氟性能,且酸性条件更有利于Al-MOF/Fe3O4吸附剂除氟. 在酸性和中性 (pH为3~7)条件下,吸附量在75 mg/g以上,当溶液pH达到9时,吸附量逐渐降至70 mg/g以下. 酸性条件下对氟离子的吸附能力较高,可能是由于氢离子消耗水中的羟基离子,促进了F-和Al—OH基团的交换;在碱性条件下氟离子与羟基离子竞争的作用较强,因此影响了吸附过程.

图9 pH对吸附量的影响
2.2.5共存阴离子的影响

图10 共存阴离子对吸附量的影响
图10为Al-MOF/Fe3O4吸附剂在不同阴离子(Cl-、CO32-、SO42-、PO43-)存在下对氟化物去除效果的影响. 由图10可以看到,即使受到Cl-的影响,Al-MOF/Fe3O4对氟离子的吸附量依然在70 mg/g以上;加入PO43-后吸附量降至58.3 mg/g;CO32-和SO42-对氟离子吸附量的影响最大,分别降至32.8和42.6 mg/g[26]. 氟离子去除率的降低很可能是由于其他阴离子对活性吸附位点的竞争,阴离子的电荷半径比(z/r)与其对吸附剂的亲和力密切相关[10],这4种阴离子的z/r大小排列依次为CO32-(2/1.64)>SO42-(2/2.44)>PO43-(3/1.67)>Cl-(1/1.81).z/r值越高,表明阴离子与吸附剂的相互作用越强.
为了探究CO32-对除氟效果的影响机理,加入了200 mg/L的HCO3-,发现氟离子的吸附量大幅降低(34.9 mg/g),与CO32-接近[27]. 而CO32-的pH在9~10之间,HCO3-在7.6左右,因此可以推断出共存离子的z/r是影响氟离子吸附量的主要因素[28].
2.3 吸附机理研究
为了进一步研究Al-MOF/Fe3O4材料对氟离子的吸附机理,对吸附后的材料进行XPS分析,如图11(a)所示,可以观察到在686.2 eV处对应着F1s的特征峰,说明氟离子被成果吸附到了材料表面[29]. XPS测得的Al、Fe、F原子比例分别为3.27%、3.19%和2.71%. 由图11(b)中的Al2p图谱可以看出,特征峰的位置从73.7 eV处移至74.5 eV处,证明其在吸附前主要以Al—OH的形势存在,而吸附后则主要以Al—F存在[30].
使用10%的NaOH对吸附后的Al-MOF/Fe3O4材料进行洗涤,然后烘干,即可对该材料实现重复利用. 如图12所示,对Al-MOF/Fe3O4和Al-MOF进行了5次循环利用试验,结果显示虽然吸附量有一定程度的降低,但一直可以保持较高的吸附量[31],第5次吸附量依然分别可以达到71.4和53.8 mg/g. 该循环利用试验也证明,Al-MOF对氟化物的吸附是通过在Al原子上取代Al—OH形成Al—F的稳定结构,通过碱液洗涤可以将氟离子脱附,恢复Al—OH的化学结构[32].

图11 吸附后Al-MOF/Fe3O4的XPS图谱
2.4 实际水体的除氟性能

图12 循环利用吸附试验结果
为进一步研究该吸附材料对地表水中氟化物的去除性能,选取安徽省SZ市某主要河段的地表水进行吸附试验. 除氟化物指标外,该地区的其余水质指标均符合GB 3838—2002《地表水环境质量标准》Ⅲ类水质标准,各项物化指标如表1所示. 氟化物初始浓度为1.17 mg/L,加入0.8 g/L的Al-MOF/Fe3O4,同时在实验室中用NaF和纯水配置了1.21 mg/L氟离子溶液,进行对比除氟试验,二者的除氟效果如图13所示,该吸附剂可以在15 min内将氟化物浓度降至0.4 mg/L以下,60 min接触时间可以将氟化物指标降至0.2 mg/L以下. 在纯水体系中可以得到更高的除氟率,说明原水浊度、有机物、无机离子等均可能会对吸附效果产生影响. 但总体而言该吸附材料在性能上完全可以满足地表水除氟的需要.

表1 安徽省SZ市某主要河段的地表水理化性质
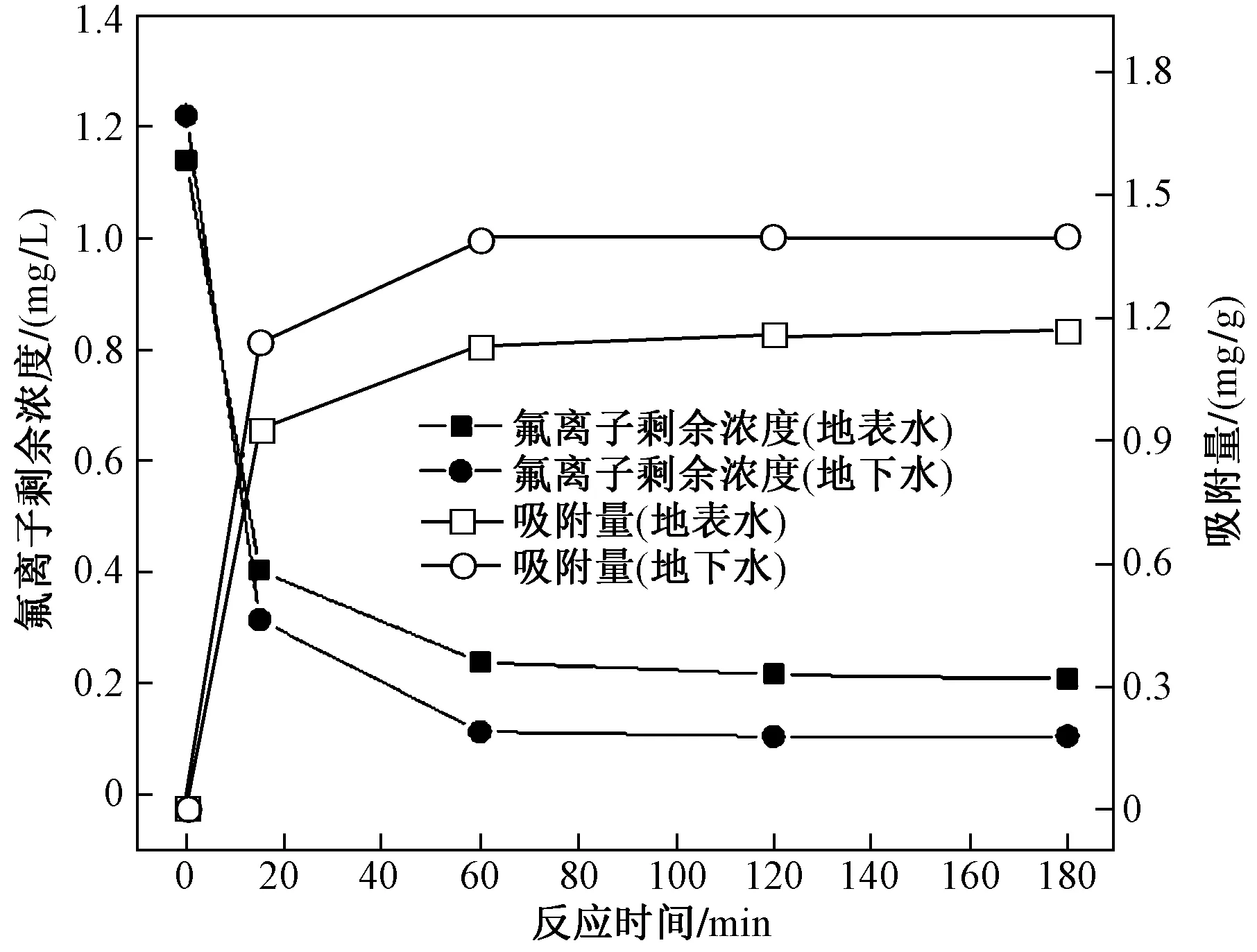
图13 Al-MOF/Fe3O4在实际地表水和纯水中的除氟性能
3 结论
a) Al-MOF@Fe3O4具有不规则的形状、粗糙的表面,其介孔直径为 6.276 0 nm,比表面积为 83.595 6 m2/g,改性前后吸附材料对氟离子的吸附能力表现为Al-MOF@Fe3O4(75.16 mg/g)>Al-MOF(66.12 mg/g)>Fe3O4(24.60 mg/g).
b) Al-MOF@Fe3O4的吸附机理主要是通过F-取代Al—OH的化学过程,其吸附过程也更加符合拟二阶动力学模型,使用NaOH溶液洗涤可以实现Al-MOF@Fe3O4的重复利用,并维持了较高的吸附率.
c) 较高吸附剂投加量和较低的氟离子初始浓度有助于提高除氟率,但却难以得到较高的吸附量. 阴离子对除氟性能的影响程度表现为CO32->HCO3->SO42->PO43->Cl-. 实际地表水中的除氟试验表明,Al-MOF@Fe3O4对氟离子的吸附过程虽然会受到水中其他组分的影响,但依然可以满足地表水除氟的需要.
