常压室温等离子体诱变选育高固氮酶活褐球固氮菌
2021-05-20段赛菲黄艳娜王金斌束仕元周茂超唐雪明
段赛菲, 黄艳娜, 王金斌, 束仕元, 周茂超, 唐雪明*
(1.上海海洋大学食品学院, 上海 201306; 2.上海市农业科学院生物技术研究所, 上海 201106)
中国作为世界上最大的氮肥生产和消费国,农业系统中的氮肥盈余成为环境污染因子[1],目前我国氮肥使用量远远超过作物最高产量需求量,过多的氮肥消耗成为环境污染的主要因素。生物固氮是工业氮肥最有效的替代品之一,可减少氮肥的使用,提高氮肥利用率,建设环境友好型农业[1],同时能够减少温室气体、酸雨及地表水和地下水的硝酸盐污染[2]。
细菌的固氮酶能够将空气中的分子氮(N2)还原成氨(NH3)[3],固氮菌通过固氮酶生物固氮可以提高全球生产力[4]。褐球固氮菌(Azotobacterchroococcum)是一种自生固氮菌,由于其不需要与一定的植物配合,因而具有适应性广的特点,在氮素循环中具有重要作用,是重要的农业菌剂。已有研究证实,褐球固氮菌对春小麦[5]、枸杞[6]、棉花[7]等作物的生长有显著促进作用,还可提高氮肥利用率[6]以及减少氮肥用量,接种褐球固氮菌可以减少50%棉花生长所需氮肥的施用量[7]。因此,褐球固氮菌在农业中具有广泛的应用前景。
常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变育种技术目前在生物育种领域应用广泛,通过育种仪产生均匀的等离子体射流对菌株进行诱变,随着处理时间的增加会导致诱变菌株的碱基与核糖之间、碱基上的氨基以及磷酸二酯中的P-O键发生断裂,将寡核苷酸链断裂成小片段,最终形成多个突变位点而改变菌株的基因序列[8-9]。相对于传统诱变方法,射流中具有化学活性的粒子能够引发种类非常丰富的DNA损伤,最终得到大容量突变库,大容量突变库容易快速获得性能优良且遗传稳定的诱变菌株,且ARTP诱变育种技术操作简便、安全无毒[10]。目前,ARTP已经成功应用于包括细菌、真菌和微藻在内的40多种微生物的诱变育种[10];大肠杆菌AFP111是一种为增加琥珀酸积累而产生的自发突变体,在ARTP诱变后,获得了具有1.33倍高的ATP产生和明显的琥珀酸产生的突变体[11];ε-Poly-L-lysine(ε-PL)是一种具有广泛抗菌活性的新型食品生物保护剂,使用ARTP处理链霉菌(Streptomycesalbulus)孢子后,得到的突变株S.albulusA-29的产ε-PL能力是野生菌株的4倍[12];何建华等[13]首次利用ARTP诱变草菇原生质体,得到了3株抗低温胁迫能力比诱变前提高24 h的突变株。但目前对固氮菌株的诱变,还鲜有报道。为提高现有褐球固氮菌的固氮能力,本研究首先通过ARTP诱变出发菌株褐球固氮菌,用乙炔还原法筛选出一株高酶活突变株28s-20,经5次传代培养确定该菌株的遗传稳定性,并用盆栽试验验证其固氮效能,为提高褐球固氮菌固氮酶活性及固氮效能提供了简便有效的方法。
1 材料与方法
1.1 材料与试剂
1.1.1材料褐球固氮菌CICC21686购自中国工业微生物菌种保藏管理中心;‘申科糯1号’玉米种子由上海市农业科学院庄行基地提供。
1.1.2试剂蔗糖、琼脂粉、胰蛋白胨、酵母提取物、氯化钠、氢氧化钠、甘露醇、KH2PO4、K2HPO4、MgSO4·7H2O、CaSO4·2H2O购自国药集团化学试剂有限公司;Na2MoO4·2H2O、FeCl3、考马斯亮蓝G-250、结晶紫购自生工生物工程(上海)股份有限公司。
1.1.3培养基固氮菌种子培养基:酵母提取物0.5 g,甘露醇20.0 g,KH2PO40.2 g,K2HPO40.8 g,MgSO4·7H2O 0.2 g,CaSO4·2H2O 0.1 g,FeCl3微量,Na2MoO4·2H2O微量,琼脂15.0 g,蒸馏水定容至1.0 L,pH 7.2;固体培养基每升加15.0~20.0 g琼脂。
无氮培养基:蔗糖5.0 g,KH2PO42.0 g,K2HPO42.0 g,MgSO4·7H2O 0.5 g,FeCl30.005 g,CaCO30.1 g,蒸馏水定容至1.0 L,pH 7.0~7.5;固体培养基每升加15.0~20.0 g琼脂。
1.2 仪器与设备
常压室温等离子体诱变仪-ⅡS(无锡源清天木生物科技有限公司)、安捷伦7890B气相色谱仪(安捷伦科技有限公司)、Evolution 60紫外-可见分光光度计(Thermo Fisher)。
1.3 试验方法
1.3.1ARTP诱变菌悬液制备:取1 mL褐球固氮菌种子液至装有100 mL固氮菌液体培养基的250 mL三角瓶中,28 ℃、200 r·min-1培养48 h,取1 mL菌液于无菌EP管中,4 000 r·min-1、4 ℃离心10 min,弃去上清液,余下的菌体用1 mL无菌生理盐水悬浮,稀释至OD600为0.6~0.8。
等离子诱变处理:ARTP功率设定120 W,通氦气载气流速为10 L·min-1,冷却水循环机温度为20 ℃,将上述菌体悬浮液与10%甘油按1∶1比例混合,取10 μL均匀涂布于与诱变仪配套使用的无菌不锈钢载片上,处理时间从0 s开始,每4 s一个递增,至52 s。每个样品处理结束后,不锈钢载片会自动掉落至装有1 mL无菌生理盐水的2 mL无菌EP管内,待样品全部处理完毕后取下EP管,在振荡器上将菌体振荡洗脱。
致死率计算:统计不同处理时间下无氮培养基平板上的菌落数,计算致死率。
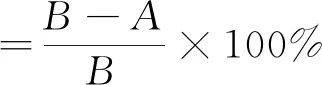
式中,A指ARTP处理后平板上生长出的菌落数,B指样品诱变处理0 s的总菌落数。
1.3.2固氮酶活性测定采用乙炔还原法[13]测定固氮酶活性,固氮菌在斜面培养基培养48 h后更换橡胶塞,向体系注入乙炔气体,使其终浓度为10%,28 ℃继续培养4 h,取1 mL反应气体用气相色谱仪测定,根据乙烯(C2H4)标准工作曲线计算乙烯生成量。菌株固氮酶活性用每毫克菌体每h将乙炔还原为乙烯的量表示,按照以下公式计算。
固氮酶活性=
式中,P为气压(mmHg),t为反应温度(℃)[14]。参考孙建光等[15]的方法用考马斯亮蓝法测定菌体蛋白量,根据牛血清白蛋白标准曲线计算菌体蛋白含量。
牛血清白蛋白标准曲线的绘制:取7只试管,分别加入浓度为0.5 mg·mL-1的牛血清白蛋白溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL,再依次分别加入1.0、0.9、0.8、0.6、0.4、0.2、0 mL蒸馏水,每支试管加入5 mL考马斯亮蓝G-250溶液;振荡摇匀各试管内液体,静置5 min,测定595 nm处吸光值A595,以标准蛋白浓度为横坐标,A595为纵坐标,绘制标准曲线。
1.3.3高固氮酶活菌株筛选①平板初筛。取200 μL经过ARTP诱变、振荡洗脱的菌液,均匀涂布在无氮固体培养基,每个时间梯度3次重复,28 ℃培养48 h,从各试验组中的无氮培养基平板上共挑选出36个生长状态良好、菌落较大的单菌落,对照组的菌株编号为1号,各试验组的菌株按照挑选顺序分别编号为2~37号,接种无氮培养基液体试管,28 ℃、200 r·min-1培养48 h。参照1.3.2测定36个菌株的固氮酶活性,以筛选发生正突变且固氮酶活性大幅提升的菌株。
②复筛。将筛选出的正向突变菌株转接至无氮液体培养基28 ℃、200 r·min-1培养48 h后转接至固氮斜面培养基,28 ℃培养48 h,参照1.3.2测定筛选菌株的固氮酶活性,验证菌株的酶活稳定性。
1.3.4诱变菌株的遗传稳定性分析为验证突变株的遗传稳定性,将复筛后获得的最优突变株28s-20传代培养5代,无氮固体培养基转接至无氮固体培养基为一代,每代均接种装有3 mL无氮培养基液体试管,28 ℃、200 r·min-1培养72 h,参照1.3.2检测每一代菌种的固氮酶活性。
1.3.5最优突变株的生物学特性检测将野生菌和最优突变株的种子液接种到装有100 mL固氮菌液体培养基。
1.3.6诱变固氮菌对植物生长量的影响采用盆栽试验,设置接种无氮培养基(对照)、接种褐球固氮菌CICC21686和突变株28s-20共3个处理,检验诱变固氮菌对玉米生长的影响。三角瓶中的培养基设置不同温度梯度,分别为26、28、30、32和34 ℃,200 r·min-1培养48 h后测定OD600,每个温度梯度3次重复;设置不同初始pH分别为6.0、6.5、7.0、7.5、8.0、8.5,28 ℃、200 r·min-1培养48 h后测定OD600,每个pH梯度3次重复。盆栽土壤取自上海市农业科学院农业试验地,试验前,将土壤用2 mm过筛,121 ℃灭菌1 h,待冷却后重新灭菌,3次重复。盆栽容器为8 cm×16 cm×8 cm(高×盆口直径×盆底直径),每盆装等量干燥土。处理方法:将玉米种子用95%酒精处理5 min,倾去酒精,加入3%NaClO溶液处理2 min,倾去NaClO溶液,无菌水冲洗5次;播种玉米种子5粒,播种深度为1~2 cm,玉米两叶一心期定苗,每盆保留长势一致的幼苗4株;每个处理3盆,设置3组平行试验,共27盆。试验在上海农业科学院组织培养室进行,室内温度28 ℃,光周期16 h光照/8 h黑暗。
将褐球固氮菌CICC21686和突变株28s-20在无氮培养基(CK)培养48 h,稀释至OD600为1.5,试验组菌剂接种量100 mL·盆-1,对照组施等量的无氮培养基,2 d接种一次,共接种7次。待幼苗生长14 d后,收获,将植株烘干至恒重,分析植株干重及全氮量,植株全氮量由南京维百瑞生物科技有限公司测定。
1.4 数据处理与分析
采用Microsoft office 2010进行数据处理,采用Origin 8.5绘图,SPSS 23.0对数据进行差异显著性分析。
2 结果与分析
2.1 不同诱变时间的致死率
褐球固氮菌的致死率曲线如图1所示,随着诱变处理时间的增加,菌体的致死率不断上升。诱变时间为12 s时,致死率达到80%以上;处理时间为20 s时,致死率相对于16 s略有下降,为77.7%,其致死率的下降可能是由于细胞启动损伤修复机制[16];诱变时间为24 s时,致死率又重新上升,可能是由于细胞受到的损伤超出了自身的修复能力,导致损伤无法继续修复,从而使得致死率再次升高[17],诱变时间为36 s及以上时,致死率达到100%。

图1 不同诱变时间的褐球固氮菌菌株致死率曲线
2.2 突变株的筛选
2.2.1初筛菌株的固氮酶活性初筛挑选出36株突变菌株,由这些菌株的酶活性及相对于野生菌的增长率结果(图2)可知,突变具有随机性,且发生正负向突变与诱变时间的长短无关,各诱变组均存在正负向突变。但当诱变时间为28 s时,致死率即达到94.6%,正突变率较高,且酶活力增长率与其他诱变时间组相比增长幅度较大。表明随着诱变致死率的升高,产生高酶活突变株的可能性越大。挑选的36株菌株中,有21株诱变株的固氮酶活高于野生菌,即58.33%的菌株发生了正向突变,其余为负向突变株,其酶活力有不同程度的降低。
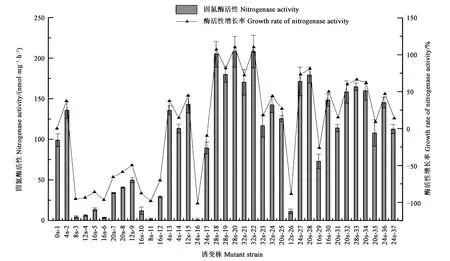
图2 诱变褐球固氮菌菌株的固氮酶活性及酶活增长率
2.2.2复筛菌株的固氮酶活性在21株正向突变株中,有10株突变株的酶活比野生菌高60%以上,为检验其遗传稳定性,选择这10株菌株重新测定酶活进行复筛。复筛结果见图3,可知,编号28s-20突变株的固氮酶活性与初筛时相当,为(207.47±6.73) nmol·mg-1·h-1,高于野生菌101.72%。编号28s-18的菌株酶活增长率在58.94%,相较于初筛时的酶活降低了22.04%,其余菌株的固氮酶活性均有不同程度的下降,均远低于初筛结果,表明这些菌株不具备遗传稳定性。因此,选择28s-20作为最优突变株并继续检验其遗传稳定性。
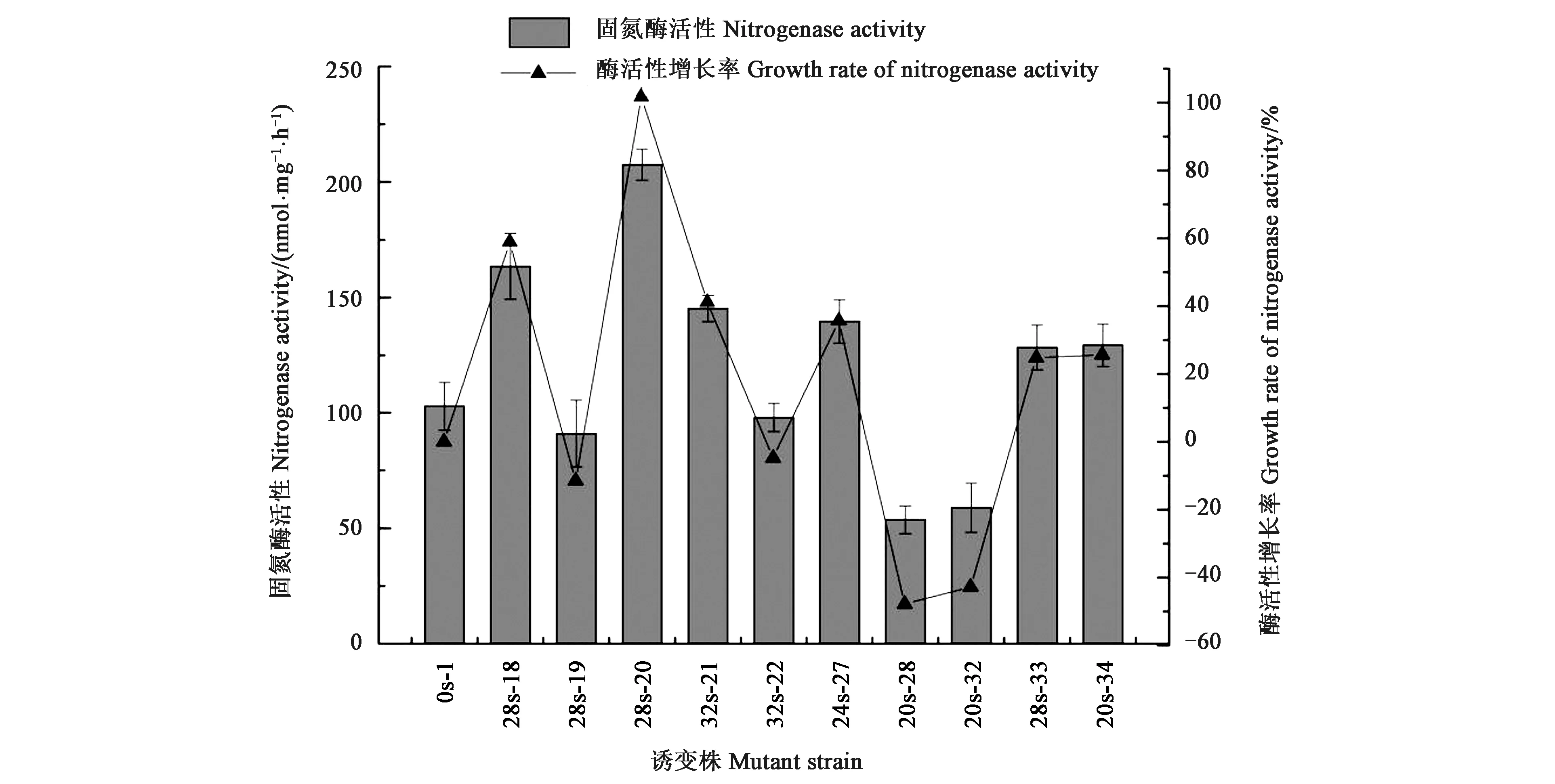
图3 初筛诱变菌株的固氮酶活性及增长率
2.2.3菌株28s-20的遗传稳定性分析 为了验证筛选得到的最优突变菌株的遗传稳定性,对28s-20进行传代培养,同条件下测定发酵后的固氮酶活性,结果(图4)显示,随着传代次数的增加,固氮酶活性始终稳定在210 nmol·mg-1·h-1左右,表明突变株28s-20具有良好的遗传稳定性。
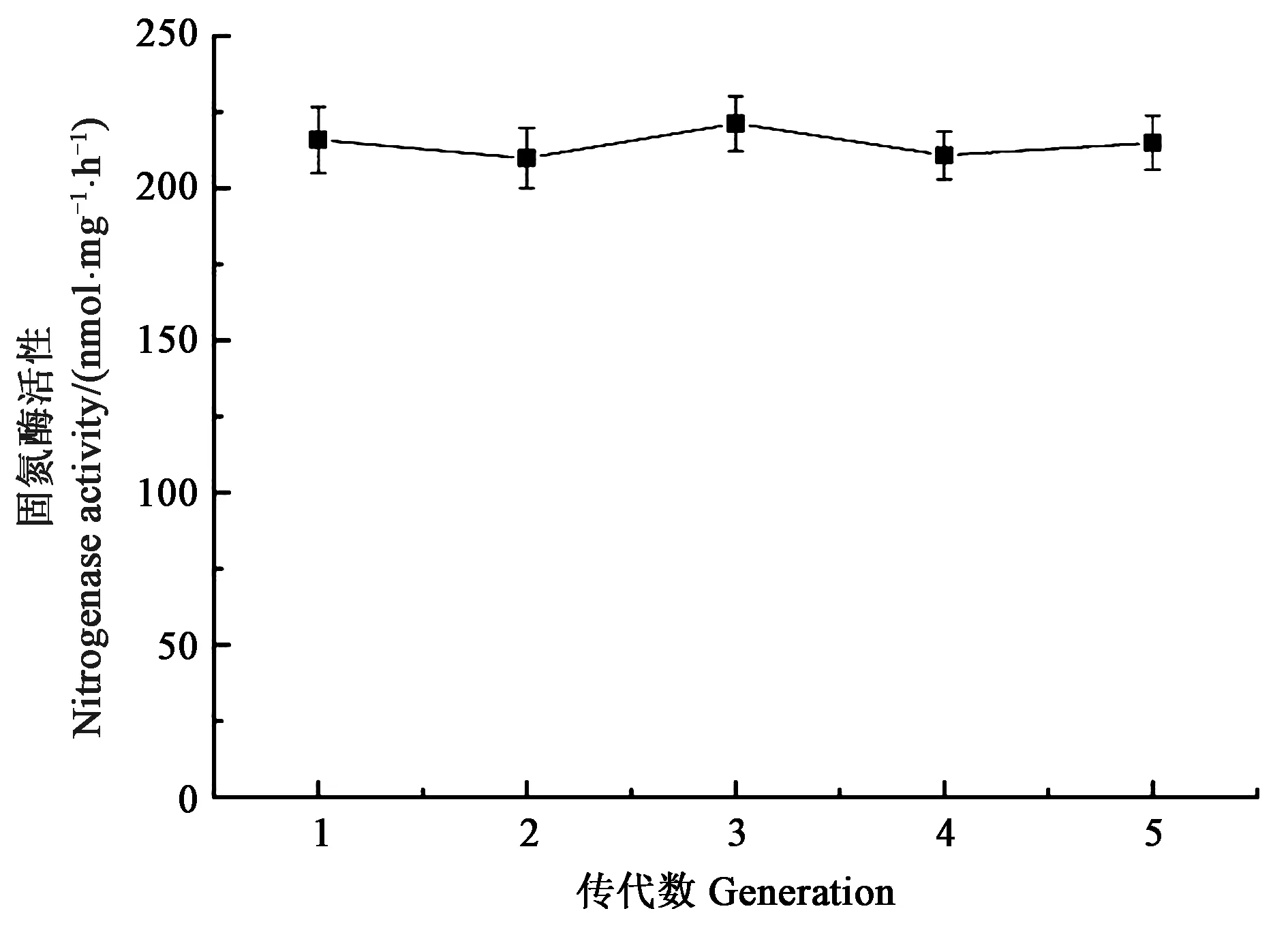
图4 连续培养5代的褐球固氮菌突变株的固氮酶活性
2.3 菌株28s-20的生物学特性
2.3.1最适生长温度不同温度的菌株生长结果见图5,可见,当培养温度为28 ℃时,野生株CICC21686和突变株28s-20的生长能力均最好,表明两株菌的最佳培养温度均为28 ℃,说明诱变对其最适生长温度未产生影响。
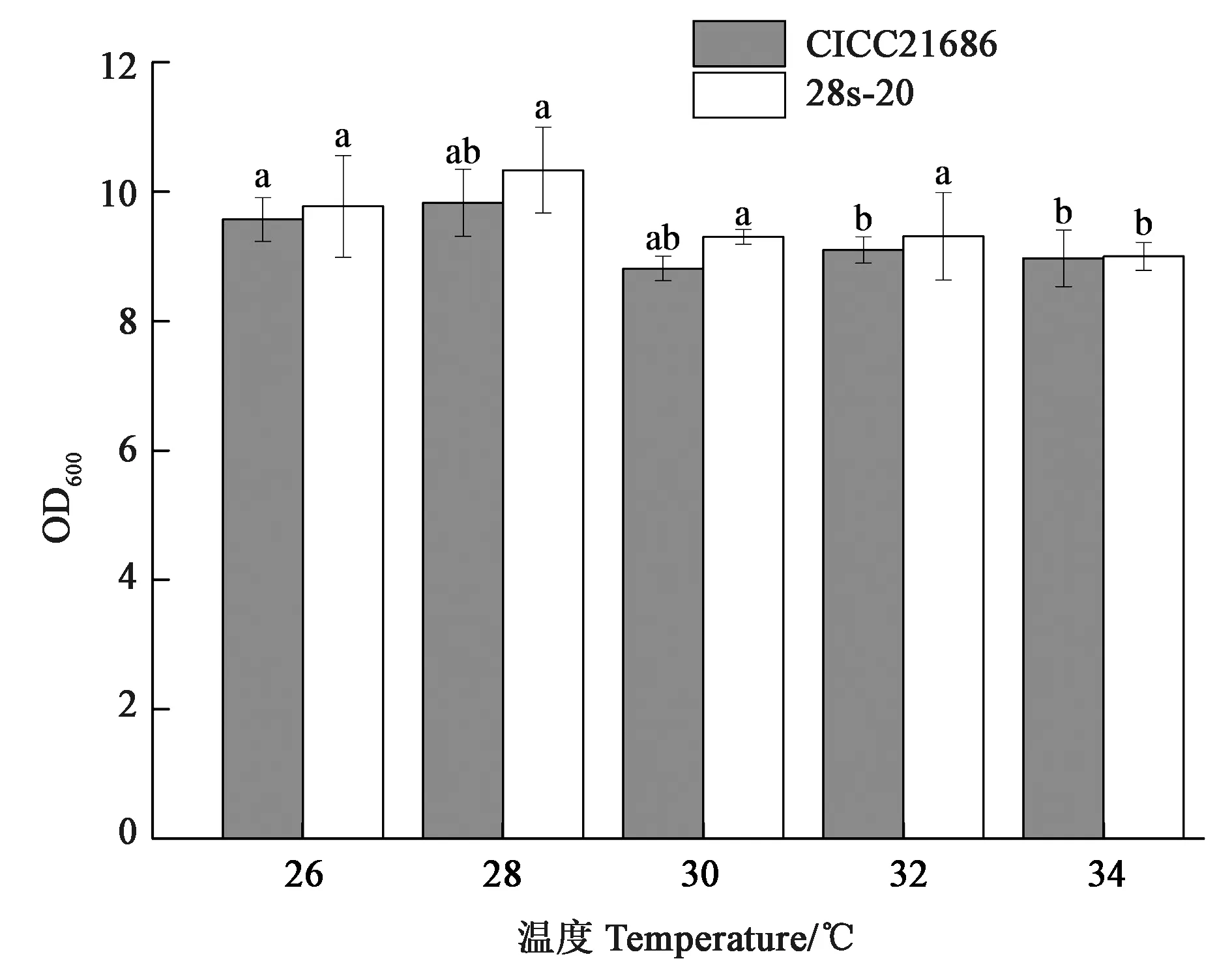
注:不同小写字母表示同一菌株不同温度间差异在P<0.05水平具有显著性。
2.3.2最适初始pH不同初始pH的野生株CICC21686和突变株28s-20菌株的生长结果见图6,可见,培养基初始pH在7.5左右时,28s-20的OD600最高,其生长能力最好,而pH升高或降低都会导致其生长能力下降。野生株CICC21686在pH 7.0~8.5培养时长势相近,说明其最适pH范围较宽,表明诱变可能提高了褐球固氮菌菌株对pH的敏感程度。

注:不同小写字母表示同一菌株不同pH间差异在P<0.05水平具有显著性。
2.4 菌株28s-20对植物生长及其固氮效能的影响
不同菌株处理的玉米植株固氮指标结果(表1)显示,接种野生株CICC21686和突变株28s-20的处理组与施用无氮培养基的对照组相比,植株干重及氮含量均显著增加(P<0.05)。而且突变株28s-20的玉米植株干重和氮含量较野生株CICC21686也均显著增加(P<0.05),植株干重及含氮量分别增加了21.16%和34.36%。表明褐球固氮菌CICC21686和突变株28s-20均能够增加玉米的固氮效能,突变株28s-20较野生株CICC21686的效果更好。
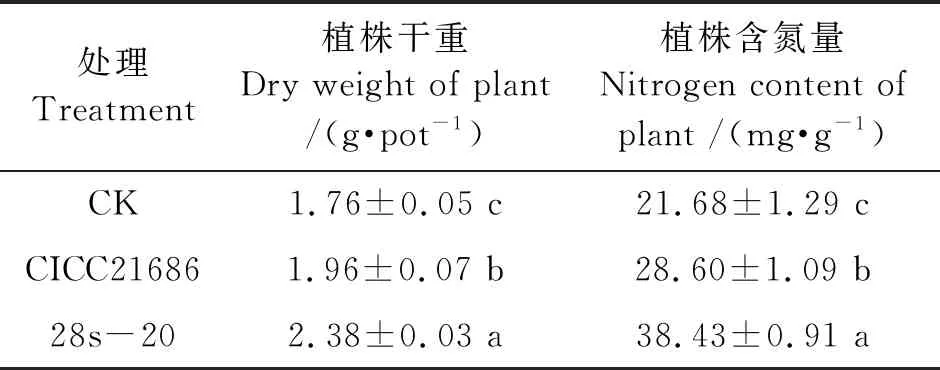
表1 褐球固氮菌处理的玉米生长及固氮指标
3 讨论
固氮菌通过其固氮酶进行生物固氮, Niu等[18]在小麦、小白菜和荷花等植物根际共分离得到30株固氮菌,其中,菌株的固氮酶活性最高的为(38.65±30.40) nmol·mg-1·h-1。孙建光等[19]在小麦、水稻等作物中分离得到92株内生固氮菌,在纯培养条件下,其固氮酶活性为0.30~254.12 nmol·mg-1·h-1,本研究获得的褐球固氮菌菌株的固氮酶活为(207.47±6.73) nmol·mg-1·h-1,高于Niu等[18]和孙建光等[19]研究的90株固氮菌。
已有许多研究证实,ARTP诱变方法具有良好筛选效果,Zhang等[20]采用ARTP诱变技术获得了木糖醇高产菌株,使其收获率提高了22%,并通过进一步生化分析表明,突变体中的相对基因表达和木糖还原酶的酶活性高于原始菌株,部分解释了木糖醇的高产率。本研究利用ARTP对褐球固氮菌进行诱变,获得的褐球固氮菌菌株28s-20的固氮酶活性较出发菌株提高了101.72%,证实ARTP诱变对褐球固氮菌具有良好的选育效果。然而,孙建光等[15]研究认为,高固氮酶活性并不总意味着高固氮效能。因此,本研究通过玉米盆栽试验对菌株的固氮效能进行了深入研究确认,证实褐球固氮菌的高酶活诱变株相对于野生菌能够显著提高玉米植株的干重和全氮量,其固氮效能可达到(38.43±0.91) mg·g-1,而蔡苗等[21]在油茶林中筛选得到的高固氮菌固氮效能最高为31.35 mg·g-1,低于本研究的固氮效能。本研究通过诱变筛选获得高固氮酶活性且遗传稳定的诱变株,并证实ARTP诱变能够显著提升其固氮效能,为提高褐球固氮菌固氮酶活性提供了有效方法。Gao等[22]通过ARTP技术诱变米曲霉(Aspergillusoryzae)3.042增强了其耐盐蛋白酶的活性,其中,耐盐碱性蛋白酶基因和天冬氨酰氨肽酶基因转录表达水平的增加,解释了突变菌株H8中蛋白酶活性的增加应部分归因于蛋白酶表达的增加。固氮酶复合物是生物中最复杂的金属酶之一[23],其通过铁蛋白与钼铁蛋白一起催化N2还原为NH3[24],关于ARTP诱变改变固氮酶活性的机制,需要进一步研究探讨。
