三种益生芽孢杆菌制备纳米硒能力研究
2021-05-20张鹏博彭晴乔宇徐小轻张宇微田丹丹黄英马蓝石波
张鹏博, 彭晴, 乔宇, 徐小轻, 张宇微, 田丹丹, 黄英, 马蓝, 石波
(中国农业科学院饲料研究所, 北京 100081)
硒是生命所必需的微量元素,具有参与机体免疫调节、预防癌症、抗氧化等重要生理功能[1]。然而我国有三分之二的人口居住在缺硒或低硒地区[2],且谷物、蔬菜、水果等天然食品中的硒含量较低,不能满足机体对于硒的日常膳食需求。根据《中国居民膳食营养素参考摄入量》[3]规定,成人硒推荐摄入量为50 μg·d-1,适宜摄入量为60 μg·d-1,可耐受最高摄入量为400 μg·d-1[3]。由于硒的生物活性范围较为狭窄,硒摄入不足或过量都会导致不良后果。硒摄入不足会导致机体生长迟缓、甲状腺功能异常[4],还可能引起克山病、大骨节病[5]等;硒摄入过量则会引起硒中毒。因此,研究者们一直在致力于寻找一种具有高活性但低毒性的补硒方式。研究表明,硒主要有3种存在方式:①无机硒盐,如Na2SeO4、Na2SeO3等;②有机硒,如硒蛋白、硒氨酸等;③纳米硒,如红色、灰色或者黑色形态的零价单质硒。已有研究表明,通过微生物法还原制备获得的纳米硒,与传统化学方法合成的纳米硒相比,尺寸更均匀,呈现规则的球状,耐高温,更稳定,不易转化成黑色或灰色纳米硒[6],更易于被机体吸收、毒性小,且具有无机硒盐与有机硒共有的功能,如抗肿瘤、抗氧化、增强机体免疫力等[7]。因此,微生物法制备的纳米硒是目前作为补硒制品的最佳选择。
据报道,一些芽孢杆菌属细菌能将Na2SeO3还原制备出纳米硒[8-11],如蜡样芽胞杆菌(Bacilluscereus)、枯草芽孢杆菌(Bacillussubtilis)、巨大芽孢杆菌(Bacillusmegaterium)、芽孢杆菌HBS4(BacillusHBS4)等。但现有报道中制备纳米硒的某些芽孢杆菌如蜡样芽胞杆菌会产生毒素且有致病性,存在安全问题,所以寻找一些既安全又具备制备纳米硒能力的菌种十分重要。近年来越来越多的芽孢杆菌属菌种被纳入益生菌范畴:如阿氏芽孢杆菌(Bacillusaryabhattai)在非洲刺槐豆种子发酵食品中作为发酵调味剂[12],可产生靶向自诱导信号分子Autoinducer-2 ,促进食物在碱性条件下发酵[13],可提高虾对于弧菌病的先天性免疫与抗氧化活性[14];解淀粉芽孢杆菌(Bacillusamyloliquefaciens)可改善肠道微生态环境、增强免疫力、降低养殖污染[15];凝结芽孢杆菌(Bacilluscoagulans)可调节肠道内菌群平衡、促进营养物质代谢和利用、提高免疫力,此外还具有耐高温、耐酸和耐胆盐等特性,同时具有乳酸菌产乳酸的特性[16]。比起一些传统的肠道益生菌,如乳杆菌、双歧杆菌等,芽孢杆菌具有存活力强、培养方式简单、生长快速等优点,同时由于芽孢杆菌具有热稳定性,可以在食品、饲料、医药制品的加工环节中添加。因此,假如将益生芽孢杆菌还原制备纳米硒的性能与其益生功效相结合,则服用少量的益生芽孢杆菌硒复合物,即可为人体补充足量的硒元素,且吸收效果好、毒性低,同时还能促进机体肠道健康,从多方面提高了机体免疫力,大大降低癌症及其他多种病的患病率,提高生命质量。到目前为止,尚未有利用阿氏芽孢杆菌或解淀粉芽孢杆菌合成纳米硒的报道;虽然凝结芽孢杆菌有关于耐硒筛选及培养条件优化报道[17],但该研究并没有对其合成纳米硒能力进行全面分析;另外对于不同的芽孢杆菌菌株,其还原制备纳米硒能力是否相同仍需进一步确定。
因此,本研究以阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9为研究对象,研究其还原Na2SeO3制备纳米硒的产率、Na2SeO3转化率、纳米硒提取率、纯度及形貌表征等,筛选适合于制备纳米硒的益生芽孢杆菌,为益生芽孢杆菌转化无机硒及有益廉价硒源的研究提供理论支持。
1 材料与方法
1.1 试验材料
1.1.1菌种阿氏芽孢杆菌SI9(Bacillusaryabhattai,CGMCC 16196),由中国农业科学院饲料研究所功能碳水化合物课题组从广西富硒大蒜中筛选获得。解淀粉芽孢杆菌AT34(Bacillusamyloliquefaciens,CGMCC 15480),由中国农业科学院饲料研究所功能碳水化合物课题组从健康仔猪粪便中筛选获得。凝结芽孢杆菌LB-9(Bacilluscoagulans,CGMCC 1.10823)购自中国普通微生物菌种保藏管理中心。
1.1.2培养基及试剂LB培养基:1% 氯化钠、1%胰蛋白胨、0.5%酵母提取物;改良LB培养基: 1% 氯化钠、1%胰蛋白胨、0.5%酵母提取物、0.5%葡萄糖;LB或改良LB固体培养基:液体培养基基础上,添加2%琼脂。
胰蛋白胨、酵母提取物,购自英国Oxoid公司;氯化钠,购自西陇科学股份有限公司;琼脂粉,购自北京双旋微生物培养基制品厂;正辛醇、十二烷基硫酸钠,购自国药集团化学试剂北京有限公司;氯仿、浓盐酸、无水乙醇,购自北京化工厂;Tris,购自北京索莱宝生物科技有限公司;盐酸羟胺、氟化钠、草酸钠、乙二胺四乙酸,购自天津市福晨化学试剂厂;2.5%戊二醛固定液,购自北京雷根生物技术有限公司;2,3-二氨基萘,购自麦克林公司。
1.1.3主要试验仪器台式离心机(SIGMA3K15,曦玛离心机有限公司),立式压力蒸汽灭菌器(LDZX-50FBS,上海申安医疗器械厂),超净工作台(SW-CJ-2FD,上海博讯实业有限公司医疗设备厂) ,生化培养箱(ZXSD-R1090,上海智城分析仪器制造有限公司),酶标仪(Epoch2,美国BioTek公司),分析天平(AR2140,美国Ohaus公司),恒温振荡器(THZ-D,太仓市实验设备厂),超声波细胞粉碎机(SCIENTZ-ⅡD,宁波新芝生物科技股份有限公司),冷冻干燥机(FD-1A-50,北京博医康实验仪器有限公司),日立冷场发射扫描电子显微镜(SU8010,日本 Hitachi公司)。
1.2 种子液的制备
将保存在-20 ℃的菌株于固体平板上划线,培养 24 h(阿氏芽孢杆菌SI9:LB培养基、30 ℃;解淀粉芽孢杆菌AT34:LB培养基、37 ℃;凝结芽孢杆菌LB-9:改良LB培养基、37 ℃),用接种环挑取单菌落接种于各自对应的液体培养基中,培养 16~18 h,以质量体积比2%接种量接种于各自对应的液体培养基中,培养24 h,得到菌株的种子液。
1.3 芽孢杆菌还原转化Na2SeO3产物的提取
Na2SeO3产物的提取参照Mohammad等[18]的方法进行。分别将三株菌种种子液按体积分数1%接种量接种于200 mL含Na2SeO3200 μg·mL-1的液体培养基中,180 r·min-1培养36 h。将培养液4 000 r·min-1离心10 min,保留沉淀; 沉淀物用质量体积分数0.9% NaCl溶液洗涤;之后用浓HCl浸泡样品24 h;离心去除浓HCl后加水洗涤,超声破碎30 min;然后用含 1% SDS的1.5 mol·L-1Tris/HCl 缓冲液(pH 8.3)连续离心洗涤 3 次,沉淀物重悬于4 mL超纯水中;加入2 mL正辛醇,剧烈摇晃, 2 000 r·min-1离心5 min后溶液分层,放入4 ℃冰箱静置24 h; 产生的纳米硒沉淀于离心管底部,细胞碎片悬浮于两相之间, 将上层溶液用移液枪吸去,沉降的纳米硒颗粒依次用氯仿、乙醇、和无菌水洗涤,最后将纳米硒颗粒重悬于超纯水中,保存于 4 ℃冰箱中,用于进一步表征和分析测定。
1.4 不同Na2SeO3浓度对菌株生长的影响
由于随着培养时间的增加菌株发酵液逐渐变红,本研究采用称重法分别测定阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9在不同浓度Na2SeO3培养基中的生长曲线,且由于Na2SeO3毒性较大,为确定不同Na2SeO3浓度对菌株生长的影响及在一定条件下的单质硒产率与Na2SeO3转化率最高的Na2SeO3添加量,使Na2SeO3尽量不残留,同时结合已有的通过细菌还原Na2SeO3为纳米硒的研究报道中采用Na2SeO3浓度多为200 μg·mL-1左右,同时为了确定Na2SeO3浓度的提高对菌株生长、单质硒产率与Na2SeO3转化率的影响,设置了200、300、400 μg·mL-13个Na2SeO3浓度。
用无菌水将菌株种子液的光密度值(OD600)调整到0.6左右,分别将三株菌液按体积分数1%接种量接种于含Na2SeO30、200、300、400 μg·mL-1的液体培养基中,180 r·min-1培养72 h,每隔一段时间,取出菌液5 mL,离心去上清后称重,设置3个重复,以时间为横坐标、重量为纵坐标,绘制生长曲线图。计算不同菌株的初始生长速率与生长抑制率,初始生长速率即菌株生长曲线初始时的斜率,菌株生长抑制率计算公式如下。
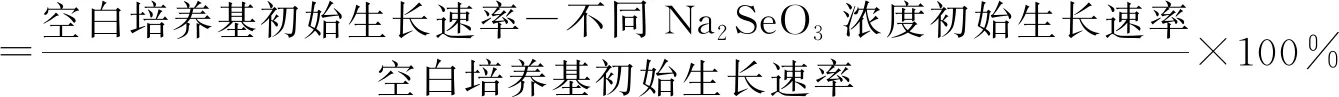
(1)
1.5 不同芽孢杆菌制备纳米硒能力比较
用无菌水将菌株种子液的光密度值(OD600)调整到0.6左右,分别将3株菌液按体积分数1%的接种量接种于含Na2SeO3200、300、400 μg·mL-1的液体培养基中,180 r·min-1培养72 h,每隔一段时间,取出菌液5 mL,12 000 r·min-1离心分离沉淀与上清,分别测定沉淀中纳米硒含量和上清中Na2SeO3残留量,同时设置空白对照(即不加Na2SeO3),每个处理3次重复。分别以时间为横坐标,纳米硒产率与Na2SeO3转化率为纵坐标,绘制曲线图。
1.5.1Na2SeO3标准曲线的制作 参照Biswas等[19]方法,将10 mL 0.1 mol·L-1HCl、0.5 mL 0.1 mol·L-1EDTA、0.5 mL 0.1 mol·L-1NaF、0.5 mL 0.1 mol·L-1草酸钠混在25 mL刻度试管中,分别加入0、50、100、150、200、250 nmol Na2SeO3,再加入2.5 mL含0.1% 2,3-二氨基萘的0.1 mol·L-1HCl(避光),40 ℃水浴40 min,冷却至室温后加6 mL环己烷,剧烈摇晃1 min分层,377 nm测吸光度,3次重复。
1.5.2Se0标准曲线的制作 参照Kessi等[20]方法并有所改变。于试管中分别加入0、2、4、6、8、10 μmol Na2SeO3,再加入25 μmol NH2OH·HCl、1 mL Na2S,轻轻混匀,1 h后500 nm测吸光度,3次重复。
1.5.3样品上清液中Na2SeO3含量的测定 取5 mL发酵液,离心后留上清,加100 μL上清液,其他操作同1.5.1 中Na2SeO3标准曲线的制作过程,根据吸光度来计算样品上清液中Na2SeO3浓度,同时计算Na2SeO3转化率,计算公式如下。
Na2SeO3转化率=
(2)
1.5.4样品沉淀中硒含量的测定取5 mL发酵液,离心后去上清,沉淀分别用1 mL 0.1 mol·L-1Tris-HCl(pH 8.0)洗涤,再用2 mL 1 mol·L-1NaCl洗两次(5 000 r·min-1离心10 min),加2 mL 1 mol·L-1Na2S,1 h后500 nm测吸光度,根据吸光度来计算样品培养物中纳米硒的量,同时计算纳米硒产率,计算公式如下。

(3)
1.6 三株菌株提取纳米硒的纯度及提取率
分别将3株菌种种子液按体积分数1%接种量接种于200 mL含Na2SeO3200 μg·mL-1的培养基中, 180 r·min-1培养36 h,收集发酵液进行纳米硒的提取,提取后冷冻干燥,并测定其硒含量,3次重复,方法与1.5.4相同,计算纯度及提取率,计算公式如下。

(4)

(5)
1.7 场发射扫描电镜观察样品形态
参考Saini等[21]的方法并有所改变。分别取1 mL菌体沉淀及提取的纳米硒颗粒用 pH 7.4的PBS缓冲液洗涤3次。然后,加入1 mL的2.5%戊二醛固定液混匀,4 ℃过夜固定。水洗三次,分别浸泡4、5、6 min,然后,用梯度乙醇(50%、70%、85%和95%)进行连续脱水,每次14 min,最后用无水乙醇脱水3次,每次15 min。临界点干燥,表面镀金,扫描电镜观察。
1.8 数据统计与分析
试验数据用Microsoft Excel 2010软件进行整理和绘图,用SPSS 13.0软件进行显著性分析。
2 结果与分析
2.1 三株益生芽孢杆菌还原制备红色纳米硒结果

注:1—阿氏芽孢杆菌SI9空白培养液;2—含200 μg·mL-1 Na2SeO3和阿氏芽孢杆菌SI9的培养液;3—解淀粉芽孢杆菌AT34空白培养液;4—含200 μg·mL-1 Na2SeO3和解淀粉芽孢杆菌AT34的培养液;5—凝结芽孢杆菌LB-9空白培养液;6—含200 μg·mL-1 Na2SeO3和凝结芽孢杆菌LB-9的培养液。
2.2 不同Na2SeO3浓度对益生芽孢杆菌生长的影响
不同Na2SeO3浓度不同芽孢杆菌的重量结果(图2)可知,在24 h 之后,阿氏芽孢杆菌SI9在200、300、400 μg·mL-1Na2SeO3浓度下的重量较空白处理下降,而解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9在不同Na2SeO3浓度下的重量与空白处理无差异。表明在较高Na2SeO3浓度条件下,阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9对Na2SeO3均表现出较强的耐受能力。
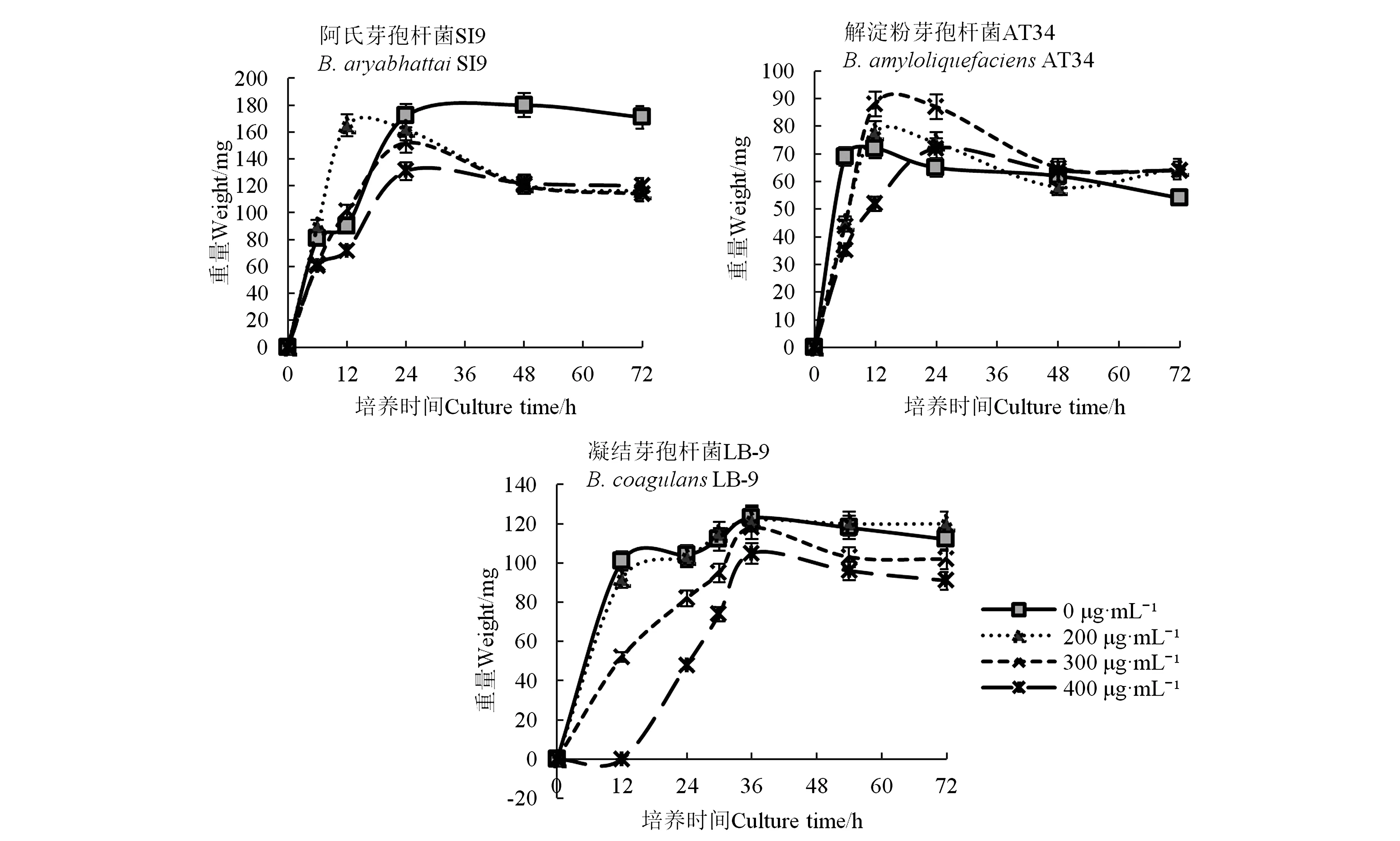
图2 Na2SeO3对三株益生芽孢杆菌菌株生长的影响
由表1可知,与空白对照相比,除阿氏芽孢杆菌SI9在Na2SeO3浓度为200 μg·mL-1时外,其余两个菌株的生长均随着Na2SeO3含量的增加而变缓, 说明Na2SeO3会抑制菌株生长,且浓度越高,抑制性越强。较高浓度的Na2SeO3虽然对上述三株芽孢杆菌的生长产生了一定的抑制作用,但细胞活性并没有被完全杀死,菌株仍可以在高浓度的硒溶液下存活。其中,阿氏芽孢杆菌SI9在含200 μg·mL-1Na2SeO3培养基中生长速率加快,表明该菌的生长并未被低浓度Na2SeO3抑制,亦反映出该菌对于Na2SeO3的耐受能力较强。三株芽孢杆菌中,阿氏芽孢杆菌SI9在不同Na2SeO3浓度培养基中的生长抑制率比较稳定,且生长抑制率均较低;而凝结芽孢杆菌LB-9的生长抑制率最高,Na2SeO3浓度为400 μg·mL-1时,生长抑制率达到100%;解淀粉芽孢杆菌AT34的生长抑制率居中。因此,对于高浓度Na2SeO3耐受能力最好的为阿氏芽孢杆菌SI9,凝结芽孢杆菌LB-9耐受力最差。
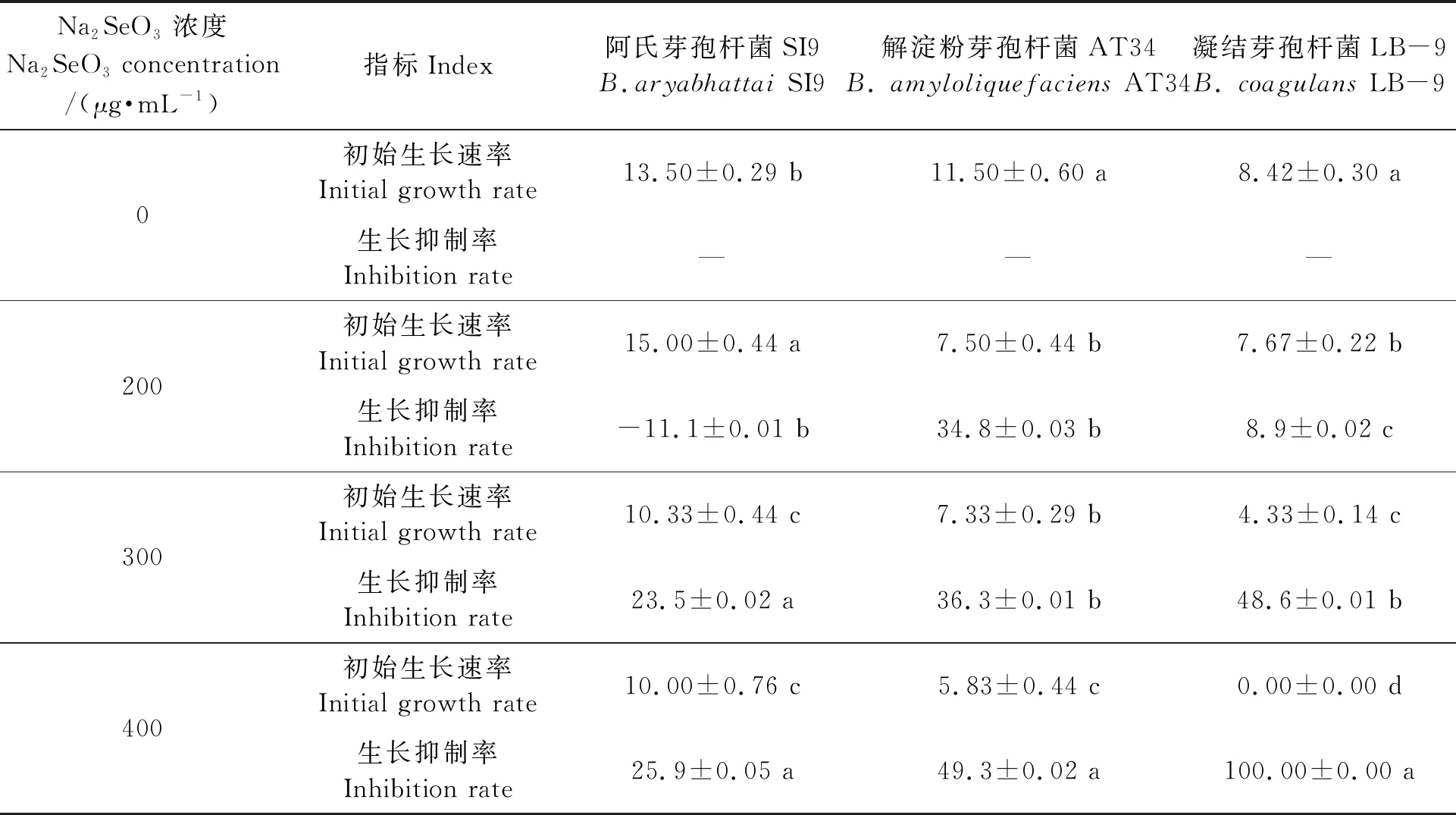
表1 不同Na2SeO3浓度下三株益生芽孢杆菌菌株的初始生长速率和生长抑制率
2.3 益生芽孢杆菌还原制备红色纳米硒能力比较
2.3.1Na2SeO3标准曲线与Se0标准曲线 为定量测定培养基中Na2SeO3含量以及微生物还原制备出的纳米硒含量,分别作出Na2SeO3标准曲线和Se0标准曲线(图3)。得到Na2SeO3的标准曲线方程为:y=0.001 6x-0.006 6,R2为0.996 8,得到的Se0标准曲线为:y=0.069 3x+0.003 9,R2为0.999 2。上述两条标准曲线的R2值均大于 0.99,表明两条标准曲线均具有良好的线性关系。
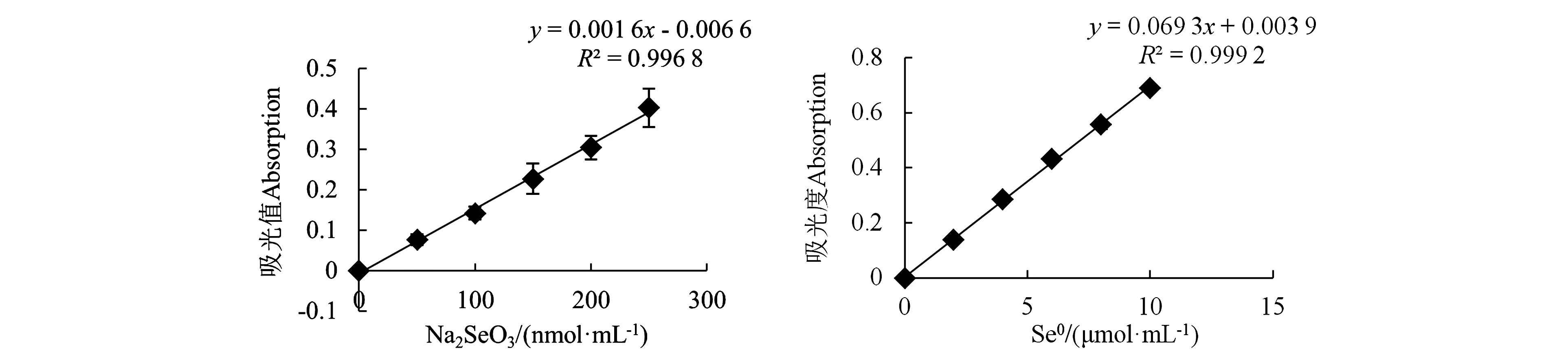
图3 Na2SeO3和Se0的标准曲线
2.3.2不同Na2SeO3浓度下不同菌株的纳米硒产率与Na2SeO3转化率 由图4可知, 当Na2SeO3浓度为200 μg·mL-1时,随着培养的时间增加,阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9的纳米硒产率逐步增加,分别在24、24、36 h达到最高,产率分别为48.3%、36.3%、34.8%。Na2SeO3的转化率也随着培养时间的增加逐步升高,且在24 h时,三株菌株的Na2SeO3转化率均达到100%,表明Na2SeO3已被完全还原,无残留。
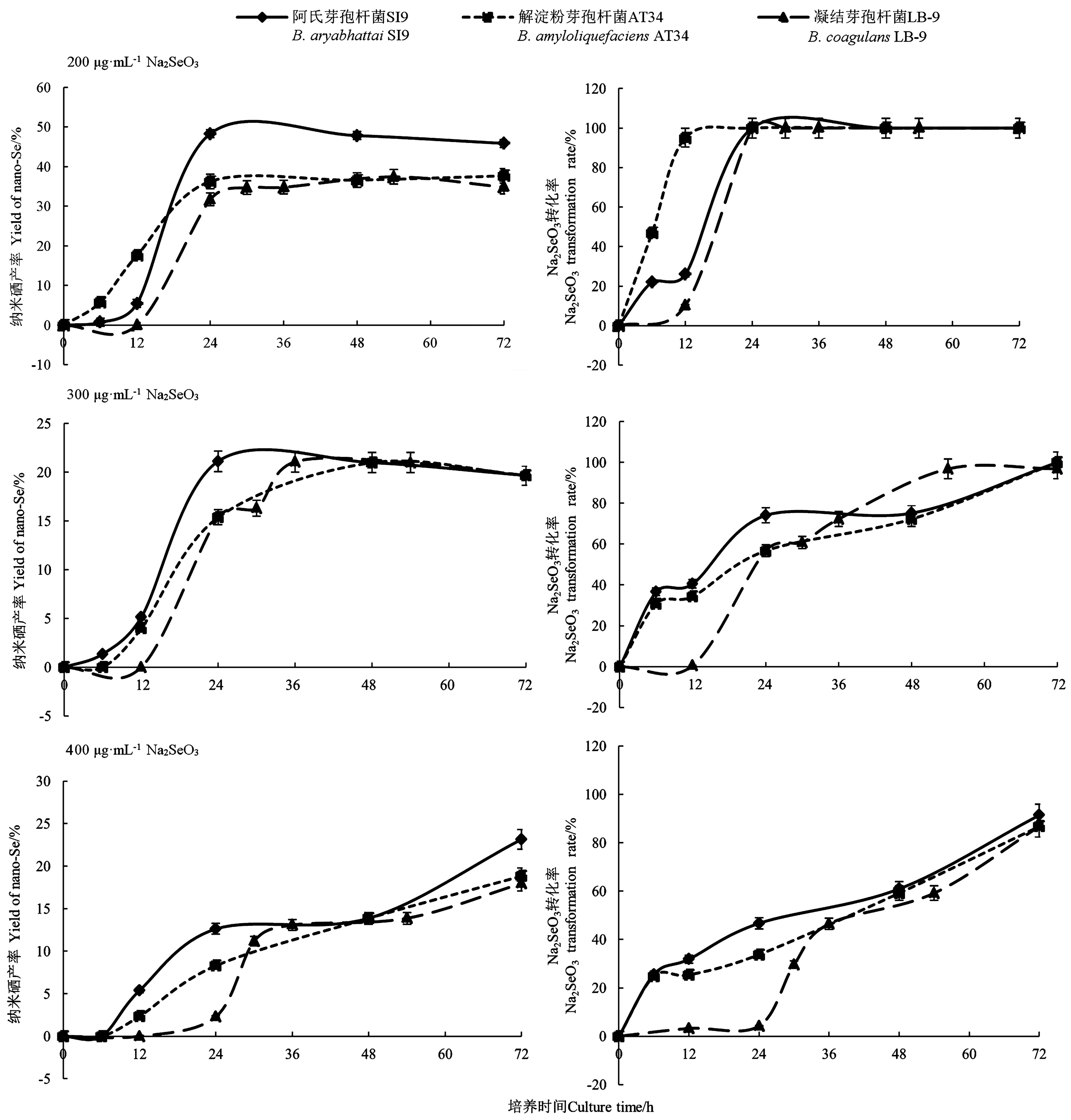
图4 不同Na2SeO3浓度下三株菌株的纳米硒产率和Na2SeO3转化率
当Na2SeO3浓度为300 μg·mL-1时,随着培养时间的增加,阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9的纳米硒产率逐步增加,分别在24、48、36 h达到最高,产率分别为21.1%、21.0%、21.1%。可见,当Na2SeO3浓度为300 μg·mL-1时,三株菌株的产纳米硒能力差别不大,且阿氏芽孢杆菌SI9达到最高产率的用时最短。Na2SeO3转化率也随着培养时间的增加而逐步升高;且在72 h时,阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34的Na2SeO3转化率达到100%,表明Na2SeO3已被完全还原,无残留;而凝结芽孢杆菌LB-9中Na2SeO3仍有少量残留,Na2SeO3转化率为97.0%。
当Na2SeO3浓度为400 μg·mL-1时,随着培养时间增加,阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34、凝结芽孢杆菌LB-9的纳米硒产率逐步增加。72 h时,纳米硒产率分别为23.2%、18.8%、18.0%。随着培养时间增加, Na2SeO3的转化率逐渐升高,但在培养结束时, Na2SeO3未被完全还原,有残留,三株菌株的Na2SeO3转化率分别为91.4%、86.8%、86.8%。
综上,当增加Na2SeO3浓度时,三株菌株的纳米硒产率并未增加,甚至在下降,过高的Na2SeO3浓度,导致Na2SeO3不能被完全还原,转化率降低,同时产纳米硒的速率也下降。由于Na2SeO3毒性较大,应尽量使其完全还原,不残留。同时,培养时间为36 h时,三株菌株的纳米硒产率已为最高。 所以选择200 μg·mL-1为合适的Na2SeO3浓度,培养时间选择36 h。此时,产纳米硒能力最好的为阿氏芽孢杆菌SI9,解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9次之。
2.3.3三株菌株提取纳米硒的纯度及提取率
从含200 μg·mL-1Na2SeO3的阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34、凝结芽孢杆菌LB-9的培养液中提取纳米硒颗粒,经冷冻干燥后称重,质量分别为25.6、18.2、15.4 mg,其中的纳米硒含量分别为18.74、14.22、13.76 mg。可得,阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9提取的纳米硒颗粒纯度和提取率(图5)。可见,凝结芽孢杆菌LB-9提取的纳米硒纯度最高,显著高于解淀粉芽孢杆菌AT34和阿氏芽孢杆菌SI9;解淀粉芽孢杆菌AT34提取的纳米硒纯度显著高于阿氏芽孢杆菌SI9。阿氏芽孢杆菌SI9的提取率最高,显著高于解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9,而后两者之间无显著差异。上述提取的红色纳米硒粉末,在室温下放置1个月后,颜色基本不变,仍呈红色,说明其稳定性较好,不易被氧化为黑色或褐色纳米硒。

注:不同小写字母表示不同菌株间的差异在P<0.05水平具有显著性。
2.4 场发射扫描电镜观察菌体和纳米硒形貌
为确认阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9菌体及纳米硒的形貌,通过冷场发射扫描电镜观察菌株在不含或含Na2SeO3培养基中生长的情况。结果(图6)显示,在不含Na2SeO3培养基中生长的菌株细胞呈直杆状,表面光滑,菌体周围无颗粒物(图6A、6D、6G);当菌株在含200 μg·mL-1Na2SeO3培养基中生长时,发现在其细胞周围出现了许多球状颗粒,这些球状颗粒不仅无规则地分布在细胞表面,而且有的散落在培养基上(图6B、6E、6H);而且从提取后的纳米硒扫描电镜图(图6C、6F、6I)可看出,提取获得的硒颗粒呈规则的球状颗粒,因此可判断分布在菌体周围的球状颗粒为纳米硒颗粒。通过测量扫描电镜图(图6C、6F、6I)中的纳米硒颗粒直径发现,经阿氏芽孢杆菌SI9制备的纳米硒颗粒尺寸分布在100~500 nm之间,经解淀粉芽孢杆菌AT34制备的纳米硒颗粒尺寸分布在150~450 nm之间,经凝结芽孢杆菌LB-9制备的纳米硒颗粒尺寸分布在70~500 nm之间。此外,还能看出在含200 μg·mL-1Na2SeO3培养基中生长的解淀粉芽孢杆菌和凝结芽孢杆菌的菌体出现了轻微变形或破损现象(图6E、6H),推测可能是受到Na2SeO3毒性的影响,而阿氏芽孢杆菌的菌体并无明显改变(图6B),这也与该浓度下Na2SeO3对菌株生长的抑制程度(表1)一致。从提取后的纳米硒的扫描电镜图可看出,纳米硒颗粒团聚现象明显,其中还可看到夹杂着一些芽孢和细胞碎片。

A:空白培养基的阿氏芽孢杆菌SI9;B:含Na2SeO3培养基的阿氏芽孢杆菌SI9;C:阿氏芽孢杆菌SI9制备提取的纳米硒;D:空白培养基的解淀粉芽孢杆菌AT34;E:含Na2SeO3培养基的解淀粉芽孢杆菌AT34;F:解淀粉芽孢杆菌AT34制备提取的纳米硒;G:空白培养基的凝结芽孢杆菌LB-9;H:含Na2SeO3培养基的凝结芽孢杆菌LB-9;I:凝结芽孢杆菌LB-9制备提取的纳米硒。
3 讨论
近年来,随着人们对于科学补硒的日益关注,利用微生物转化Na2SeO3制备纳米硒的研究非常多,研究涉及的微生物包括乳酸菌和芽孢杆菌类等细菌。李丹等[22]研究发现,沼泽红假单胞菌(Rhodopseudomonaspalustris)在Na2SeO3浓度为1 mmol·L-1(173 μg·mL-1)时的Na2SeO3转化率为100%,在Na2SeO3浓度为2 mmol·L-1(346 μg·mL-1)时的Na2SeO3转化率则降为80%。本研究中,阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9在Na2SeO3浓度为200 μg·mL-1时Na2SeO3转化率均为100%;在Na2SeO3浓度为300 μg·mL-1时,三者的Na2SeO3转化率分别为100%、100%、97%;在Na2SeO3浓度为400 μg·mL-1时,三者的Na2SeO3转化率分别为91.4%、86.8%、86.8%。随着Na2SeO3浓度的升高,上述菌株的Na2SeO3转化率均逐渐下降。然而,可以发现三株益生芽孢杆菌在高Na2SeO3浓度下的转化能力均高于沼泽红假单胞菌。说明阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34与凝结芽孢杆菌LB-9的转化Na2SeO3能力较强,若是经过培养优化后,其转化能力应该能有所提升。由于Na2SeO3毒性较大,在微生物转化合成纳米硒的过程中,应尽量提高Na2SeO3转化率,因此需要选择合适的Na2SeO3浓度。本研究发现,阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9的合适Na2SeO3浓度为200 μg·mL-1,此浓度下Na2SeO3转化率均为100%,且其纳米硒产率也未较300、400 μg·mL-1Na2SeO3浓度的产率低。
本研究中,阿氏芽孢杆菌SI9、解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9对于低浓度Na2SeO3的转化率均能达到100%,然而其纳米硒产率却不足50%,说明其转化的大部分Na2SeO3可能以有机硒形式存在,如何提高Na2SeO3转化为纳米硒的效率,仍需深入研究。而且随着时间的增加,纳米硒产率有下降的趋势,可能是因为菌株又将单质硒转化为其他硒形式,具体仍需进一步研究。此外,本研究提取的纳米硒颗粒纯度不高,其中包含一些细胞碎片和芽孢,仍需要改进方法来提高其提取纯度。 Xu等[23]利用干酪乳杆菌制备的纳米硒粒径在50~80 nm之间; Eszenyi等[24]利用乳酸菌制备的纳米硒粒径在100~500 nm之间;刘红芳[25]利用乳酸菌LA4制备的纳米硒粒径在50~200 nm 之间;周驰[26]采用生防菌枯草芽孢杆菌制备纳米硒粒径在50~250 nm。本研究制备的纳米硒颗粒尺寸在70~500 nm之间,与已有报道结果一致。
通过益生芽孢杆菌将高毒性的Na2SeO3转化为低毒性且生物利用率高的纳米硒和有机硒,将是一种更为科学的补硒趋势。这样一方面可以起到补硒的作用,另一方面芽孢杆菌本身带有的益生菌功效将对肠道健康起到促进作用。本研究选用的三株益生芽孢杆菌中,阿氏芽孢杆菌SI9比解淀粉芽孢杆菌AT34和凝结芽孢杆菌LB-9表现出显著的优越性。然而作为一种食品或饲料添加剂,其本身以及合成的纳米硒对于人或者动物的毒性以及毒副作用需要更为全面的检测和评估,对于阿氏芽孢杆菌SI9的发酵优化也需要进一步研究。
